荧光标记解淀粉芽孢杆菌WK1在山核桃树体和土壤中的定殖规律
高 竞,方 伟,顾佳悦,严淑娴,邵 帅,梁辰飞,秦 华,陈俊辉,徐秋芳
(浙江农林大学 环境与资源学院,浙江省森林生态系统碳循环与固碳减排重点实验室,浙江 杭州 311300)
山核桃(CaryacathayensisSarg.)主要分布在浙江、安徽和福建等地。由葡萄座腔菌(Botryosphaeriadothidea)引起的山核桃干腐病是山核桃上最严重的病害之一。近年来,山核桃干腐病病情越来越严重,部分地区的发病率达到80%~90%,造成大面积林地死亡,严重制约了山核桃产业的发展[1]。目前,防治山核桃干腐病主要采取化学防治和物理防治的手段[2],但是大量使用化学农药导致病原菌产生抗药性,且易造成环境污染;而物理防治又易对树体造成创伤,且不能解决根本问题[3]。因此,生物防治植物病害的探索近年来成为相关研究的热点。刘凤英[4]从小麦新鲜根分离内生菌,在防治小麦纹枯病上取得了较好的效果;宋光桃等[5]从油茶林土壤中分离出对油茶炭疽病具有拮抗作用的放线菌CF17;司美茹[6]从青海省5个县的土壤中分离得到4株木霉菌、10株毛壳菌和2株放线菌,发现其对辣椒疫病均具有较好的抑制效果。然而,有关山核桃干腐病生物防治技术的报道还甚少。
当前,植物病害生物防治中应用较多的生防菌主要有木霉菌[7]、芽孢杆菌[8-10]、丛枝菌根真菌、毛壳菌等。芽孢杆菌是自然环境中广泛存在的一类菌群,对许多植物病原菌具有较好的防病效果,被广泛用作生防制剂[11-12]。研究人员现已围绕芽孢杆菌生防菌的鉴定与筛选、促生作用、抗菌机制、防病能力与定殖效果等开展研究[13-15]。常文智等[16]发现,解淀粉芽孢杆菌(Bacillusamylolyticus)能够提高土壤酶活性,改善土壤微生物区系,从而提高土壤肥力,同时还对植物有促生作用和抗病作用,其中的活性物质是脂肽类和聚酮类化合物的次级代谢产物[17]。在抗菌化合物中,环状脂肽(LPs),包括表面活性素surfactin、iturin和fengycin家族等赋予芽孢杆菌在植物根表定殖的能力[18]。实际应用中,生防菌常受环境因素影响,生防效果的稳定性差异较大。如果生防菌能在植物体内长期定殖,其生防效果就更能得到保证。
解淀粉芽孢杆菌WK1是作者团队从土壤中筛选获得的优良菌株。前期室内试验表明,该菌株对葡萄座腔菌具有较好的抑制效果,且具有抑制多种植物病原菌的能力[19],可用作山核桃干腐病的潜在生防菌。将用该菌株制成的菌液涂抹于发病树树干上有较好的控制效果,但山核桃树干溃疡的病斑很多,菌液涂抹的工作量太大,不适合大面积推广。如果WK1菌株能定殖到根系表面或植物体内则可起到植物自身免疫的作用。绿色荧光蛋白(GFP)标记[20]在实时、原位研究微生物的空间定位、微生物与环境和宿主的相互作用等方面展示了良好的应用前景[21-23]。为探寻WK1菌株在植物体内和土壤中有效定殖的施用技术,本研究应用GFP标记法,开展盆栽试验,探寻适宜WK1定殖的土壤pH值范围,并在林地中使用不同的接种方式,寻找最佳的菌液施用方法。
1 材料与方法
1.1 试验材料
解淀粉芽孢杆菌WK1,菌种保藏号CGMCC No.11640。病原菌葡萄座腔菌系本实验室分离保存。pNW33n-gfp质粒由南京农业大学资源与环境学院提供。
1.2 GFP-WK1菌株的构建与检验
1.2.1 GFP-WK1菌株的荧光效果与基因检验
WK1的电击转化参考亓雪晨等[24]的方法。将转化后的菌株立即移入LB复苏液试管中,在30 ℃、180 r·min-1的恒温摇床上振荡培养3 h,涂布在含有氯霉素的LB固体培养基平板上,30 ℃培养24 h。用接种环挑取少量菌体涂片固定,在荧光显微镜下观察,标记成功的会有明亮绿光。将转化子提取质粒利用gfp基因特异性引物(ATGAGTAAAGGAGAAGAACT、TTATTTGTATAGTTCATCCATG)进行PCR验证,将成功标记的菌株命名为GFP-WK1。引物合成与基因测序工作均由生工生物工程(上海)股份有限公司完成。
1.2.2 GFP-WK1菌株的遗传稳定性测定
挑取转化子单菌落进行平板划线,30 ℃培养24 h,以未标记菌株WK1为对照,在SteREO Discovery.V12体式荧光显微镜(德国Carl Zeiss)下检测荧光。活化GFP-WK1,按照0.1%(体积分数)的比例转接于LB液体培养基中,30 ℃、180 r·min-1振荡培养5 h;再以相同比例将菌液转接于LB液体培养基,相同条件重复培养10次。每次转接前,梯度稀释10倍并均匀涂布于LB固体培养基平板上,于30 ℃恒温培养箱中过夜培养,统计绿色荧光的菌落数和菌落总数,计算GFP-WK1在非选择压力下的稳定性。
1.2.3 GFP-WK1菌株的生长动力学测定
挑取GFP-WK1单菌落接种至100 mL含有25 μg·mL-1氯霉素的LB液体培养基中,30 ℃、180 r·min-1过夜培养,将菌悬液浓度稀释到108CFU·mL-1,取100 μL菌液接种到含有25 μg·mL-1氯霉素的LB液体培养基中,30 ℃、180 r·min-1培养,用WK1菌株作为对照,在相同处理下培养,每4 h测量一次菌液D600值,设置4个重复,测得WK1和GFP-WK1的生长特性。
1.2.4 GFP-WK1菌株的抑菌能力测定
采用平板对峙法测定GFP-WK1菌株的抑菌能力,简述如下:采用穿刺接种法将病原菌接种在PDA平板中央,将WK1和GFP-WK1菌株分别接种至距离病原菌1.5 cm 处,并设置未接种菌株的对照CK,置于30 ℃恒温培养箱中培养,直到朝向菌株方向的病原菌菌落不再生长为止。采用十字交叉法测量菌落直径,计算抑菌率。
1.3 GFP-WK1菌株的定殖试验
1.3.1 GFP-WK1在大田山核桃树体和土壤中的定殖
在位于浙江省杭州市临安区湍口乡的山核桃林地和浙江农林大学校园内的山核桃林地开展试验。分别采用叶面喷施(喷叶法)、根系浇灌(灌根法)和树干滴注(挂液法)的方式接种GFP-WK1,菌液浓度均为4.8×109CFU·mL-1,每个处理3个重复,以无菌水处理为对照。喷叶法,使用喷雾器将菌液均匀喷于山核桃树半侧的叶片上,每株200 mL;灌根法,将200 mL菌液稀释在山核桃根部直径1 m范围内,用浇液瓶均匀地喷洒在土壤表面;挂液法,在山核桃树根部30 cm处挂200 mL菌液,使用塑料针管紧密地插入树干,避免菌液流出。分别在3、7、15、30、60 d对山核桃树的根、茎、叶和土壤进行取样,树体各部位和土壤分别取3份样品混匀。为了避免喷叶时部分液体落到土壤,采集未喷叶的另一侧土壤。将植物样品用无菌水漂洗后分为2份:一份用作茎、叶切片的原位镜检观察;另一份植物样品用作定量分析,称取山核桃根、叶部位样品0.5 g,表面使用75%(体积分数)乙醇溶液消毒5 min,无菌水漂洗5次,加入2 mL无菌水研磨成匀浆,转移到50 mL离心管,定容,摇匀振荡30 min,2次梯度稀释,吸取50 μL稀释液,涂布于氯霉素平板上,30 ℃过夜培养,荧光显微镜下统计菌株定殖数量。土壤样品浸提液涂平板后镜检观察拍照或定量读数。
1.3.2 GFP-WK1在不同pH土壤条件下的定殖规律
选择临安当地山核桃品种,采集山核桃林土壤进行盆栽试验,调节土壤pH值,设置3个处理:(1)pH=7.9,使用石灰石粉调节;(2)pH=6.8,原土壤;(3)pH=5.6,使用硫酸亚铁调节。每个处理4个重复。将长出2片真叶的山核桃幼苗移栽至盆钵(直径23 cm、高21.5 cm,内含2.0 kg土壤)中,待幼苗稳定成活后,将浓度为4.8×109CFU·mL-1的GFP-WK1菌液以3%的体积质量比接种至土壤中,定期浇水,在培养3、7、15、30、60 d时取幼苗根系土壤和植物组织,运用与1.3.1节相同的方法对样品进行处理,通过稀释涂布平板法在荧光显微镜下统计标记菌株的数量。
1.4 数据分析
采用Excel 2016软件整理所有数据,并采用SPSS 22.0软件进行数据处理,对有显著(P<0.05)差异的处理采用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 GFP-WK1的构建与特性检验
2.1.1 GFP-WK1影像观察和质粒PCR验证
用接种环挑取绿色荧光蛋白标记转化后的菌株,接种于LB固体培养基平板,30 ℃培养24 h后,荧光显微镜下检测到菌株发绿色荧光(图1)。将绿色荧光蛋白标记菌记为GFP-WK1,以菌体提取的质粒作为模板,利用设计的gfp特异性引物进行扩增,在750 bp位置得到了一条清晰条带,和预期的片段大小一致。以上结果说明,gfp基因已转入标记菌株中。
2.1.2 GFP-WK1的遗传稳定性
连续稀释培养试验表明,随着培养时间延长,质粒仍能在WK1细胞中保持稳定;继代培养10次(50 h)后,含有氯霉素抗性且会发荧光的菌株占菌落总数的比例为92%,与前人研究结果一致[25],表明质粒在WK1细胞中较为稳定。芽孢杆菌在实验室环境、营养丰富的条件下20~30 min分裂1次,在自然条件下繁殖一代所需的时间为50~100 h[26]。据此认为,标记菌株适合长时期的定殖研究。

M为DNA相对分子质量标准,1和2为GFP-WK1,3为WK1。M was DNA molecular marker, 1 and 2 were GFP-WK1, and 3 was WK1.图1 GFP-WK1在荧光显微镜下的影像(A)和GFP质粒PCR验证结果(B)Fig.1 Fluorescence microscope image of GFP-WK1 (A) and PCR inspection result of GPF plasmid (B)
2.1.3 GFP-WK1的生长曲线
从GFP-WK1菌株和未标记菌株(WK1)的生长曲线(图2)可以看出,GFP-WK1的生长趋势和WK1基本一致。这表明外源质粒的转入和绿色荧光蛋白的表达对菌株WK1的生长没有明显影响。
2.1.4 GFP-WK1的抑菌特性
通过平板对峙法比较GFP-WK1菌株和WK1菌株对葡萄座腔菌的抑制效果,由图3可知, GFP-WK1对葡萄座腔菌的抑菌效果与WK1无明显差异。以上结果说明,GFP-WK1可用来对WK1的生防效果和定殖规律进行研究。
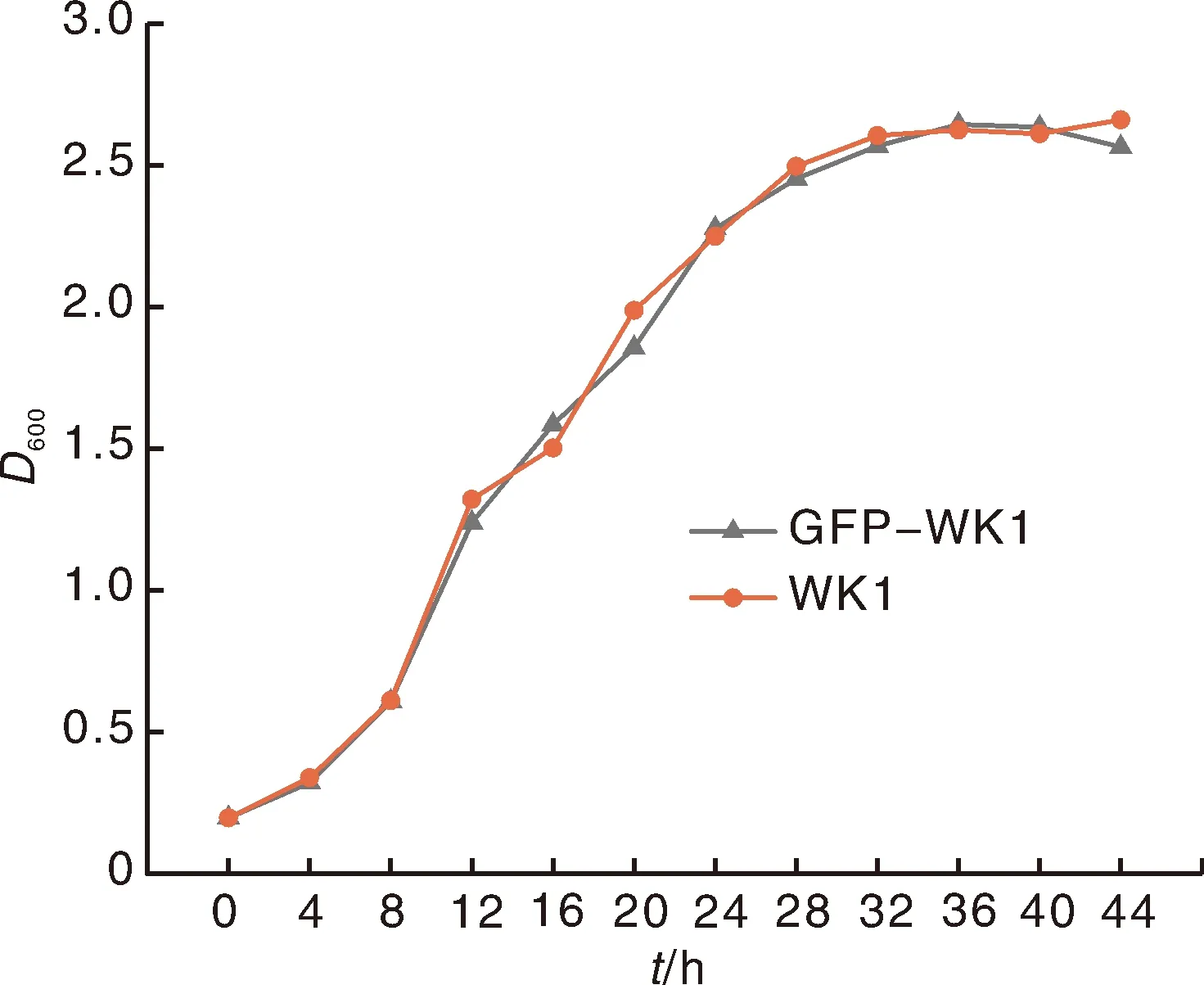
图2 WK1和GFP-WK1菌株的生长曲线Fig.2 Growth curve of WK1 and GFP-WK1
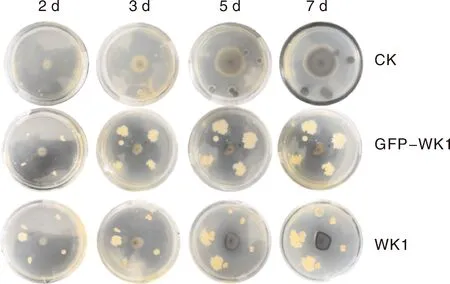
图3 未标记菌株(WK1)和GFP-WK1菌株的抑菌效果Fig.3 Bacteriostatic effect of GFP-WK1 and WKI
2.2 GFP-WK1在山核桃树体和土壤中的定殖动态
位于临安区湍口乡山核桃林地和浙江农林大学校园内的2处试验点上GFP-WK1定殖的原位观察结果如图4所示。采用喷叶法、灌根法和挂液法接种均能使GFP-WK1菌株进入植物组织并在不同组织中转移。灌根后,土壤中定殖的GFP-WK1数量丰富,喷叶法处理下叶片内的GFP-WK1数量最多(部分图片未呈现)。
2.2.1 不同方法接种后GFP-WK1的定殖动态
对浙江农林大学校园内试验点3种接种方式下60 d内土壤、根、叶的菌株定殖量变化进行统计,结果如表1所示。采用喷叶法处理的山核桃树根与土壤中GFP-WK1的定殖量在接种后呈先升高后下降的趋势,喷叶第7天根部与土壤中GPF-WK1的定殖量达到最高,分别为0.91×106、0.32×106CFU·g-1,60 d时土壤中GFP-WK1的定殖量仍达到104CFU·g-1,表明GFP-WK1能够通过叶面向下传递并定殖在土壤和山核桃树根部。叶片部位GFP-WK1的定殖量一直呈下降趋势,30 d后稳定在105CFU·g-1。
采用挂液法处理后,山核桃树根和叶部位的GFP-WK1定殖量呈先增加后稳定的趋势,其中,山核桃根部的GFP-WK1定殖量在30 d时最多(0.68×106CFU·g-1),而叶面中GFP-WK1的定殖量在第7天时达到最多(0.61×106CFU·g-1)。土壤中GFP-WK1的定殖量表现为先上升后下降的趋势,在60 d时仍保持在105CFU·g-1的水平,说明GFP-WK1能通过挂液法进入树干,并可通过导管向根部和叶面传递,且菌数能保持在较高水平。

图中箭头所指亮点为GFP-WK1菌体。a,不接种菌株的空白对照在绿色荧光下的土壤样品;b,接种WK1菌株在绿色荧光下的山核桃树皮样品;c,灌根法接种GFP-WK1菌株在绿色荧光下的土壤样品;d,灌根法接种GFP-WK1在白光下的树皮样品;e,灌根法接种GFP-WK1在绿色荧光下的树皮样品;f,灌根法接种GFP-WK1在绿色荧光下的树叶样品;g,挂液法接种GFP-WK1在白光下的树皮样品;h,挂液法接种GFP-WK1在绿色荧光下的树皮样品;i,挂液法接种GFP-WK1在绿色荧光下的树叶样品。The bright spot indicated by the arrow in the figure is GFP-WK1. a, Soil of blank control under green fluorescence without strain inoculation; b, Carya cathayensis bark inoculated with WK1 under green fluorescence; c, Soil inoculated with GFP-WK1 by root irrigation under green fluorescence; d, Carya cathayensis bark inoculated with GFP-WK1 by root irrigation under white light ; e, Carya cathayensis bark inoculated with GFP-WK1 by root irrigation under green fluorescence; f, Carya cathayensis leaf inoculated with GFP-WK1 by root irrigation under green fluorescence; g, Carya cathayensis bark inoculated with GFP-WK1 by trunk injection under white light; h, Carya cathayensis bark inoculated with GFP-WK1 by trunk injection under green fluorescence; i, Carya cathayensis leaf inoculated with GFP-WK1 by trunk injection under green fluorescence.图4 不同方法接种的GFP-WK1在山核桃林土壤和植物体内的定殖示意图Fig.4 Colonization of GFP-WK1 inoculated with different methods in soil and Carya cathayensis

表1 不同接种方法GFP-WK1的定殖动态
采用灌根法处理后,GFP-WK1在山核桃林地土壤、根部和叶面的定殖量在第3天最高,之后呈逐渐下降趋势,且土壤中的定殖量显著(P<0.05)高于根和叶中的定殖量,在60 d时土壤中GFP-WK1的定殖量为0.11×106CFU·g-1,而根和叶中GFP-WK1的定殖量处于104CFU·g-1水平。
2.2.2 不同土壤pH条件下GFP-WK1的定殖规律
选择具有不同pH值的3种土壤开展山核桃幼苗盆栽接种GFP-WK1试验,结果表明,在山核桃根、茎、叶组织中均可以分离检测到GFP-WK1菌株(图5)。3种土壤下,植物根内的定殖量均高于茎和叶中的定殖量,接种初期差异最大,且差异显著(P<0.05),随接种时间延长差异缩小,各部位GFP-WK1的定殖量亦总体下降。接种初期,根内GFP-WK1的定殖量高达106CFU·g-1,在60 d时下降到105CFU·g-1水平。比较不同处理发现,当土壤pH值为7.9时,山核桃幼苗的根和茎中GFP-WK1的定殖量在第3天时最高,前期(3~30 d)下降幅度较大,30~60 d间下降幅度较小,趋于稳定;叶中GFP-WK1的定殖量呈现先上升后下降的趋势,在7 d时达到最高(3.46×105CFU·g-1)。当土壤pH值为6.8时,山核桃幼苗根内GFP-WK1的定殖量变化规律与土壤pH值为7.9时相似,但茎和叶中GFP-WK1的定殖量均表现为先升后降的趋势,茎中GFP-WK1的定殖数量在7 d时达到最高(5.40×105CFU·g-1),而叶中GFP-WK1的定殖量在15 d时达到最高(5.20×105CFU·g-1)。当土壤pH值为5.6时,山核桃幼苗茎和叶中的GFP-WK1定殖量均呈先升高后下降的趋势,在7 d时达到最高,分别为4.80×105、3.20×105CFU·g-1,且在各个时期根、茎、叶部位GFP-WK1的定殖量均存在显著差异(P<0.05)。
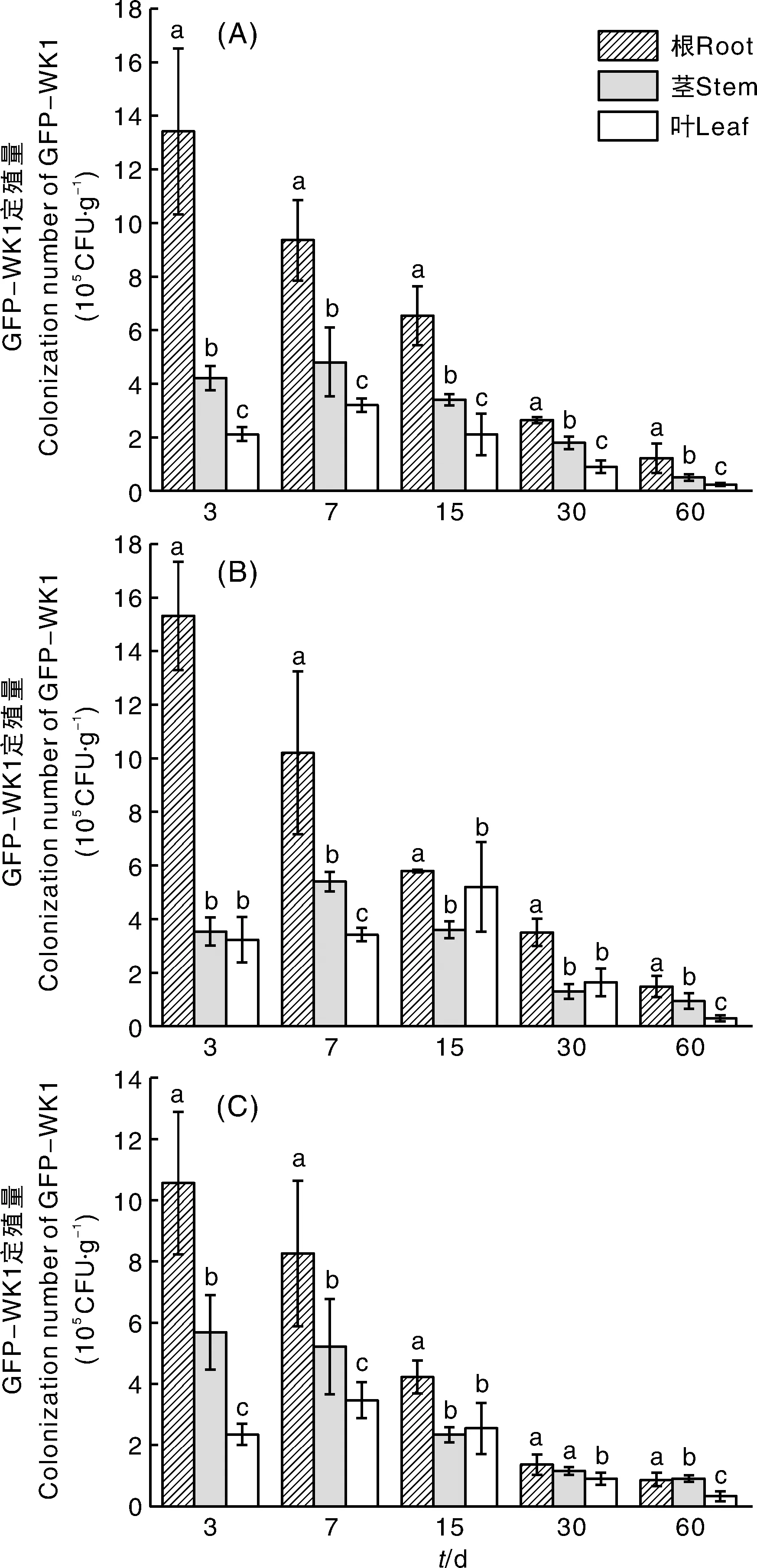
同一时间柱上无相同字母的表示不同部位间差异显著(P<0.05)。Bars marked without the same letters indicated significant difference within different parts at P<0.05 in the same time.图5 当土壤pH值分别为5.6(A)、6.8(B)、7.9(C)时GFP-WK1在山核桃苗上的定殖动态Fig.5 Colonization dynamics of GFP-WK1 in pecan seedlings under soil pH of 5.6 (A), 6.8 (B), and 7.9 (C)

同一时间柱上无相同字母的表示不同处理间差异显著(P<0.05)。Bars marked without the same letters indicated significant difference within treatments at P<0.05 in the same time.图6 GFP-WK1在不同pH值土壤上的定殖动态Fig.6 Colonization of GFP-WK1 in soil under different pH value
不同pH条件下,GFP-WK1在土壤上的定殖动态结果如图6所示,可以看出,不同pH处理下土壤中GFP-WK1的定殖量随时间推进基本呈下降趋势,在30 d后趋于稳定,且均以pH值6.8下最高。7 d时,pH值6.8土壤中的GFP-WK1定殖量显著(P<0.05)高于pH值7.9土壤中GFP-WK1的定殖量,但其他时期不同处理间并无显著差异。
3 讨论
本研究表明,WK1菌株可被绿色荧光蛋白基因成功标记,并具有良好的遗传稳定性,其生长曲线和抑制效果与原菌基本一致,说明外源质粒的导入对解淀粉芽孢杆菌WK1影响较小[27-28],可用其追踪菌株运动和定殖轨迹。
生防菌在自然环境中的作用取决于其在土壤或植物体的定殖能力和一定的定殖数量,这是其发挥生防作用的关键。原位观察与定量结果表明,喷叶法、灌根法、挂液法这3种接种方法均能使GFP-WK1侵入山核桃树体的不同部位,并能在山核桃树体和土壤之间传递。GFP-WK1在叶面中主要定殖在叶细胞间和叶脉处,这和王珍等[29]报道的巨大芽孢杆菌在小白菜上的定殖规律基本一致。蒋晓玲等[30]研究发现,接种芽孢杆菌40 d后仍能从玉米根围的土壤,以及玉米根、茎和叶部位分别检测到106、105、104、103CFU·g-1的荧光标记菌。虽然随着时间延长,土壤和植物各组织内GFP-WK1的定殖量总体呈下降趋势,但在60 d时仍能达到每克鲜样(土/植物)104~105CFU的水平,说明WK1在植物体内的定殖能力较强,且能够达到发挥生防菌作用的水平[31-33]。
以植物体内定殖量判断,喷叶法接种GFP-WK1的效果在15 d时优于挂液法,但15 d后挂液法的GFP-WK1定殖量高于灌根法和喷叶法。灌根法接种GFP-WK1后,山核桃根部GFP-WK1的定殖量在整个试验期内呈先下降再稳定的趋势,从长期定殖效果看,不如其他2种方法。灌根法效果差的原因是,GFP-WK1一次性接种于山核桃林土壤,自然环境和营养物质等条件改变导致菌株大量死亡。挂液法的接种过程中GFP-WK1定殖虽较为缓慢,但菌液袋内的GFP-WK1能持续输入山核桃树体。喷叶法接种前期,GFP-WK1在叶片内的定殖量较多,而土壤和根内定殖量较少。这是因为叶表面积较大且具有气孔,生防芽孢杆菌能够较快速且大量地通过叶面进入山核桃树体。虽然不同接种方法下GFP-WK1在山核桃树内和土壤中的定殖量随着接种时间的变化规律不同,但从60 d时植物体内菌种的接种数量看,挂液法能保证植物体内有较多的GFP-WK1。
不同土壤pH条件下,根中菌株的定殖量均高于茎、叶部位,这与田涛等[34]得出的芽孢杆菌在根表定殖的菌体相对比茎叶定殖更为牢固的结论一致。原因可能是,根部代谢旺盛,可供芽孢杆菌利用的养分较多。在pH值6.8和5.6的土壤条件下,GFP-WK1在山核桃幼苗茎和叶中的定殖量呈先上升后下降的趋势,而在pH值7.9的条件下仅叶部呈先上升后下降的趋势。这表明解淀粉芽孢杆菌的最适pH值接近中性,碱性条件下其生长繁殖会受到抑制[35]。当前,山核桃林地中大部分土壤呈酸性,而施肥管理土壤较多呈中性。由此推测,解淀粉芽孢杆菌有望在当下的山核桃林中发挥较大作用。
总的来看,本研究发现,绿色荧光蛋白标记的解淀粉芽孢杆菌GFP-WK1和原始未标记菌株WK1相比,其生长曲线、抑菌能力无差异。据本试验的研究结果判断, WK1能够通过喷叶法、灌根法和挂液法3种方式在土壤和山核桃树体定殖和移动,定殖量随时间的延长而下降。从60 d时植物体内菌株的定殖量看,挂液法处理下山核桃树体内的GFP-WK1定殖量最多。不同土壤pH条件下,GFP-WK1在山核桃幼苗根、茎、叶部位的数量分布规律基本一致,在pH值为6.8的土壤中定殖量最多。鉴于GFP-WK1可在山核桃树体和土壤中定殖,并能在树体上下双向移动,从短期定殖效果和施用方便的角度出发,推荐田间使用灌根法。将土壤pH值调到6.8,最有利于该菌株的作用发挥。长期使用的话,建议选择挂液法,可使树体菌株的定殖量保持稳定。

