不同程度肥胖儿童的代谢特征、维生素D、IGF-1水平及与肥胖的关系分析
刘枫凤 杨利琦
[摘要] 目的 研究不同程度肥胖兒童的代谢特征、维生素D及IGF-1(胰岛素样生长因子-1)的水平及与肥胖的关系。方法 收集2018年1月至2021年3月就诊于我院儿科并确诊为单纯性肥胖的儿童125例,其中轻度肥胖25例,中度肥胖55例,重度肥胖45例,同时选取入院行青春发育期相关检查的健康非肥胖儿童55例作为对照组,记录年龄、性别,测量身高、体重,检测血糖(FBG)、血清胰岛素(FINS)、三酰甘油(TG)、总胆固醇(TC)、尿酸(UA)、维生素D、IGF-1等指标。并计算体质量指数(BMI)、胰岛素抵抗指数(HOMA-IR)及根据性别、年龄调整后的IGF-1(aIGF-1)。结果 ①肥胖组的BMI、HOMA-IR、TG、UA水平均高于对照组,维生素D 水平低于对照组,aIGF-1水平为轻度肥胖组高于其他三组。②肥胖组两两比较结果:BMI、HOMA-IR、TG、UA水平是重度肥胖组>中度肥胖组>轻度肥胖组,维生素D、aIGF-1水平是轻度肥胖组>中度肥胖组>重度肥胖组。③肥胖组BMI的多元线性回归分析结果显示,UA、HOMA-IR与BMI呈正相关,aIGF-1及维生素D与BMI呈负相关,因此UA、HOMA-IR是肥胖儿童BMI增加的危险因素,aIGF-1、维生素D是保护因素。结论 随着肥胖程度的增加,发生胰岛素抵抗、高尿酸血症等代谢紊乱、维生素D缺乏、IGF-1低水平可能性增加,这些会不利于儿童的生长发育。
[关键词] 肥胖儿童;代谢特征;维生素D;胰岛素样生长因子-1
[中图分类号] R589.2 [文献标识码] A [文章编号] 1673-9701(2021)33-0031-04
[Abstract] Objective To study the metabolic characteristics of children with different degrees of obesity, the levels of vitamin D and IGF-1 and their relationship with obesity. Methods A total of 125 children who were diagnosed as simple obesity in the Department of Pediatrics of our hospital from January 2018 to March 2021 in our hospital were collected, including 25 cases of mild obesity, 55 cases of moderate obesity and 45 cases of severe obesity. Meanwhile, 55 healthy non-obese children who were admitted to hospital for related examinations during puberty were selected as the control group. Their age and gender were recorded, and their height and weight were measured, and their fasting blood glucose (FBG), fasting serum lisulin (FINS), triacylglycerol (TC), uric acid (UA), vitamin D, and IGF-1 were measured. Body mass index (BMI), insulin resistance index (HOMA-IR) and IGF-1 (aIGF-1) adjusted according to gender and age were calculated. Results ①The levels of BMI, HOMA-IR, TG and UA in the obesity group were higher than those in the control group, while the level of vitamin D was lower than that in control group, and the level of aIGF-1 was higher in the mild obesity group than in other three groups. ②Based on the results of pairwise comparison of obese groups, the levels of BMI, HOMA-IR, TG and UA were the highest in the severe obesity group, followed by the moderate obesity group and the mild obesity group. The levels of vitamin D and aIGF-1 in the mild obesity group were the highest, followed by the moderate obesity group and the severe obesity group. ③The results of multiple linear regression analysis of BMI in the obesity group showed that UA and HOMA-IR were positively correlated with BMI, while aIGF-1 and vitamin D were negatively correlated with BMI. Therefore, UA and HOMA-IR were the risk factors of BMI increase in obese children, while aIGF-1 and vitamin D were the protective factors. Conclusion With the increase of obesity, the possibility of insulin resistance, hyperuricemia and other metabolic disorders, vitamin D deficiency and low level of IGF-1 will increase, which will be detrimental to childrens growth and development.
[Key words] Obese children; Metabolic characteristics; Vitamin D; Insulin like growth factor-1
随着经济的发展和生活方式的转变,儿童肥胖率在世界范围内快速增长,我国青少年的身体健康状况不容乐观。一项调查研究发现,我国青少年总体肥胖率高达7.1%[1]。众所周知,肥胖是一种慢性健康杀手,是心脑血管疾病、2型糖尿病、高血压、代谢紊乱等的危险因素[2]。目前关于肥胖儿童代谢特征的研究较多,对维生素D、IGF-1水平的研究较少,且肥胖儿童中IGF-1水平至今说法不一,升高和降低均有。本研究主要探讨单纯性肥胖儿童的糖脂代谢、维生素D、IGF-1等水平及与肥胖的关系,以加深人们对儿童时期肥胖的不良影响的认识,现报道如下。
1 对象与方法
1.1 研究对象
选择2018年1月至2021年3月就诊于我院儿科的单纯性肥胖儿童125例,其中男60例,女65例,平均年龄(10.29±0.33)岁;纳入标准:根据《中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准》[3]将BMI大于等于同年龄同性别正常健康儿童的第95百分位数判定为肥胖。排除標准:由神经垂体、内分泌、遗传代谢、自身性免疫系统等疾病以及化学药物等因素所致继发性肥胖或肥胖综合征。将BMI超过同身高同性别标准体重的20%~29%分为轻度肥胖组(n=25),超过30%~49%为中度肥胖组(n=55),超过50%为重度肥胖组(n=45),并选取来我院行青春期发育相关检查的健康非肥胖儿童55例作为对照组,男13例,女42例,平均年龄(9.76±0.48)岁。
1.2 方法
研究对象清晨空腹,测量其身高体重,精确到0.1 cm、0.1 kg,计算体质量指数(BMI),BMI=体重(kg)/身高2(m2)。并抽取空腹静脉血标本,应用我院检验科全自动生化分析仪及生化试剂盒检测FBG、FINS、TG、TC、UA、维生素D、IGF-1等。计算稳态模型胰岛素抵抗指数(HOMA-IR)=[(空腹胰岛素(mIU/L)×空腹血糖(mmol/L)]/22.5。计算校正年龄、性别后的IGF-1=(实测值-均值)/均值[4],均值为同年龄同性别的IGF-1水平[5]。
1.3 统计学方法
采用SPSS 20.0统计学软件进行数据分析,所有数据进行正态和方差齐性检验,符合正态分布的计量资料以(x±s)表示,非正态分布的资料用四分位间距描述[M(P25,P75)],符合正态分布且方差齐的资料组间比较采用方差分析,对于非正态分布的资料组间比较采用Kruskal-Wallis H检验,再行Mann-Whitney U检验进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
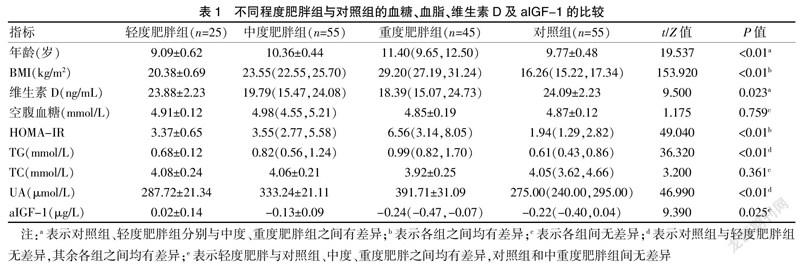
2.1 不同程度肥胖组与对照组的血糖、血脂、维生素D及aIGF-1的比较
肥胖组与对照组比较,BMI、HOMA-IR、TG、UA均升高,维生素D水平较对照组降低,aIGF-1水平则是轻度肥胖组高于其他三组,对照组与中重度肥胖组比较,差异有统计学意义(P<0.05),肥胖组进行两两比较结果显示,BMI、HOMA-IR、TG、UA水平是重度肥胖组>中度肥胖组>轻度肥胖组,维生素D、aIGF-1水平是轻度肥胖组>中度肥胖组>重度肥胖组,差异有统计学意义(P<0.05)。见表1。
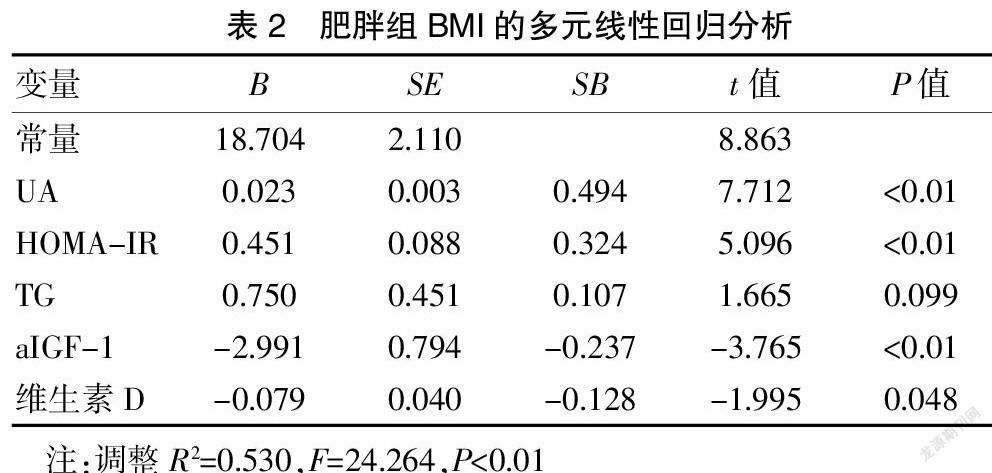
2.2 将肥胖组BMI与其他变量进行双变量Pearson相关性分析
HOMA-IR、TG、UA、维生素D、aIGF-1与BMI相关(P<0.01),然后以BMI为因变量,以HOMA-IR、TG、UA、维生素D、aIGF-1为自变量进行多元线性回归分析,结果显示,UA(SB=0.494,P<0.01)、HOMA-IR(SB=0.324,P<0.01)与BMI呈正相关,维生素D(SB=-0.128,P=0.048)、aIGF-1(SB=-0.237,P<0.01)与BMI呈负相关(P<0.05)。见表2。
3 讨论
3.1 不同程度肥胖儿童的代谢特征
本研究通过对125例不同程度肥胖儿童的相关指标进行分析结果显示,肥胖组中的HOMA-IR、TG、UA水平是重度肥胖组>中度肥胖组>轻度肥胖组,线性回归分析结果显示,HOMA-IR、UA与BMI呈正相关,是BMI升高即肥胖的危险因素。本研究与许多对肥胖儿童代谢特征的研究结果基本一致[6-7]。本研究亦证明,HOMA-IR与BMI呈正相关,但较少文献提到这点。胰岛素主要反映组织是肝脏、骨骼肌及脂肪组织,体内过多的脂肪酸浓度会使肝细胞和心肌细胞的氧化和储存能力下降,导致细胞内脂肪酸代谢的中间物(如二酰甘油、酰基辅酶A衍生物和神经酰胺)积聚[8]。这些物质通过激活丝氨酸激酶途径抑制胰岛素信号,从而引起高胰岛素血症。近年来炎症机制与胰岛素抵抗的关系逐渐被证实。有研究表明,IRS-1/PI3K/AKT通路在控制葡萄糖稳态中起着重要作用。活化的IRS-1/PI3K/AKT的途径促使GLUT4表达从而使脂肪组织、骨骼肌、肝脏摄取葡萄糖、合成糖原和脂质[9]。在高脂环境中,慢性炎症可以通过JNK途径和NF-κB途径抑制IRS-1的胰岛素通路[10],从而引起高胰岛素血症,因此肥胖可以通过产生影响胰岛素作用的代谢物、炎症等途径导致高胰岛素血症。
本研究结果亦证明,尿酸与BMI呈正相关。有研究表明[11],脂肪组织可以通过黄嘌呤氧化还原酶(XOR)产生和分泌尿酸,而肥胖的脂肪组织会缺氧,导致脂肪组织细胞功能障碍,如脂肪细胞因子的调节失调和慢性低级别炎症,诱导的XOR活性增加,从而使尿酸产生增加。肥胖引起高尿酸血症的另一种机制为[11-13]:在脂肪酸合成过程中需要大量的还原氢,磷酸戊糖途径被激活,嘌呤核苷酸合成增多,嘌呤分解代谢随之增强,从而伴随着尿酸大量生成。反之,尿酸还可以通过激活NLRP3炎症复合体[14]直接诱导肝细胞生成脂肪、胰岛素抵抗和胰岛素信号传导受损。也有研究证实[15],尿酸暴露的肝细胞线粒体氧化应激和内质网应激之间存在交互作用,导致脂原基因的表达增强[如乙酰辅酶羧化酶1(ACC1)、脂肪酸合成酶(FAS)和硬脂酰辅酶去饱和酶1(SCD1)]和三酰甘油的产生。因此,肥胖可以导致高尿酸血症,高尿酸也是肥胖的危险因素,这些可以解释本研究结果。
3.2 不同程度肥胖儿童维生素D水平及与BMI的关系
本研究结果显示,肥胖儿童中维生素D水平降低,且与BMI负相关。一项研究发现[16],维生素D缺乏在丹麦肥胖儿童中很常见,且肥胖程度与血清25羟维生素D浓度独立相关。相关机制可能如下,脂肪生成是前脂肪细胞分化为成熟的脂肪细胞的过程,维生素D,1,25(OH)2D在脂肪细胞中参与基因表达和细胞信号的控制。1,25(OH)2D通过上调脂肪生成过程中的基因表达酶[如脂肪酸合成酶(FASN)、脂肪酸结合蛋白(FABP)、过氧化物酶体增殖物激活物受体(PPAR)-γ,PPAR-γ是参与脂肪细胞分化的重要转录因子]刺激脂肪细胞生成[17-19]。维生素D在脂肪细胞代谢和肥胖进展中起着有益作用,维生素D缺乏对脂肪组织增多、免疫细胞浸润和炎症状态产生不利影响,因为维生素D减少NF-κB P65的磷酸化和易位进入细胞核的能力,从而降低炎症和氧化应激反应[20]。总之,肥胖与维生素D缺乏之间的相关机制可能是维生素D具有调节脂肪细胞的生成、炎症反应、氧化应激等的能力。因此,低水平的维生素D是肥胖的危险因素。
3.3 不同程度肥胖儿童IGF-1 水平及与BMI的关系
关于肥胖儿童IGF-1 水平的研究是有争议的,无关和降低均有报道。本研究结果表明,轻度肥胖组aIGF-1 水平高于对照组,且在肥胖儿童中与BMI呈负相关。有报道称[21],与对照组相比,肥胖儿童IGF-1SDS水平较低。也有研究表明[22],IGF-1在受试者中没有差异,且与代谢指标、身体组成参数无关。本研究与上述结果存在差异,其原因可能是:①研究使用aIGF-1作为IGF-1的替代;②研究群体不同,种族、生活习惯、自然环境等的不同。胰岛素样生长因子是一种与胰岛素结构类似的多肽分子,以内分泌方式调节生长激素的合成和分解代谢,以旁分泌和自分泌方式调节细胞的生长、增殖、迁移、分化及凋亡等。IGF-1由肝脏、骨骼肌和心脏等器官分泌,可调节机体的代谢平衡,对多种组织和器官发挥保护效应[23]。IGF-1可促进前脂肪细胞分化为成熟的脂肪细胞,生理性IGF-1浓度不能有效刺激脂质合成或脂解,只有在高浓度下才能通过胰岛素受体刺激葡萄糖转运。IGF-1可增强肌肉对游离脂肪酸的利用及对生长激素的抑制。IGF-1还可以维持细胞因子的稳态抗炎作用,从而防止肥胖引起的轻度炎症[24]。因此,IGF-1对机体的代谢稳态起着重要作用,低水平的IGF-1是肥胖的危险因素。
综上所述,随着肥胖程度的增加,HOMA-IR、UA水平升高,维生素D、aIGF-1水平降低,因此对于中重度肥胖儿童,应注意其胰岛素抵抗、高尿酸血症等代谢紊乱及维生素D缺乏、IGF-1低水平状态的发生,因为这会对骨骼生长、内分泌代谢系统等引起危害,另外,维生素D是一种应用广泛、安全性高的药物,可以将补充维生素D作为治疗儿童肥胖的一种辅助药物。
[参考文献]
[1] 陈贻珊,张一民,孔振兴,等. 我国儿童青少年超重、肥胖流行现状调查[J]. 中华疾病控制杂志,2017,21(9):866-869.
[2] Powell WTM,Poirier P,Burke LE,et al. Obesity and cardiovascular disease:A scientific statement from the American heart association[J]. Circulation,2021,143(21):e984-e1010.
[3] 中國肥胖问题工作组季成叶. 中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J]. 中华流行病学杂志,2004(2):10-15.
[4] Ricco RC,Ricco RG,Queluz MC,et al. IGF-1R mRNA expression is increased in obese children[J]. Growth Hormone & IGF Research,2018,39:1-5.
[5] Xu S,Gu X,Pan H,et al. Reference ranges for serum IGF-1 and IGFBP-3 levels in Chinese children during childhood and adolescence[J]. Endocrine Journal,2010, 57(3):221-228.
[6] 刘栋,宋宏庆,王晓琴. 肥胖儿童血尿酸水平及糖脂代谢特征[J]. 医学综述,2016,22(13):2621-2623.
[7] 吴琼,严维. 学龄期单纯性肥胖儿童血糖、血脂及内分泌激素水平分析[J]. 中国卫生工程学,2020,19(5):779-780.
[8] Tagi VM,Chiarelli F. Obesity and insulin resistance in children[J]. Current Opinion in Pediatrics,2020,32(4):582-588.
[9] Chen Y,Qian Q,Yu J. Carbenoxolone ameliorates insulin sensitivity in obese mice induced by high fat diet via regulating the IκB-α/NF-κB pathway and NLRP3 inflammasome[J]. Biomedicine & Pharmacotherapy,2019,115:108 868.
[10] Liu Z,Patil IY,Jiang T,et al. High-fat diet induces hepatic insulin resistance and impairment of synaptic plasticity[J]. PLos ONE,2015,10(5):e0128 274.
[11] Tsushima Y,Nishizawa H,Tochino Y,et al. Uric acid secretion from adipose tissue and its increase in obesity[J]. Journal of Biological Chemistry,2013,288(38):27 138-27 149.
[12] Ohtsubo T,Matsumura K,Sakagami K,et al. Xanthine oxidoreductase depletion induces renal interstitial fibrosis through aberrant lipid and purine accumulation in renal tubules[J]. Hypertension,2009,54(4):868-876.
[13] Park J,Rho HK,Kim KH,et al. Overexpression of glucose-6-phosphate dehydrogenase is associated with lipid dysregulation and insulin resistance in obesity[J]. Mol Cell Biol,2005,25(12):5146-5157.
[14] Wan X,Xu C,Lin Y,et al. Uric acid regulates hepatic steatosis and insulin resistance through the NLRP3 inflammasome-dependent mechanism[J]. J Hepatol,2016, 64(4):925-932.
[15] Choi Y,Shin H,Choi HS,et al. Uric acid induces fat accumulation via generation of endoplasmic reticulum stress and SREBP-1c activation in hepatocytes[J]. Laboratory Investigation,2014,94(10):1114-1125.
[16] Plesner JL,Dahl M,Fonvig CE,et al. Obesity is associated with vitamin D deficiency in Danish children and adolescents[J]. J Pediatr Endocrinol Metab,2018,31(1):53-61.
[17] Narvaez CJ,Simmons KM,Brunton J,et al. Induction of STEAP4 correlates with 1,25-dihydroxyvitamin D3 stimulation of adipogenesis in mesenchymal progenitor cells derived from human adipose tissue[J]. J Cell Physiol,2013, 228(10):2024-2036.
[18] Ruiz-Ojeda FJ,Anguita-Ruiz A,Leis R,et al. Genetic factors and molecular mechanisms of vitamin D and obesity relationship[J]. Annals of Nutrition and Metabolism,2018,73(2):89-99.
[19] 楊谷良,潘敏雄,向福,等. PPARγ调控脂肪细胞增殖和分化机理研究进展[J]. 食品科学,2017,38(3):254-260.
[20] Farhangi MA,Mesgari-Abbasi M,Hajiluian G,et al. Adipose tissue inflammation and oxidative stress:The ameliorative effects of vitamin D[J]. Inflammation,2017,40(5):1688-1697.
[21] Liang S,Hu Y,Liu C,et al. Low insulin-like growth factor 1 is associated with low high-density lipoprotein cholesterol and metabolic syndrome in Chinese nondiabetic obese children and adolescents:A cross-sectional study[J]. Lipids in Health and Disease,2016,15:112.
[22] Inzaghi E,Baldini FB,Fintini D,et al.Insulin-like growth factors and metabolic syndrome in obese children[J]. Horm Res Paediatr,2017,87(6):400-404.
[23] 李博文,冯丽丽,田振军. 胰岛素样生长因子-1与代谢性疾病及运动干预的研究进展[J]. 生理学报,2021,73(2):342-352.
[24] Aguirre GA,De Ita JR,de la Garza RG,et al. Insulin-like growth factor-1 deficiency and metabolic syndrome[J]. J Transl Med,2016,14:3.
(收稿日期:2021-07-01)

