脑内ACE2基因过表达对高血压前期大鼠血压进展和氧化应激的影响*
刘国英, 彭雯雯, 裴 骏, 陈秀云, 许桂清, 赵晓霖, 李明余, 潘燕霞
(福建医科大学健康学院康复医学系,福建福州350122)
高血压是常见的心血管疾病,由于血压水平与心血管病的危险程度呈正相关,所以高血压的干预越早越好[1]。原发性高血压又是一种与基因有关的疾病,与高血压相关的基因多达数十种,血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)基因就是其中一种。ACE2 是肾素-血管紧张素系统(renin-angiotensin system,RAS)的新成员,其主要作用是水解血管紧张素II(angiotensin II,Ang II)生成血管紧张素1-7(angiotensin 1-7,Ang1-7),Ang1-7对Ang II 发挥负性调控作用[2]。在与RAS 激活有关的疾病中,如慢性心衰、心肌梗死、高血压及肾脏疾病,ACE2 均能产生保护性作用[3]。ACE2 广泛存在于心、脑、肾、血管、肺、胃肠道和脂肪组织。在中枢神经系统,ACE2通过降解心血管中枢的Ang II,抑制交感神经中枢兴奋,减少外周交感神经活动,从而舒张血管、降低血压[4]。有研究报道,自发性高血压大鼠(spontaneously hypertensive rats,SHR)、Ang II 诱导的高血压大鼠[4-6]及DOCA 盐敏感性高血压大鼠[7]的心脏、血管、肾脏和脑组织中,ACE2基因和蛋白表达明显降低,而过表达ACE2基因则可降低高血压和交感神经活动,减轻血管和心脏重构,保护肾脏和脑组织[4-7],提示ACE2 功能降低可能是产生高血压新的病理生理机制;另一方面,其他学者和本实验室以往的研究结果显示,运动训练能上调高血压大鼠延髓和下丘脑室旁核(paraventricle nucleus,PVN)中ACE2基因和蛋白表达,提高ACE2酶活性,从而降低交感神经活动,延缓高血压进展[8-10]。但ACE2基因降压的分子机制尚未完全清楚。氧化应激是引起高血压的细胞与分子机制之一。在离体培养的神经细胞,ACE2基因过表达能抑制Ang II 诱导的活性氧(reactive oxygen species,ROS)升高,下调NADPH 氧化酶(NADPH oxidase,NOX)表达,减轻氧化应激[11]。ACE2基因敲除小鼠出现增龄性氧化应激、自主神经功能紊乱和高血压[12],小鼠室旁核过表达ACE2基因能阻止Ang II 诱导的升压反应和NOX 表达,并降低脑内ROS 生成[12]。但ACE2基因对高血压前期大鼠中枢氧化应激和血压进展的影响目前未见报道。因此,本研究以慢病毒为载体将ACE2基因导入SHR室旁核,观察ACE2基因过表达对高血压前期大鼠血压调节、交感神经活动及氧化应激的影响,并探讨ACE2基因降压的分子机制。
材料和方法
1 主要仪器和试剂
FT-200 动物跑台仪、BP-300 无创血压测试仪和BL-420S生物机能实验系统(成都泰盟);脑立体定位仪(深圳瑞沃德);微量注射器(Hamilton)、荧光显微镜(OLYMPUS)、冰冻切片机(HM550)和多功能酶标仪(上海美谷分子仪器);垂直电泳转印系统和凝胶成像系统(Bio-Rad)。苯肾上腺素(Sigma);二氢乙啶(dihydroethidium,DHE;MedChemExpress);去甲肾上腺素(norepinephrine,NE)和Ang II 酶联免疫试剂盒(武汉华美);NOX2 和NOX4 兔单克隆抗体(Ab⁃cam);GAPDH 兔多克隆抗体(沈阳万类);辣根过氧化物酶标记的山羊抗兔IgG(Jackson ImmunoRe⁃search);ECL发光液(GenView)。
2 方法
2.1ACE2基因重组慢病毒载体的构建ACE2基因以慢病毒为载体由上海吉凯基因化学技术有限公司构建。ACE2基因全长2 459 bp,序列号为NM_021804。将ACE2 基因与慢病毒载体GV358 进行同源重组,形成重组子GV358-ACE2。经克隆、测序,证实与GeneBank 数据库中人源ACE2 基因序列一致。将重组子GV358-ACE2 转染293T 细胞,通过抽提病毒、浓缩和病毒滴度测定,最终获得ACE2 基因重组慢病毒的滴度为5×1014TU(tranduction unites)/L。GV358 慢病毒载体携带增强型绿色荧光蛋白(en⁃hanced green fluorescent protein,eGFP),作为病毒载体对照,病毒滴度为5×1012TU/L。
2.2 动物分组 30 只6 周龄雄性自发性高血压大鼠,体重110~130 g 和10 只同龄、同性别正常血压的Wistar-Kyoto(WKY)大鼠,体重130~150 g,均为无特定病原体清洁级(SPF级)动物,购自北京维通利华实验动物有限责任公司,许可证号为SCXK(京)2012-0001。本实验室先前研究测得6 周龄SHR 收缩压(123.7±7.8)mmHg 为高血压前期[9],但脑内注射比较困难。为了提高脑内注射点的准确性和注射后大鼠的成活率,对6 周龄SHR 进行跑台运动2 周(速度18~20 m/min,60 min/d,每周5 d)以推迟高血压的发生。将8 周龄SHR 随机分成3 组:对照(SHR)组、基因载 体对照(SHR-eGFP)组和ACE2 基因(SHRACE2)组,每组10只。10只WKY 大鼠作为高血压对照(WKY)组,不进行任何干预。所有动物均饲养在福建医科大学动物实验中心动物房内。
2.3 室旁核内ACE2基因微注射 在10%水合氯醛腹腔注射麻醉下,将大鼠头部固定于脑立体定位仪上,切开皮肤和骨膜,用小钻子在颅顶钻一小洞,下丘脑室旁核注射点在颅骨上的定位坐标是[13]:前囟向后1.8 mm,中线旁开0.4 mm,颅骨表面向下深达7.9 mm。将携带ACE2 基因重组慢病毒缓慢匀速注入PVN,注射体积为200 nL,注射的病毒数量为1×107。对照组PVN 的内注射等体积的慢病毒载体。预实验时,用携带绿色荧光蛋白的慢病毒载体注射到PVN。一周后处死大鼠,取脑做冠状面冰冻切片,片厚10 μm,在荧光显微镜下观察注射点的荧光,进行组织学鉴定。
2.4 大鼠尾动脉血压的测量 采用BP-300 无创血压测量系统,分别在干预前、干预后4 周和8 周进行测压。
2.5 血压调节功能评估 以压力反射敏感性(baro⁃reflex sensitivity,BRS)代表血压调节功能。根据本实验室已建立方法[8-9],采用静脉注射苯肾上腺素(8 μg/kg),引起血压升高和反射性心率减慢,记录注药前后血压和心率的变化,BRS=注药前后心率变化/注药前后血压变化。
2.6 ELISA 法检测血浆去甲肾上腺素和下丘脑室旁核Ang II含量 按试剂盒说明进行操作。
2.7 DHE 染色法检测ROS 水平 对各组大鼠脑组织进行冰冻切片,将含有最明显PVN 结构的脑片铺在玻片上做DHE 染色,用免疫染色保护笔划圈防止DHE 溶液外溢,滴加2 μmol/L DHE 溶液覆盖脑片,将玻片放入湿盒(预先在37 ℃温箱平衡30 min),然后再放入37 ℃温箱孵育30 min,取出后在暗室中进行以下操作:滴加PBS冲洗2次,避光晾干,加入抗荧光淬灭剂,覆盖脑片,在荧光显微镜下观察、拍照,用ImageJ软件分析荧光强度。
2.8 Western blot 检测ACE2、NOX2 和NOX4 的蛋白表达 取冻存的大鼠PVN 组织约50 mg,按照1∶10(质量∶体积)加入RIPA 裂解液(含PMSF和蛋白酶抑制剂),冰上匀浆,裂解30 min。将匀浆液移入EP 管中,4℃、12 000×g 离心),取上清液,BCA 法蛋白定量。SDS-PAGE 分离(10%分离胶、5%浓缩胶),电转移至硝酸纤维素膜上,用丽春红染色,依相对分子质量大小切取条带,5%脱脂奶粉室温下封闭1 h。然后分别加入TBST 稀释的Ⅰ抗(兔抗ACE2 抗体按1∶1 500 稀释,兔抗NOX2 抗体按1∶2 000 稀释,兔抗NOX4 抗体按1∶1 500 稀释),4℃摇床过夜。次日,洗膜后分别加入按照1∶1 000 稀释的羊抗兔IgGHRP,室温下孵育2 h。洗膜后加入ECL 显影,用凝胶成像仪扫描,保存图像。Image-Pro Plus 6.0 图像分析软件进行条带吸光度值的测定,以GAPDH 作为内参照,目的蛋白/GAPDH 条带吸光度的比值表示目的蛋白的表达水平。
3 统计学处理
全部数据以均数±标准差(mean±SD)表示,应用SPSS 21.0 软件进行数据处理和作图,多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异(LSD)法。以P<0.05为差异有统计学意义。
结 果
1 ACE2基因过表达对高血压前期血压进展和BRS的影响
PVN 注射ACE2 基因之前,SHR 组、SHR-eGFP组和SHR-ACE2 组大鼠的收缩压无显著差异;ACE2基因注射4 周和8 周后,SHR-ACE2 组大鼠收缩压均显著低于SHR 组和SHR-eGFP 组(P<0.05);PVN 内注射病毒载体无降压作用,SHR-eGFP 组大鼠收缩压与SHR组无显著差异,见表1。
如图1所示,SHR组和SHR-eGFP组BRS显著低于WKY 组(P<0.01);ACE2 基因过表达提高SHR 的BRS,SHR-ACE2 组 的BRS 显 著 高于SHR 组(P<0.05);SHR-eGFP 组的BRS 与SHR 组相比差异无统计学显著性。

表1 ACE2基因对高血压前期大鼠血压进程的影响Table 1. Effect of ACE2 gene on the progression of blood pressure in the prehypertensive rats(Mean±SD. n=10)

Figure 1. Over-expression of ACE2 gene improved arterial baror⁃flex sensitivity in SHR. Mean±SD. n=10. *P<0.05,**P<0.01 vs WKY group;#P<0.05 vs SHR group.图1 ACE2基因过表达改善SHR动脉压力反射敏感性
2 ACE2 基因过表达对SHR 室旁核ACE2 蛋白表达的影响
Western blot 结果显示,SHR 组和SHR-eGFP 组ACE2 蛋白表达显著低于WKY 组(P<0.01);外源性ACE2 基因导入SHR 室旁核后,SHR-ACE2 组ACE2蛋白表达显著高于SHR 组(P<0.05),且与WKY 组的差异无统计学意义;病毒载体不影响SHR的ACE2蛋白表达,见图2。
3 ACE2 基因过表达对SHR 室旁核Ang II 和血浆NE水平的影响
SHR 组和SHR-eGFP 组室旁核Ang II 水平显著高于WKY 组(P<0.01),伴交感神经活动增强,血浆NE 水平亦显著高于WKY 组(P<0.01);SHR-ACE2组Ang II和NE 水平均显著低于SHR 组(P<0.05),但仍高于WKY 组(P<0.05);SHR-eGFP 组室旁核Ang II和血浆NE水平与SHR组无显著性差异,见图3。
4 ACE2基因过表达对室旁核氧化应激的影响

Figure 2. The protein expression of ACE2 in the PVN of SHR was up-regulated after ACE2 gene transfection. Mean±SD. n=4. **P<0.01 vs WKY group;#P<0.05 vs SHR group.图2 ACE2基因过表达上调SHR室旁核ACE2蛋白表达
ROS 经DHE 染色呈现红色,不同组别的ROS 呈现不同程度的红色。统计结果显示,SHR 组和SHReGFP 组 室 旁 核ROS 水 平 显 著 高 于WKY 组(P<0.01),而SHR-ACE2 组室旁核ROS 水平低于SHR 组(P<0.05),但仍高于WKY 组(P<0.05),SHR-eGFP组室旁核ROS水平与SHR组无显著差异,见图4。
NOX 是产生ROS 的关键酶。如图5 所示,SHR组和SHR-eGFP组室旁核NOX2和NOX4蛋白表达显著高于WKY组(P<0.05或P<0.01);ACE2基因过表达显著降低SHR 组NOX2 和NOX4 的蛋白表达(P<0.05或P<0.01);病毒载体不影响SHR室旁核NOX2和NOX4的蛋白表达。
讨 论

Figure 3. Over-expression of ACE2 gene decreased Ang II level in the PVN(A)and plasma NE level(B)of SHR. Mean±SD. *P<0.05,**P<0.01 vs WKY group;#P<0.05 vs SHR group.图3 ACE2基因过表达降低SHR室旁核Ang II和血浆NE水平

Figure 4. Over-expression of ACE2 gene depressed oxidative stress in the PVN of SHR. Mean±SD. n=4. **P<0.01 vs WKY group;#P<0.05 vs SHR group.图4 ACE2基因过表达抑制SHR室旁核氧化应激
SHR 是遗传性高血压大鼠,其血压变化与人类原发性高血压相似,是研究原发性高血压理想的动物模型。SHR 生后4 周内血压正常,8 周龄时出现高血压,4~7 周为高血压前期[14]。高血压前期发展成高血压和发生心血管疾病的风险是正常血压的2倍[15]。因此,应积极干预高血压前期以减少高血压和心血管疾病的患病率。为了探讨ACE2基因对高血压进程的影响及其中枢机制,本研究选取6 周龄SHR 为研究对象,前期研究测得6 周龄SHR 收缩压为(123.7±7.8)mmHg[9]。由于6 周龄大鼠PVN 体积较小,注射定位比较困难,所以先进行2 周中等强度的跑台运动,以延缓高血压前期进展[8-9]。PVN 注射ACE2基因之前,8 周 龄SHR、SHR-ACE2和SHReGFP 组的收缩压在135~138 mmHg 之间,仍处于高血压前期。ACE2基因注射后8 周,SHR-ACE2组血压较SHR 组降低,而病毒载体组无显著降压作用。SHR 组和SHR-eGFP 组血压达到170 mmHg,显著高于正常WKY 大鼠。Western blot证实外源性ACE2基因导入SHR 的PVN,引起ACE2 蛋白过表达。因此,本实验结果说明ACE2基因导入PVN 能抑制高血压前期大鼠的血压升高。Yamazato 等[4]首次报道了SHR 延髓头端腹外侧区注射外源性ACE2基因可引起持久的降压作用。Feng 等[16]也报道侧脑室注射ACE2基因,能阻止Ang II引起的血压升高。此外,在DOCA 盐敏感性高血压大鼠,ACE2基因导入PVN 也可显著降低高血压[7]。上述研究结果提示延髓或下丘脑心血管中枢导入ACE2基因,可降低多种高血压动物模型的血压。
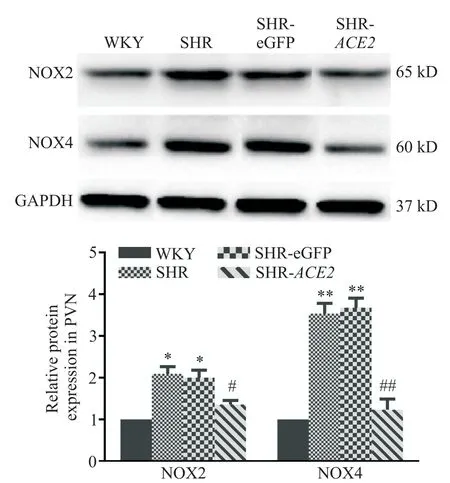
Figure 5. Over-expression of ACE2 gene down-regulated protein expression of NOX2 and NOX4 in the PVN of SHR.Mean±SD. n=4. *P<0.05,**P<0.01 vs WKY group;#P<0.05,##P<0.01 vs SHR group.图5 ACE2 基因过表达下调SHR 室旁核NOX2 和NOX4 的蛋白表达
心血管中枢对血压的调控作用主要通过动脉压力反射实现的,BRS 降低是高血压发生发展重要的神经机制。外周血压升高或降低,刺激颈动脉窦和主动脉弓压力感受器,传入信息到达延髓和下丘脑压力反射中枢,经过中枢整合后再传出,调节交感和迷走神经活动,从而调节血压。BRS 降低意味着机体对血压变化的反应性降低,以至于对高血压的降压作用减弱,因此BRS 与血压水平呈负相关[9]。本实验观察到ACE2基因导入SHR 室旁核,引起ACE2蛋白过表达,SHR-ACE2组BRS 显著高于SHR 组,而SHR-eGFP组BRS与SHR组无显著差异,这一结果说明ACE2 蛋白过表达能增强SHR 压力反射的降压作用。在延髓压力反射中枢过表达ACE2也可增强BRS 功能,降低Ang II 介导的高血压和慢性心衰[17-19]。此外,Lopes 等[20]采用运动训练联合ACE2激动剂改善高血压大鼠压力反射功能,降低高血压。本实验室前期采用运动训练也能上调SHR延髓和下丘脑压力反射中枢ACE2酶活性和蛋白表达,能够增强BRS,延缓高血压前期进展[8-9]。上述研究结果提示,增强动脉压力反射可能是室旁核ACE2蛋白过表达阻止高血压进展的重要机制。
ACE2 是金属蛋白酶,能水解Ang I 和Ang II,分别生成Ang 1-9 和Ang 1-7,但ACE2 水解Ang II 的作用是水解Ang I 的400 倍,所以ACE2 主要作用是降解Ang II。本实验证实室旁核过表达ACE2 蛋白,可降低SHR 脑组织Ang II和血浆NE 水平。已知Ang II能强烈抑制动脉压力反射,故推测室旁核ACE2蛋白过表达可能通过降低SHR 脑组织Ang II 从而改善动脉压力反射。其他学者将外源性ACE2基因导入延髓头端腹外侧区和孤束核均可降低脑组织Ang II 水平,改善自主神经功能[17,19],与本实验结果一致。
氧化应激与高血压密切相关,Ang II升高能引起细胞氧化应激,激活NADPH 氧化酶,使ROS增加[21]。在中枢神经系统,ROS 水平升高能兴奋交感神经中枢,增加交感神经活动,升高血压[21]。过表达ACE2能对抗Ang II 介导的升压反应和NADPH 氧化酶的激活[22]。本实验也观察到室旁核ACE2 蛋白过表达可下调SHR 的NADPH 氧化酶亚单位NOX2 和NOX4蛋白表达,降低ROS 水平,可能与Ang II 水平降低有关。
综上所述,室旁核ACE2蛋白过表达能阻止高血压前期大鼠血压进展,增强血压调节功能,并抑制交感神经活动,其机制可能与降低中枢Ang II 水平和氧化应激有关。

