人乳糜化脂肪来源干细胞生物学特性的初步研究
陈俊男 李治桦 赖琳英 周桂文 梁黎明 陈敏亮
[关键词]乳糜化脂肪;间充质干细胞;生物学特性;表面标记物
脂肪源性基质/干细胞(Adipose d e r i v e d s t e mcells,ASCs)是一类来源于脂肪组织的成体间充质干细胞,具有自我更新和优良多向分化潜能,且取材容易、取材量大、对组织损伤小、干细胞含量丰富、增殖能力强大、不受伦理约束等优点使其迅速成为组织工程与修复领域的研究热点[1]。2001年,Zuk等[2-3]首先发现ASCs,他们在体外能够很好地扩增,具有多向分化能力,治疗涵盖多领域[4-6]。不仅如此,ASCs能够分泌细胞因子,建立良好的损伤修复微环境,提高机体组织修复能力等[7-8]。2013年,Patrick Tonnard等[9]通过机械乳化与过滤方式把抽吸脂肪组织制成“纳米脂肪(Nanofat)”,用于临床治疗并获较好效果。研究收集3种脂肪样本(Macrofat颗粒脂肪,Microfat微粒脂肪及Nanofat),三者比较分析发现,Nanofat内含有大量优质ASCs。
本研究对传统负压抽吸获得的自体颗粒脂肪,先经特殊步骤处理得到“乳糜化脂肪(Chyle fat)”,然后从中提取乳糜化脂肪来源干细胞(Chyle fat derived stemcells,CFSCs)并进行体外分离、培养、鉴定、多向诱导等实验,旨在对同一个体、相同体积的两种脂肪样本中分离、纯化的间充质干细胞,从形态学观察、干细胞表型鉴别及诱导分化能力进行分析比较,初步研究CFSCs的形态学特征及生物学特性,以期为以干细胞为基础的相关临床治疗提供实验依据和技术支持。
1 材料和方法
1.1 脂肪组织样本来源:本实验所用人脂肪标本材料来自解放军总医院第四医学中心烧伤整形科接受脂肪抽吸手术的1例女性患者(35岁)。抽脂部位为下腹部,患者无急、慢性病史,且已签署知情同意书。
1.2 研究方法
1.2.1 Chyle fat的制备
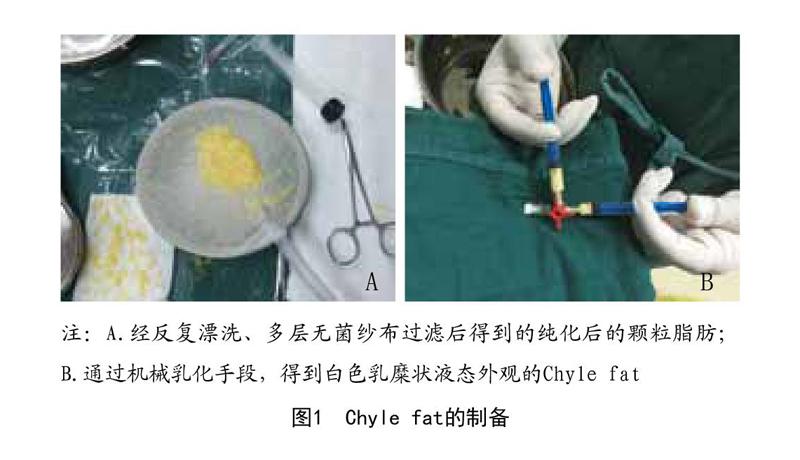
1.2.1.1 颗粒脂肪制备:脂肪抽吸是在1例35岁女性患者接受腹部整形修复手术的过程中进行的。术前肿胀液的配比如下:无菌生理盐水1 000ml+2%利多卡因注射液400mg+鹽酸肾上腺素注射液1mg。20ml注射器回抽10ml(抽吸负压值60kPa)及管径3mm伴多个侧孔直径1mm进行脂肪抽吸手术。将收获的脂肪用林格氏液冲洗干净并通过孔径为0.5mm的无菌尼龙布过滤、清洗、纯化,剔除粗大纤维结缔组织,无菌罐内收集经过处理后的脂肪样本,分装存储在无菌的离心管内,每管30ml,每3管为一组,计算均值作为一次实验数据结果。
1.2.1.2 Chyle fat制备:将颗粒脂肪经孔径大小为0.8mm的纳米转换头(BD Luer-Lok connector)在两个5ml注射器内快速对打30次,通过机械乳化的方法,使脂肪转换成白色的乳糜状液态,将脂肪液体再次用无菌尼龙布过滤,收集Chyle fat,同法分装储存于离心管内,每管30ml,3管为一组,计算均值作为一次实验数据。见图1。
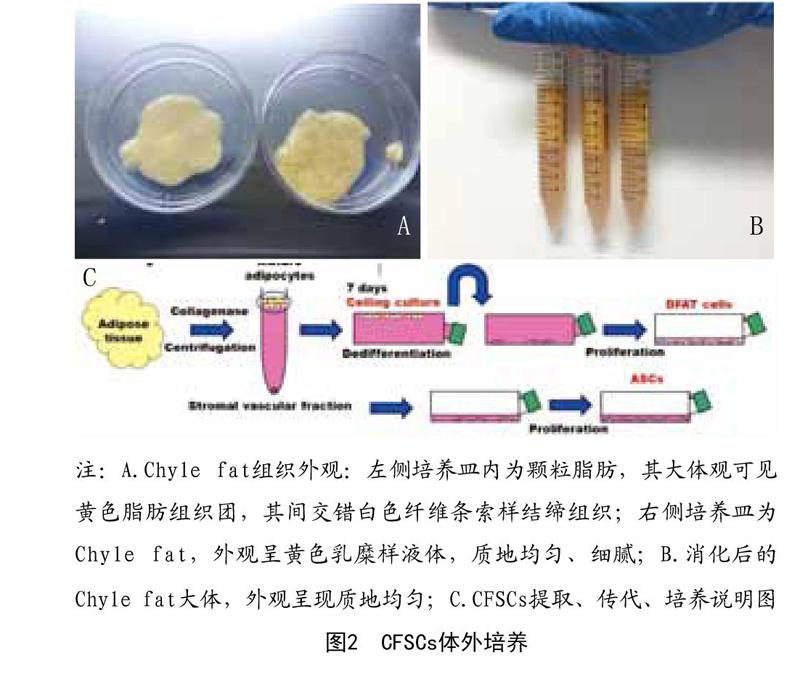
1.2.2 分离提取CFSCs及其体外培养:ASCs及CFSCs的分离来自不同的脂肪抽吸物(颗粒脂肪和Chyle fat),分离提取CFSCs步骤均参照Zuk法。具体操作为:每管以1:1(等体积)比例加入相应体积的含有0.1% Ⅱ型胶原酶的磷酸盐缓冲液,37℃恒温摇床匀速80r/min振荡消化45min,观察混合物呈均质匀浆状即为消化完全,再加同等体积DMEM/F12培养基(其中含体积分数10%胎牛血清及体积分数1% 100IU青霉素、100mg/ml链霉素)中和胶原酶终止消化,之后2 000rpm/min离心10min,吸出上层液体和破碎脂肪油脂并丢弃,将基质细胞沉淀重悬于磷酸盐缓冲盐水中,用70μm细胞尼龙筛网过滤,并将滤液收集,而后1 600rpm/min离心10min,吸出上清,培养基重悬基底细胞沉淀,调整细胞浓度为1×105/cm2,接种到25T培养瓶内,于37℃、5% CO2饱和湿度的培养箱内孵育。本实验选取P3代脂肪干细胞进行研究。见图2。
1.2.3 CFSCs细胞形态学观察:倒置相差显微镜下观察CFSCs接种不同时间细胞形态的变化、分布及克隆增殖情况。
1.2.4 流式细胞术检测CFSCs表面抗原标记:取P3代CFSCs,0.25%胰酶消化,PBS洗涤2次,1% BSA(牛血清白蛋白)吹打均匀,制备成每管浓度为1×106/100μl分装,每支EP管100μl。然后分别加入FITC偶联小鼠抗人CD105、FITC偶联小鼠抗人CD90、BV421偶联抗人CD73、BV421偶联抗人CD34单克隆抗体每管5μl、Pe偶联抗人CD31、Pe偶联抗人CD45单克隆抗体每管20μl,设立空白同型对照,送流式细胞仪检测。
1.2.5 CFSCs多能诱导分化
1.2.5.1 成脂诱导鉴定:P3代CFSCs细胞,2×104/cm2接种于六孔板至细胞100%融合,加成人ASCs成脂肪诱导培养基A(10%胎牛血清+培养基A+1%青链霉素+500μmol/L 3-异丁基-1-甲基黄嘌呤)诱导3d,弃A加B液(10%胎牛血清+培养基B+1%青链霉素+谷氨酰胺+400μl胰岛素)。A、B液交替使用20d,显微镜观察细胞形态变化,油红〇染色:将培养板置于显微镜下对成脂染色观察并拍照。
1.2.5.2 成骨诱导鉴定:P3代CFSCs细胞,换用成骨诱导液(成骨诱导液+10%胎牛血清+1%双抗+400μl抗坏血酸、20μl地塞米松、2ml β-甘油磷酸钠)诱导培养,设计对照组,诱导培养5周。诱导期间每日显微镜下观察细胞形态学改变情况,终末期行茜素红染色,显微镜下观察并拍照记录。
1.2.5.3 成软骨诱导鉴定:取P3代CFSCs细胞,加入成软骨诱导培养基(成软骨培养基+20μl地塞米松+600μl抗坏血酸+2ml ITS添加物+200μl丙酮酸钠+200μl脯氨酸),采用微团培养法诱导分化连续培养1个月,对照组仅用常规配制的DMEM培养。诱导4周后行阿利辛蓝染色观察,对细胞外基质酸性多糖的阳性染色来鉴别成软骨分化结果。
1.2.6 CFSCs細胞增殖能力检测(CCK-8法):取P3代CFSCs细胞,96孔板接种细胞悬液,100μl/孔,测6孔/天,实验时间共7d,将首次接种的培养板放入培养箱中预培养24h,每孔加入配置CCK-8工作液100μl,再用酶标仪检测在450nm的吸光度值,连续检测7d。以OD对培养时间绘制细胞生长曲线。
1.2.7 统计学分析:运用SPSS 22.0软件进行数据分析。所有数据以均数±标准差(x?±s)表示,组间数据比较用t 检验,以P <0.05为差异有统计学意义。
2 结果
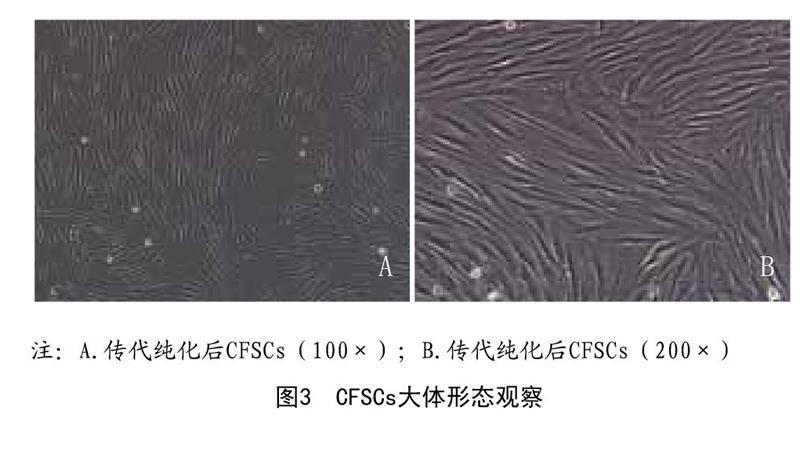
2.1 CFSCs细胞形态学:CFSCs原代经24h左右可贴壁,接种24h后可见大约半数细胞贴壁,形状呈现出圆形或菱形,大小不一,此时在培养瓶内可见大量透光度亮的红细胞等漂浮,48h左右细胞数量上升,长梭形为主,培养至5~7d后细胞进入指数增殖期,局部融合排列紧密,呈放射状或平行状紧密排列,此时视为细胞传代时机。原代细胞一般在3~5d即可达90%以上融合,二、三代后CFSCs细胞生长良好。见图3。
2.2 CFSCs表面标记物免疫表型检测:流式细胞仪检测P3代CFSCs免疫表型结果:①CFSCs:P3代CFSCs细胞呈CD105(95.32%)、CD90(90.16%)、CD73(96.90%)阳性表达,同时呈白细胞、造血细胞系及内皮细胞分子标记物CD45(0.25%)、CD34(0.39%)、CD31(0.18%)阴性表达; ② 颗粒脂肪A S C s : P 3 代A S C s 细胞呈C D 1 0 5(90.89%)、CD90(89.07%)、CD73(90.62%)阳性表达,同时其呈CD45(0.04%)、CD34(0.05%)、CD31(0.23%)阴性表达,间接排除白细胞、造血细胞系和内皮细胞的污染。见图4。
2.3 CFSCs三系诱导结果
2.3.1 成脂诱导结果:P3代CFSCs成脂肪诱导分化第4天开始,可以观察到生细胞形态逐渐由梭形变为椭圆形或圆形,细胞胞质内有大小不一、晶莹透亮的脂滴形成,油红〇染色示细胞内脂滴呈桔红色。见图5。
2.3.2 成骨诱导结果:P3代CFSCs成骨细胞诱导后,大量细胞呈现出不规则的形状,且体积开始慢慢变大,之后细胞开始密集、重叠,出现聚集,细胞胞质内出现颗粒状物质,茜素红染色示桔红色钙化结节的类骨小梁结构。见图6。
2.3.3 成软骨诱导结果:P3代CFSCs成软骨细胞诱导后,大量细胞出现体积变大变圆,胞质十分丰富,阿利辛蓝染色示软骨组织内酸性粘多糖着色效果。见图7。
2.4 CFSCs细胞生长曲线:CCK8法检测P3代CFSCs,以细胞的吸光度值为纵坐标,以培养时间为横坐标,标画生长曲线。可以看出,同ASCs的生长曲线相似,CFSCs在经历了一个快速增殖期后,逐渐进入平台期,从第6天开始,细胞增殖达到顶点并出现接触抑制的现象。见图8。
3 讨论
分离ASCs方法主要有:一为脂肪组织固体团块;二为负压吸引法所得到的液态脂肪组织。但是,何种方法能够获取更多干细胞团呢?该疑问尚未解决,有待于更进一步地深入探究[10-11]。从分离、提取ASCs角度看,脂肪抽吸手术因来源丰富、操作简单、取材方便、创伤痛苦小等诸多优势,临床实践证实其远比切除脂肪法更具优势。最常见的脂肪抽吸术式仍为肿胀法脂肪抽吸术[12],但是要注意抽吸压力的掌控,否则会导致ASCs产量大幅下降或影响干细胞的增殖活性[13]。
研究证实腹部、侧腹部所获得的ASCs产量无显著性差异[14]。本研究选取低负压(60kPa)抽吸方式得到游离脂肪组织,乳糜化机械分离结合酶消化法成功获取到CFSCs,该细胞梭形且呈贴壁生长[15]。
Kim等[ 1 6 ]研究发现,高浓度含葡萄糖培养基可以加速干细胞老化,抑制干细胞的增殖、分化。故本实验采用DMEM/F12培养基培养人CFSCs,发现通过机械乳化和酶消化后分离提取的人CFSCs体外培养时克隆增殖快,传代间隔时间短,连续多次传代亦未出现显著衰老迹象。SVF中除ASCs外,还包括内皮细胞、脂肪前体细胞等多种细胞[17]。未避免上述混合细胞群可能对ASCs表型鉴定、增殖能力等结果造成干扰、混淆实验数据,本实验应用CFSCs的贴壁特性,通过多次离心清洗的方式尽量去除大部分悬浮细胞,使得CFSCs因其可贴壁牢固从而存留。然而,原代培养CFSCs时存在被成纤维细胞污染之可能,且两者形态神似,均无特异性鉴别标志。那么,漂洗及消化时间在此显得尤为重要,因为不同细胞的贴壁、消化时间均不一致,知晓成纤维细胞消化所需时间显著长于CFSCs后,只需要采用适当的消化时间就能有效地去除此类杂质细胞。
本次用流式细胞术检测P3代CFSCs膜表面的抗原,结果提示:①CFSCs细胞高表达CD105(95.32%)、CD90(90.16%)、CD73(96.90%)等间充质细胞标记物,而不表达造血系细胞标记物、共刺激分子及部分黏附分子如CD45(0.25%)、CD34(0.39%)、CD31(0.18%);②颗粒脂肪ASCs的细胞表面标志抗原表达情况:CD105(90.89%)、CD90(89.07%)、CD73(90.62%)、CD45(0.04%)、CD34(0.05%)、CD31(0.23%)。CD34和CD31代表血管内皮细胞标记物,两者在上述乳糜化脂肪中的极低表达说明提取并纯化过的CFSCs不含血管内皮细胞、造血系细胞等。CD45在所有白细胞上都有表达,也叫其白细胞共同抗原,该抗原的低表达量也证明了本实验分离获得的细胞并非白细胞等血液来源细胞。提示:获取的CFSCs为高度均一的间充质来源细胞群,充分说明乳糜化脂肪中提取到的CFSCs呈现间充质干性极强特性。本实验尚对CFSCs进行增殖及三系分化潜能检测,结果显示:同传统的颗粒脂肪ASCs相似,CFSCs具有强大的增殖能力和向外、中、内胚层分化的能力。
本实验在制备乳糜化脂肪时,脂肪细胞在机械乳化过程中被大量破坏,镜下未见明显脂肪细胞,但是乳糜化脂肪样本后期的细胞培养与纯化过程中,成功分离出具备良好分化潜能的CFSCs,该CFSCs具有粘附性,能够贴壁形成单层,并表现出成纤维细胞形态,且其具备干细胞免疫表型,并可在不同诱导条件下向成熟脂肪细胞、骨细胞、软骨细胞分化。研究结果说明:乳糜化脂肪内含有大量优质干细胞(CFSCs)。
类似Nanofat,乳糜化脂肪不在于容积构建,因其内缺少脂肪细胞。前期临床研究[18]发现,乳糜化脂肪移植能够改善瘢痕内Ⅰ、Ⅲ型胶原蛋白排列顺序使增生性瘢痕趋于平坦。结合本实验研究结果得出:乳糜化脂肪内都不含脂肪细胞了,还能称其为脂肪移植吗,改善瘢痕质地及组织性质的关键又是什么呢?考虑主要起效的为其内所含的干细胞。因此,乳糜化脂肪注射可以被想象成是一个体内组织工程重建过程。乳糜化脂肪移植治疗瘢痕是一种非常有价值的临床技术,其机制仍需进一步研究。

