粗毛纤孔菌不同极性萃取物对α-葡萄糖苷酶的抑制作用及抗氧化活性研究*
唐 敏,丁 野,杨 阳,谢孟乐,王淑敏,陈长宝,王 欢,**,李 玉**
(1.长春中医药大学,吉林省人参科学研究院,人参化学与药理重点实验室,吉林 长春130117;2.吉林农业大学食药用菌教育部工程研究中心,吉林 长春 130118;3.中国热带农业科学院环境与植物保护研究所,海南 海口 570100)
粗毛纤孔菌 [Inonotus hispidus (Bull.:Fr.) P.Karst.],属于担子菌门(Basidiomycota) 伞菌纲(A-garicomycetes) 锈革孔菌目(Hymenochaetales) 锈革孔菌科 (Hymenochaetaceae) 纤孔菌属 (Inonotus)[1]。粗毛纤孔菌具有极高的药用价值,国内多用于治疗消化不良[2]、胃溃疡[3]等,国外主要用其润肠通便的功效[4]。王婷等[5]的研究证明了粗毛纤孔菌粗多糖对H22荷瘤小鼠具有一定的抗肿瘤活性,此外,粗毛纤孔菌还可用于治疗糖尿病、痛风和关节炎等病症[6];粗毛纤孔菌子实体萃取物还具有调节人体免疫力[7]、抗病毒[8]、降血脂[9]等作用。
当体内氧化还原系统失衡时,会引起氧化应激反应,氧化应激反应在糖尿病的发展过程中起着重要的作用。体内血糖浓度过高时,过量的活性氧ROS等会造成机体损伤进而引起糖尿病及其并发症[10]。据国际糖尿病联合会(IDF) 报道,2017年全世界约有4.25亿糖尿病患者,每年约有11%的人死于糖尿病及其并发症[11]。α-葡萄糖苷酶抑制剂可用于调节血糖代谢,有效预防糖尿病及血管并发症等[12]。临床现有的α-葡萄糖苷酶抑制剂类药物,如阿卡波糖和伏格列波糖等对糖尿病具有较好的治疗效果,但也会导致人体肝、肾组织的不可逆损伤[13]及出现肠胃胀气、腹泻、腹部不适等副作用[14]。从药用真菌资源中挖掘具有抗氧化及α-葡萄糖苷酶抑制作用的天然药物具有重要的意义。因此,本研究对粗毛纤孔菌子实体4种不同极性萃取物的总酚含量、α-葡萄糖苷酶抑制作用及体外抗氧化能力进行了测定,为开发高效低毒生物降血糖、抗糖尿病药物及保健品提供参考。
1 材料与方法
1.1 供试材料
粗毛纤孔菌(I.hispidus) 采集于吉林省延吉市八家子镇泉水洞林场,由长春中医药大学王淑敏教授鉴定,其子实体形态见图1。

图1 粗毛纤孔菌子实体Fig.1 The fruiting body of Inonotus hispidus
由图1可知,粗毛纤孔菌子实体,无柄,革质至软木栓质。菌盖平展,外伸可达22 cm,宽可达29 cm,基部厚可达5 cm;表面呈浅褐色,生长活跃时呈金黄褐色,成熟时呈暗褐色,被粗毛,边缘钝。孔口表面褐色至暗褐色,多角形,每毫米2个~3个;管口边缘薄,撕裂状。不育边缘明显,宽可达3 mm。菌肉暗栗褐色,厚可达3 cm。菌管与孔口表面同色,长可达35 mm[15]。
1.2 主要试剂
没食子酸、α-葡萄糖苷酶、1,1-二苯基-2-苦肼基(DPPH)、2,6-二叔丁基对甲酚 (BHT)、2,4,6-三吡啶基 (TPTZ)、2,2-联氮-二 (3-乙基-苯并噻唑-6-磺酸) 二铵盐(ABTS)、福林酚,购自上海源叶生物有限公司;三氯化铁、醋酸铵、甲醇、二甲基亚砜(DMSO)、过硫酸钾,三氯乙酸和硫酸亚铁等试剂均为国产分析纯;4-硝基-α-D-吡喃葡萄糖苷(PNPG),纯度≥99%,为Sigma公司产品。
1.3 主要设备
M200 Pro多功能酶标仪,瑞士TECAN公司;EYELA N1300旋转蒸发仪、EYELA OSB2200油浴锅,东京理化器械(株)独资工厂;BT25s电子分析天平,赛多利斯科学仪器(北京) 有限公司;SHZ-D(III)型循环水真空泵,上海瑞兹仪器设备有限公司;A11BS025粉碎机,德国IKA。
1.4 试验方法
1.4.1 供试样品制备
取粗毛纤孔菌子实体130 g,粉碎后过100目筛,经1.2倍体积甲醇连续提取3次,每次24 h,过滤后合并3次提取液,减压浓缩,得到甲醇粗提物26.8 g。将甲醇粗提物溶解,按极性由小到大顺序依次用石油醚、乙酸乙酯、正丁醇萃取,每个极性分别萃取3次,合并各极性萃取液,减压浓缩,即得4个不同极性供试样品。将供试样品的浓度分别稀释为 15.625 μg·mL-1、31.250 μg·mL-1、62.500 μg·mL-1、125 μg·mL-1、250 μg·mL-1、500 μg·mL-1、1 000 μg·mL-1进行体外α-葡萄糖苷酶抑制作用及抗氧化能力测定。
1.4.2 总酚含量测定
按照参考文献[16],绘制标准曲线。根据Folin-Ciocalteu比色法原理,测定4种不同极性萃取物的总酚含量。将各极性萃取物的终浓度配制为1 000 μg·mL-1,以样品溶液代替没食子酸标准品,测定在波长750 nm下的吸光值。
1.4.3 α-葡萄糖苷酶抑制能力测定
按照参考文献[17],稍作修改进行测定。用pH 6.8磷酸盐缓冲溶液(含1%的二甲基亚砜溶液)配置样品溶液,测定在波长405 nm下的吸光值。以PBS(含1%的DMSO溶液) 为空白对照组,计算4种不同极性萃取物对α-葡萄糖苷酶抑制率(R1,%),公式为:

式中:Ax为样品吸光值;Ax0为样品本底吸光值;Ab为对照吸光值;A0为空白吸光值。
1.4.4 DPPH清除能力测定
DPPH是一种较稳定的自由基,溶于有机溶剂呈紫色,当有自由基清除剂类的物质存在时,DPPH自由基接受电子使溶液褪色,不同清除能力的物质会使溶液颜色产生变化,并使最大紫外吸收处的吸收值产生差异[18]。
按照参考文献[19],测定反应液在波长517 nm下的吸光值。以甲醇代替样品为空白组,以同浓度的2,6-二叔丁基对甲酚(BHT) 为阳性对照组。DPPH自由基清除率(R2,%) 计算公式为:
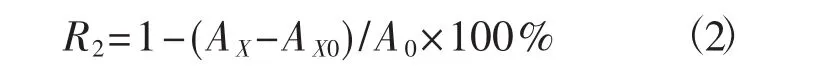
式中:AX为样品吸光值;AX0为显色剂本底吸光值;A0为空白吸光值。
1.4.5 ABTS自由基清除能力测定
参考Li等[20]的方法进行ABTS自由基清除能力的测定。测定各反应液在波长734 nm下的吸光值。以甲醇代替样品为空白组,以BHT为阳性对照组。ABTS自由基清除率(R3,%)计算公式为:

式中:AX为样品吸光值;AX0为显色剂本底吸光值;A0为空白吸光值。
1.4.6 总抗氧化能力测定
在酸性条件下,Fe3+可被样品中还原物质还原为Fe2+的价态,在波长593 nm下具有最大紫外吸收。根据氧化还原反应的比色法原理,将样品的吸光值换算为硫酸亚铁的浓度进行比较。
按照参考文献[21],配制FRAP工作液及硫酸亚铁标准溶液。样品的抗氧化能力以硫酸亚铁当量(mmol·g-1)表示,即1 g样品抗氧化能力相当于硫酸亚铁毫摩尔浓度。测定反应液在波长592 nm下的吸光值,以标准曲线求得硫酸亚铁浓度(μmol·L-1)定义为FRAP值。FRAP值越大,表示抗氧化能力越强。以无水乙醇为空白组,以BHT为阳性对照组。
1.4.7 数据处理
采用SPSS 20.0软件对数据进行处理及分析,通过GraphPad Prism 7.00软件作图。所有试验重复3次,数据均以±SE表示。
2 结果与分析
2.1 不同极性萃取物得率
粗毛纤孔菌甲醇粗提物经石油醚、乙酸乙酯、正丁醇溶剂萃取后,不同极性萃取物得率分别为11.9%、4.5%、24.6%。
2.2 不同极性萃取物总酚含量
粗毛纤孔菌子实体不同极性萃取物的总酚提取率的影响见图2。

图2 粗毛纤孔菌子实体不同极性萃取物总酚提取率Fig.2 Polyphenol yield of Inonotus hispidus fruiting body extracts
由图2可知,以没食子酸标准品的浓度为横坐标,吸光度为纵坐标绘制标准曲线,计算回归方程(R2=0.997 2) 为:

不同极性溶剂对多酚提取率影响较大,4种萃取物的多酚提取率有显著性差异(P<0.001)。乙酸乙酯萃取物多酚提取率最高,可达(10.21±0.03)%,其次分别为正丁醇萃取物(4.85±0.18)%、甲醇萃取物(1.85±0.04)%、石油醚萃取物(1.07±0.02)%。
2.3 不同极性萃取物对α-葡萄糖苷酶的抑制作用
粗毛纤孔菌子实体不同极性萃取物对α-葡萄糖苷酶抑制作用的情况见图3。
由图3可知,在试验浓度范围内,乙酸乙酯萃取物对α-葡萄糖苷酶的抑制作用显著高于其他极性萃取物(P<0.001),且随样品浓度升高,抑制率逐渐上升。1 000 μg·mL-1时,乙酸乙酯萃取物对α-葡萄糖苷酶的抑制率最高,为(98.17±0.60)%,其次是正丁醇萃取物(88.60±0.68)%,甲醇萃取物(50.62±1.32)%,石油醚萃取物 (6.12±0.60)%。结果表明,抑制α-葡萄糖苷酶活性的物质主要存在于乙酸乙酯和正丁醇萃取物中。
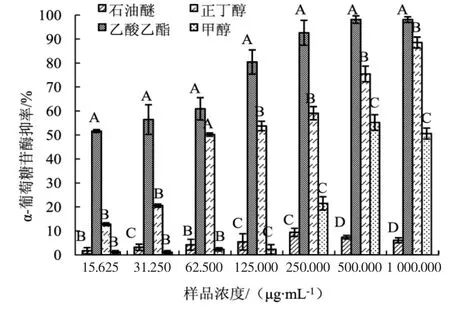
图3 粗毛纤孔菌子实体不同极性萃取物对α-葡萄糖苷酶抑制作用的测定Fig.3 The α-glucosidase inhibition of Inonotus hispidus fruiting body extracts
2.4 不同极性萃取物对DPPH自由基清除能力的影响
粗毛纤孔菌子实体4种萃取物对DPPH自由基的清除率的清除率见表1。
如表1所示,石油醚萃取物和乙酸乙酯萃取物对DPPH自由基均具有一定清除作用。500 μg·mL-1、1 000 μg·mL-1石油醚萃取物,125 μg·mL-1、250 μg·mL-1、500 μg·mL-1、1 000 μg·mL-1乙酸乙酯萃取物,DPPH自由基的清除能力与阳性对照BHT相当。
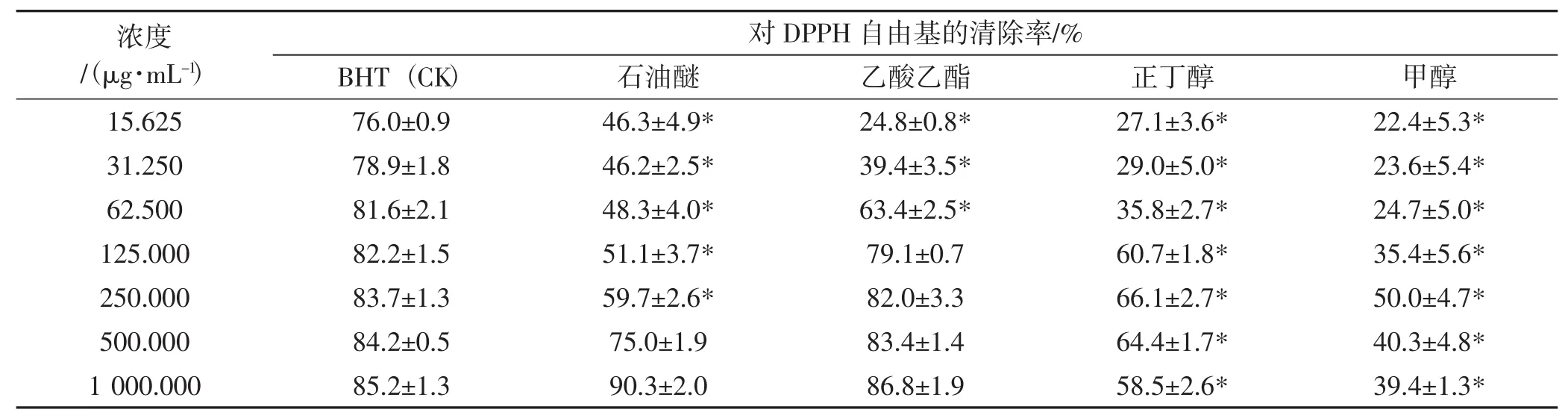
表1 粗毛纤孔菌子实体不同极性萃取物对DPPH自由基的清除率Tab.1 DPPH scavenging activity of Inonotus hispidus fruiting body extracts
2.5 不同极性萃取物对ABTS自由基清除能力影响
粗毛纤孔菌子实体不同极性萃取物对ABTS自由基清除率见表2。
由表2所示,清除率与萃取物浓度呈明显的效量关系,乙酸乙酯和正丁醇萃取物均显示出一定的ABTS自由基清除活性。500 μg·mL-1、1 000 μg·mL-1乙酸乙酯萃取物,1 000 μg·mL-1正丁醇萃取物对ABTS自由基清除能力与阳性对照BHT相比,无显著性差异。

表2 粗毛纤孔菌子实体不同极性萃取物对ABTS自由基清除率测定Tab.2 ABTS free radical scavenging capacity of Inonotus hispidus fruiting body extracts
2.6 不同极性萃取物对总抗氧化能力测定
由FeSO4标准曲线计算回归方程为:Y=0.569 7X+0.049 7,R2=0.999 3。粗毛纤孔菌子实体不同极性萃取物的总抗氧化能力测定见表3。
由表3可知,4种不同极性萃取物的总抗氧化能力具有明显的剂量依赖关系。250 μg·mL-1、500 μg·mL-1、1 000 μg·mL-1乙酸乙酯萃取物的 FRAP值,显著高于阳性对照BHT(P<0.05)。

表3 粗毛纤孔菌子实体不同极性萃取物的总抗氧化能力测定Tab.3 The total antioxidant capacity of Inonotus hispidus fruiting body extracts
3 讨论
当体内积累大量自由基无法正常代谢时,会使人体抗氧化能力下降,同时引发机体产生肺炎、糖尿病、癌症等病症[22]。粗毛纤孔菌作为一种珍贵的药用真菌,其含有的酚类物质可通过在体内调节代谢酶活性[23],体外清除自由基发挥抗氧化作用[24]。研究结果表明,在4种不同极性萃取物中,乙酸乙酯萃取物总酚含量最高,是石油醚萃取物的9.54倍、正丁醇萃取物的2.11倍、甲醇萃取物的5.51倍;与同浓度的4种不同极性萃取物相比,乙酸乙酯萃取物对α-葡萄糖苷酶的抑制作用最强;清除DPPH、ABTS自由基的能力与阳性对照BHT相比无显著性差异,总抗氧化能力显著高于阳性对照BHT。正丁醇萃取物的总酚含量、α-葡萄糖苷酶的抑制能力仅次于乙酸乙酯萃取物,说明粗毛纤孔菌发挥抗氧化作用的有效活性物质主要存在于乙酸乙酯和正丁醇萃取物中。因此,应对乙酸乙酯、正丁醇萃取物进行深层次的药理活性研究,进一步阐明粗毛纤孔菌发挥降糖、抗氧化作用的机制及途径,为深入开发粗毛纤孔菌的药用价值提供理论基础。

