术中高场强MRI联合荧光引导技术在脑胶质瘤切除术中的应用
董泽平 赵旸 陈凡 李文忠 陈大伟
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,手术全切除是延长无进展生存期(PFS)和提高生活质量的重要方法[1],但是由于肿瘤细胞分化差、增殖迅速、侵袭性强,术中常难以判断肿瘤边界,导致肿瘤残留[2],如果扩大切除范围,特别是位于脑功能区的肿瘤,可能造成永久性神经功能损伤。近年来,多种手术辅助技术如神经导航系统、荧光引导技术、术中超声检查(OUS)等的应用,使肿瘤全切除率显著提高[3-6],但各项技术均有其局限性,神经导航系统可随术中脑脊液释放和肿瘤部分切除引起脑漂移,降低准确性;低级别胶质瘤荧光素钠(FLS)和5-氨基乙酰丙酸(5-ALA)染色不明显,边缘模糊;术中超声检查难以辨别肿瘤边界和残留肿瘤。而术中MRI(iMRI)可以精准分辨肿瘤边界,辨认重要神经结构,并及时更新数据,纠正脑组织移位,准确判断肿瘤切除程度,从而在保留神经功能的前提下最大限度安全切除肿瘤[7]。研究显示,术中高场强MRI可以提高不同类型胶质瘤全切除率,并明显改善预后[8]。鉴于此,吉林大学白求恩第一医院对比分析荧光引导下脑胶质瘤切除术与术中高场强MRI联合荧光引导下脑胶质瘤切除术的有效性和安全性,以期提高患者术后无进展生存期和生活质量。
资料与方法
一、临床资料
1.纳入标准 (1)头部MRI显示额颞顶枕叶和丘脑占位性病变,T1WI呈低信号,周围存在大片高信号水肿区,增强扫描病灶呈明显不规则强化或环状强化。(2)均行荧光引导下肿瘤切除术,并经术中冰冻病理及术后病理证实为脑胶质瘤。(3)所有患者及其家属均对研究内容和手术方法知情同意并签署知情同意书。
2.排除标准 (1)影像学诊断为脑膜瘤、脑转移瘤、中枢神经系统淋巴瘤或脑脓肿。(2)病变位置表浅,位于非功能脑区的胶质瘤。(3)荧光素钠过敏试验阳性。(4)存在MRI扫描禁忌证或安全隐患。
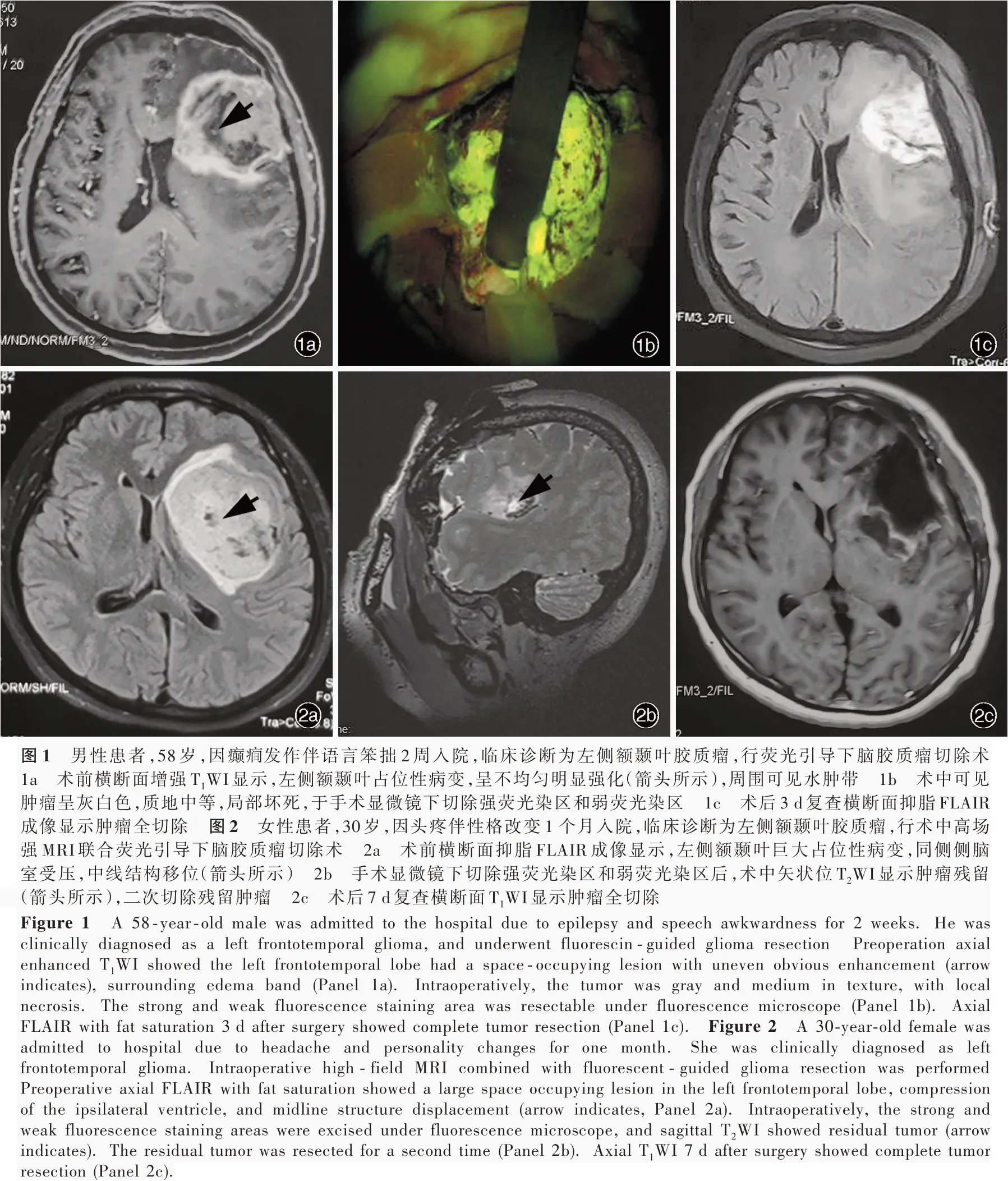
3.一般资料 选择2017年6月至2018年6月在吉林大学白求恩第一医院神经肿瘤外科住院治疗的脑胶质瘤患者共53例,男性39例,女性14例;年龄29~73岁,平均(48.24±23.12)岁;原发肿瘤46例(86.79%),复发7例(13.21%);肿瘤位于额叶26例(49.06%),颞 叶14例(26.42%),顶 枕 叶8例(15.09%),丘脑5例(9.43%);其中33例(62.26%)肿瘤位于重要脑功能区,分别位于运动区17例,语言区11例,丘脑5例。根据术中是否应用高场强MRI分为荧光引导组(28例)和术中高场强MRI联合荧光引导组(联合组,25例)。两组患者一般资料比较,差异无统计学意义(均P>0.05,表1)。

表1 联合组与荧光引导组患者基线临床资料的比较Table 1. Comparison of basic clinical data between combined group and fluorescence guidance group
二、研究方法
1.荧光引导下脑胶质瘤切除术 荧光引导组患者根据肿瘤部位摆放术中体位,气管插管全身麻醉。麻醉前行荧光素钠过敏试验,将0.50 ml荧光素钠注射液(5 ml:500 mg,美国Alcon Laboratories公司,进口药品注册证号:H20090507)以生理盐水稀释至5 ml(终浓度1%)静脉注射,监测患者生命体征和有无皮疹,15~30 min后无异常者即为荧光素钠过敏试验阴性。常规开颅显露肿瘤,静脉注射10%荧光素钠10 ml(10~15 mg/kg),观察肿瘤染色,自浅黄色逐渐加深,5~10 min达荧光染色高峰,于手术显微镜(OPMI PENTERO 900双荧光手术显微镜,德国Zeiss公司)下切除强荧光染区、弱荧光染区至无荧光染区,结束手术(图1)。本组有15例患者肿瘤位于重要脑功能区,术中同时行神经电生理监测,在直接皮质电刺激(DCS)保护下切除肿瘤。术中对切除的不同荧光染区行快速冰冻病理学检查。
2.术中高场强MRI联合荧光引导下脑胶质瘤切除术 联合组患者根据肿瘤部位摆放体位,气管插管全身麻醉。根据术前多模态MRI检查结果,避开重要脑功能区和神经传导束,选择适宜手术入路,于荧光引导下切除肿瘤,荧光素钠过敏试验同荧光引导组。如果术者发现肿瘤未全切除,肿瘤邻近重要脑功能区,脑脊液流失较多致脑组织移位而迷失肿瘤位置,或脑组织肿胀或膨出怀疑颅内出血时,行术中高场强(3.0T)MRI检查,由术者和影像科医师共同根据增强T1WI和T2-FLAIR成像判断是否肿瘤残留及其残留程度。确定无颅内血肿后重新标记残留肿瘤,勾画神经传导束,纠正脑组织移位,必要时可以重复行MRI检查,直至全切除肿瘤(图2),瘤腔内无需止血材料以免干扰术中MRI的评估。肿瘤全切除为MRI增强扫描显示残留肿瘤体积<0.175 cm3[9],肿瘤体积(cm3)=长径×宽径2/2[10]。
3.观察指标 (1)有效性:详细记录术中高场强MRI扫描次数、手术时间、肿瘤全切除率、脑功能区肿瘤全切除率、肿瘤复发率和病死率。(2)安全性:记录术后言语障碍、运动障碍、精神障碍、颅内感染和颅内出血等并发症发生率。
4.统计分析方法 采用SPSS 17.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验或Fisher确切概率法。呈正态分布的计量资料以均数±标准差(±s)表示,采用两独立样本的t检验。以P≤0.05为差异具有统计学意义。
结 果
本研究53例患者均顺利完成手术,肿瘤全切除42例(79.25%),次全切除11例(20.75%);其中33例肿瘤位于重要脑功能区(运动区、语言区、丘脑),肿瘤全切除25例(75.76%),次全切除8例(24.24%);经术后病理证实星形细胞瘤(WHOⅡ级)12例(22.64%),间变性星形细胞瘤(WHOⅢ级)17例(32.08%),胶 质 母 细 胞 瘤(WHOⅣ级)24例(45.28%);术后出现言语障碍16例(30.19%)、短暂性肢体活动障碍21例(39.62%)、精神障碍6例(11.32%)、颅内感染8例(15.09%)、少量硬膜外血肿2例(3.77%),予以脱水、甲泼尼龙冲击、营养神经、镇静和抗感染对症治疗后7天至3个月恢复正常,无死亡病例。联合组患者行术中MRI扫描1~2次,手术时间长于荧光引导组(P=0.000),肿瘤全切率高于荧光引导组(P=0.031),WHO分级比例两组差异具有统计学意义(P=0.036),而重要脑功能区肿瘤全切除程度(P=0.101)和术后并发症发生率(P=1.000)组间差异无统计学意义(表2)。
本组术后有41例高级别(WHOⅢ级和Ⅳ级)胶质瘤患者辅以放疗和替莫唑胺化疗。随访6~12个月,有11例(20.75%)患者肿瘤复发,其中,荧光引导组8例,6例再次手术获得全切除;联合组3例,1例再次手术获得全切除、2例放弃治疗,两组肿瘤复发率差异无统计学意义(P=0.138,表2)。

表2 联合组与荧光引导组患者术后临床资料的比较Table 2. Comparison of postoperative clinical data between combined group and fluorescence guidance group
讨 论
荧光素钠pH值为8时荧光染色最强,静脉注射后有60%~80%与血清白蛋白结合,其余为游离荧光素,可产生强烈的荧光。胶质瘤呈侵袭性生长破坏血-脑屏障,荧光素钠透过血-脑屏障进入肿瘤组织和肿瘤侵袭的脑组织,从而呈荧光染色,据此可清晰辨认出肿瘤边界,术中指导肿瘤切除。Kuhnt等[11]于荧光素钠引导下切除胶质母细胞瘤,术中清晰显示肿瘤与正常脑组织的界限,且荧光染色区与术前CT/MRI增强区相吻合。Wu等[12]于荧光素钠引导下切除多形性胶质母细胞瘤,肿瘤全切除率达84.4%,且未出现高剂量荧光素钠导致的不良反应。国内陈大伟等[13]于荧光素钠引导下切除脑胶质瘤,手术全切除率为80%。本组患者均静脉注射荧光素钠,术中荧光染色边界与术中冰冻病理学和术后病理学结果相一致,证实强荧光区是肿瘤主体部分,弱荧光染区是术中常误认为正常脑组织的部分,其中12例星形细胞瘤(WHOⅡ级)患者荧光染色不明显,提示荧光素钠染色在高级别胶质瘤切除术中可清晰显示肿瘤边界,从而提高肿瘤全切除率,但是对于血-脑屏障破坏不严重的低级别胶质瘤,荧光素钠染色则不明显。此外,荧光素钠无法进入肿瘤细胞内,故其标记肿瘤的特异性较差,周围正常脑组织亦可呈荧光染色[14],因此,荧光引导技术尚不足以用于无神经功能损害的脑胶质瘤的全切除。本研究荧光引导组有15例肿瘤位于重要脑功能区,其中15例行术中神经电生理监测,肿瘤全切除9例,全切除率为60%,可能与低级别胶质瘤血-脑屏障相对完整、荧光素钠无染色有关。术后16例出现言语障碍、21例发生短暂性肢体活动障碍、6例出现精神障碍、8例发生颅内感染、2例出现少量硬膜外血肿,予脱水、甲泼尼龙冲击、营养神经、镇静和抗感染对症治疗后,7天至3个月恢复。
近年来,随着iMRI的应用,术者可以直观分辨肿瘤边界,辨别重要神经结构,纠正脑组织移位,从而判断肿瘤切除程度,并使二次手术对脑组织的损伤最小化[15]。iMRI通过客观的影像学证据,实时判断有否肿瘤残留,并在保护神经功能的前提下最大限度切除肿瘤,使术者操作更精准,降低手术损伤。Kuhnt等[16]和Woodworth等[17]认为,即使术者判断显微镜下肿瘤全切除,仍有33%~67%残留,单纯采用神经导航系统也有约30%的肿瘤残留。周权炜等[18]在41例岛叶胶质瘤切除术中行MRI检查,肿瘤全切除16例,次全切除18例,大部切除7例。丁大领等[19]在28例丘脑胶质瘤切除术中行MRI检查,肿瘤全切除率达71.43%(20/28)。Hofmann等[20]的研究显示,术中高场强(1.5T)MRI对残留肿瘤诊断的灵敏度为98%,特异度为94.3%,准确度为96.1%,显著优于术中超声和术中低场强(0.15T)MRI。本研究有25例术前行多模态MRI导航,精确定位肿瘤体表投影,得以设计手术切口和骨窗,明确肿瘤、脑功能区、神经传导束和神经血管的解剖关系,从而制定手术入路和策略,并于术中神经电生理监测下尽可能保留神经功能,于荧光引导下最大限度切除肿瘤,术中首次MRI显示13例肿瘤全切除,余12例肿瘤位于重要脑功能区有不同程度残留,更新手术计划后最终10例全切除,2例因残留肿瘤紧邻重要皮质功能区或者皮质下传导束而次全切除,术后出现言语障碍6例、短暂性肢体活动障碍8例、精神障碍2例、颅内感染3例,硬膜外血肿1例,经对症治疗后于7天至3个月恢复正常,表明术中高场强MRI联合荧光引导下脑胶质瘤切除术可以降低术后永久性神经功能障碍发生率,提高患者生活质量、延长无进展生存期。
本研究有33例(62.26%)肿瘤位于重要脑功能区,分别位于运动区17例、语言区11例、丘脑5例,肿瘤全切除25例(75.76%),次全切除8例(24.24%),而联合组与荧光引导组肿瘤全切除率差异无统计学意义,可能是由于联合组重要脑功能区肿瘤次全切除仅2例,样本量太小,今后尚待扩大样本量进一步验证。本组患者术后随访6~12个月,平均9个月,有11例(20.75%)肿瘤复发,其中,荧光引导组8例,6例再次手术获得全切除;联合组3例,1例再次手术获得全切除、2例放弃治疗,两组肿瘤复发率差异无统计学意义。联合组手术时间较荧光引导组耗时2~3小时,术中行MRI检查时术者及相关人员均及时撤离至中控室,扫描完成后所有人员重新更换无菌手术衣,关颅时以含万古霉素的生理盐水反复冲洗术区,从而有效减少颅内感染。
综上所述,术中高场强MRI联合荧光引导技术可以显著提高脑胶质瘤全切除率,同时尽可能保留重要脑功能区和神经结构,提高患者生活质量和延长无进展生存期。
利益冲突无

