18F-FDG PET/MR 在乳腺癌分期及复发检测中的临床应用研究
阳依宏,王海岩,祁 纳,陈 兴,尤志雯,吴蕾芬,赵 军
(同济大学附属东方医院核医学科,上海 200120)
乳腺癌已经成为女性最常见的恶性肿瘤,严重威胁人类生命健康,术前准确评估原发灶以及淋巴结和远处转移,有助于患者的正确分期,进而对治疗方案的个体化制定、改善患者预后和降低死亡率意义重大[1]。近年来,已有多种影像学检查被应用于乳腺癌中,有部分学者[2-3]对MR 和PET/CT 在乳腺癌中的应用价值进行了研究,发现两种影像学检查具有各自的优势和不足。PET/MR 是目前最先进的医学影像设备之一,具备多种分子探针以及MR 参数和序列,软组织分辨率更高,辐射剂量极低[4],但由于其较高的检查费用和较低的设备普及率,尚未广泛应用于临床诊疗过程中。目前关于PET/MR 乳腺癌诊治中的研究报道较少,本研究通过对29 例乳腺癌患者的18F-FDG PET/MR 检查结果与手术病理和临床随访等资料进行对比分析,探讨PET/MR 在乳腺癌分期及复发检测中的应用价值。
1 资料与方法
1.1 一般资料
回顾性分析2019 年1 月—2021 年5 月于我科行18F-FDG PET/MR 检查的29 例乳腺癌患者的资料,均为女性,年龄30~78 岁,平均59 岁,其中术前患者12 例,术后复查患者17 例。术前患者纳入标准:①接受18F-FDG PET/MR 检查前未行手术、放疗与化疗等;②均经病理学检查(手术病理8 例,活检病理4 例)确定病理类型。排除标准:①合并其它恶性肿瘤;②临床资料不全者。术后患者纳入标准:①手术后至PET/MR 检查时间>3 月。排除标准:①乳腺癌行2 次及以上手术者;②临床资料不全者。本研究由我院医学伦理审查委员会批准,且患者均签署知情同意书。
1.2 PET/MR 检查方法
采用联影uPMR 790 PET/MR 仪,检查前患者空腹4~6 h,测定空腹血糖<11.1 mmol/L 后,按体质量经肘静脉注射18F-FDG(0.08~0.10 mCi/kg 体质量),60 min 后行俯卧位乳腺扫描(术前分期患者)及全身扫描。俯卧位乳腺PET/MR 扫描使用乳腺专用线圈,图像包括乳腺PET 成像(1 个床位,25 min)、T1加权成像、多方位T2加权脂肪抑制成像、弥散加权成像、动态对比增强成像及容积插入法屏气扫描,全身扫描包括全身PET 成像(躯干4 个床位,3 min;脑部1 个床位,8 min)、T1加权成像及多方位T2加权成像。使用组织分割法分割脂肪、水和软组织进行PET衰减校正。DWI 扫描参数:自旋回波-平面回波(SEEPI)序列,TR 5 000 ms,TE 100 ms,层厚5 mm,间隔1 mm,FOV 34 cm,矩阵256×256,b 值为0、800 s/mm2。
1.3 图像分析
采用随机自带工作站进行图像重建后处理,在图像显示病灶的最佳层面手动勾画感兴趣区,使用随机自带软件计算病灶的最大标准摄取值,由2 名核医学科医师(均具有10 年以上的影像诊断经验)对PET/MR 图像进行分析诊断,意见不一致时通过协商确定诊断,随后进行临床资料随访,记录后续诊治情况及病灶随访结果。
1.4 诊断标准
对于术前患者,评估PET/MR 分期与金标准的诊断一致性;术后复查患者则评估PET/MR 与最终病理诊断及随访的诊断一致性。
PET/MR 分期:使用美国癌症联合委员会(AJCC,American Joint Committee on Cancer)和国际抗癌联盟(UICC,Union for International Cancer Control)建立的TNM 分期系统(2016 年修订,第八版)[5]结合全身PET/MR 图像进行分期(参考MR 影像表现及18F-FDG 代谢的异常[6])。
金标准:手术治疗后的病例以术后病理为金标准;未经手术治疗的病例,如有穿刺活检病理,将其作为金标准,如未行穿刺活检,则以临床查体、PET/MR 图像及随访结果等综合评估。
真阳性:PET/MR 提示恶性或可疑恶性病变,并通过最终病理诊断及随访证实为恶性。
假阳性:PET/MR 提示恶性或可疑恶性病变,但通过最终病理诊断及随访证实为良性。
真阴性:PET/MR 提示良性或可疑良性病变,且通过最终病理诊断或随访证实为良性。假阴性:PET/MR 提示良性或可疑良性病变,但通过最终病理诊断或随访证实为恶性。
1.5 统计学方法
利用SPSS 22.0 统计软件,采用Kappa 一致性检验评估术前患者PET/MR 分期、临床分期与金标准的诊断一致性(Kappa 取值在0~1 之间,Kappa值<0.4 表示一致性较差,Kappa 值为0.4~<0.75 表示一致性一般,Kappa 值≥0.75 表示一致性较高,P<0.05 为差异有统计学意义),并分别计算二者的诊断一致率;对于术后复查患者,根据最终病理诊断和随访结果计算PET/MR 诊断的灵敏度、特异性、准确率、真阳性率、真阴性率、假阳性率、假阴性率。
2 结果
2.1 术前乳腺癌患者PET/MR 分期与金标准对比
12 例乳腺癌患者术前PET/MR 分期及金标准结果详见表1;PET/MR 分期与金标准的诊断符合率是91.6%(11/12),1 例患者PET/MR 评估病灶大小为1.9 cm×1.5 cm,手术评估病灶大小为2.3 cm×2.0 cm,导致分期从Ⅰa 期更改为Ⅱa 期。Kappa 分析表明:PET/MR 分期与金标准的诊断一致性较高(Kappa值=0.892),差异有统计学意义(P<0.01)。图1 为1例乳腺癌治疗前患者的18F-FDG PET/MR 图像。
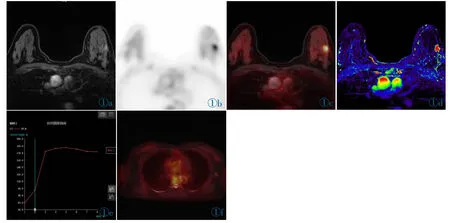
图1 女,49 岁,左侧乳腺癌伴左侧腋窝淋巴结转移。T1WI(图1a)示左侧乳腺外下象限高信号结节影(红箭),大小约1.2 cm×1.2 cm,PET(图1b)及PET/MR 融合图像(图1c)示病灶18F-FDG 摄取异常增高(SUVmax=4.3)。图1d 为正性增强积分图,可见病灶为高信号,代表增强累积剂量高。图1e 为增强曲线,为平台型。左侧腋窝见肿大淋巴结(图1f,白箭),18F-FDG 摄取轻度增高(SUVmax=0.99)。Figure 1. A 49-year-old female patient with left breast cancer and left axillary lymph node metastasis.T1WI(Figure 1a) showed high signal intensity nodular shadow in the outer lower quadrant of the left breast (red arrow),the size was about 1.2 cm×1.2 cm;PET(Figure 1b) and PET/MR fused image(Figure 1c) showed its abnormal increased uptake of 18F-FDG(SUVmax=4.3);The positive enhancement integral graph(Figure 1d) showed the high signal intensity of the lesion,also high cumulative dose;The enhancement curve was plateau type(Figure 1e);Enlarged lymph node(SUVmax=0.99) was found in the left axillary(Figure 1f,white arrow).
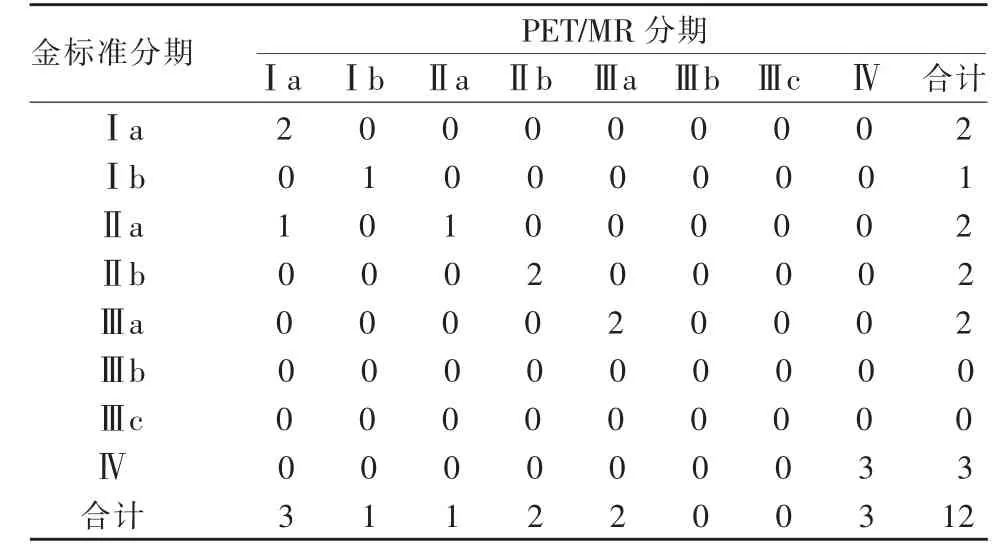
表1 乳腺癌PET/MR 分期及金标准分期诊断结果
2.2 乳腺癌术后患者PET/MR 诊断结果
在17 例术后乳腺癌患者中,真阳性4 例,转移部位分别是肝脏、骨、淋巴结、肺;假阳性1 例,PET/MR 提示左乳内上象限深部异常信号影,放射性摄取轻度增高,经病理证实为左乳腺病伴疤痕增生;真阴性12 例,12 例患者随访5~10 月(平均7.7 月)无复发表现;本组无假阴性患者。PET/MR 的灵敏度为100%,特异性为92.3%,准确度为94.4%,阳性预测值为80%,阴性预测值为100%。图2 为1 例乳腺癌术后复查患者的18F-FDG PET/MR 图像。
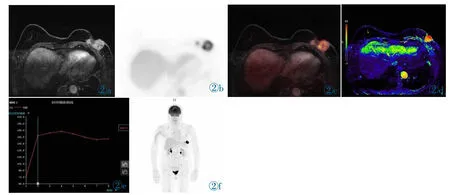
图2 女,78 岁,左侧乳腺癌术后复查。图2a:T1WI 增强示左乳腺外上象限高信号影(红箭头),大小约3.5 cm×3.0 cm,病灶SUVmax 为9.99。图2b,2c:PET 及PET/MR 融合图像。图2d:正性增强积分图,可见病灶为高信号,代表增强累积剂量高。图2e:增强曲线,为平台型。图2f:全身MIP 图。Figure 2. A 78-year-old female patient’s postoperative reexamination with left breast cancer.T1WI (Figure 2a) showed high signal intensity nodular shadow in the outer upper quadrant of the left breast (red arrow),the size was about 3.5 cm×3.0 cm and SUVmax was 9.99;Figure 2b and 2c was PET and PET/MR used image;The positive enhancement integral graph (Figure 2d) showed the high signal intensity of the lesion,also high cumulative dose;The enhancement curve was plateau type(Figure 2e);Figure 2f was whole body MIP image.
3 讨论
目前,早期诊断乳腺癌常用的影像学检查方法有钼靶X 线摄影、超声和MR。乳腺钼靶X 线摄影对50 岁以上亚洲妇女准确性较高,但对40 岁以下人群、致密型乳腺、假体植入及手术后瘢痕形成者具有一定的局限性。乳腺超声检查单独作为筛查措施的有效性尚未获得充分的证据,而MR 可作为钼靶X 线检查、乳腺临床体检或超声检查发现的疑似病例的补充检查措施[7],也有研究指出,MR 检测同侧乳腺的多灶性、多中心癌以及对侧乳腺多原发癌的灵敏度较高[8]。18F-FDG PET/CT 显像目前已广泛应用于各种恶性肿瘤的早期诊断、分期、疗效评估中,一次成像即可评估原发灶、淋巴结及远处转移。其对于乳腺癌患者的诊断价值已有大量研究,均报道对原发乳腺肿瘤的灵敏度较低。如Kumar 等[9]评估了111 名治疗前乳腺癌患者,得出18F-FDG PET/CT 的诊断灵敏度为48%,Avril 等[10]评估了144 名治疗前乳腺癌患者,灵敏度为64.4%,可见PET/CT 对乳腺癌的早期诊断价值有限,其原因可能是PET/CT 对乳腺癌较小的病灶探测灵敏度较低[11]。
PET/MR 的软组织分辨率更高,对乳腺解剖结构、病灶的浸润及小病灶的显示更清晰。本研究结果显示,PET/MR 分期与金标准的诊断一致性较高,其原因可能不仅是PET/MR 可提供分子代谢信息以及对解剖结构和病灶更清晰的显示,MR 多参数多序列成像也可能有助于对病灶的评估,如DWI 序列对病灶的高灵敏度,能够检出PET/CT 中可能漏诊的FDG 低代谢性病变,而对于一些DWI 可能误诊为恶性的良性肿瘤,则可以通过分析FDG 代谢情况进一步提高诊断准确性。有国外研究[12]报道PET/MR 对治疗前乳腺癌患者的分期(正确分期50/51 例)比DWI(正确分期43/51 例)和PET/CT(正确分期38/51 例)更准确,而本研究中PET/MR 分期与金标准的诊断符合率是91.6%,略低于前述文献(98.0%),可能是由于本研究中术前乳腺癌患者的数量较少。多项研究指出,PET/MR 对原发病灶的诊断能力优于MR 和PET/CT。例如Grueneisen 等[13]认为,MR 和PET/MR 比PET/CT 更有可能确定准确的肿瘤最大直径,PET/MR 的T 分期正确率为82%,PET/CT 为68%。Sawicki 等[14]发现,PET/MR 对复发的乳腺癌患者全身分期的诊断效能最高。PET/MR 可检出全部病 灶,而PET/CT、MR 和CT 的检出率分别为97.0%、96.2%和74.6%,PET/MR 鉴别良恶性病变的准确性最高(98.5%),PET/CT、MR 和CT 分别为94.8%、88.1%和57.5%。
本研究的局限性:首先,纳入研究的术前乳腺癌患者数量较少,且各分期的患者数量不均,为了更准确的评估PET/MR 对乳腺癌分期的应用价值,待收集更多病例进一步研究。其次,乳腺癌术后患者的随访时间较短,本研究评估为真阴性、假阳性的患者的最终临床结局存在变化的可能。
总之,PET/MR 作为一种新兴的多模态分子影像技术,包含多种分子探针以及MR 参数和序列,可更准确的对乳腺癌原发灶、淋巴结转移和远处转移进行评估,为乳腺癌的诊疗决策提供更多更准确的信息。但是PET/MR 也存在技术复杂、费用较高、检查时间较长、存在检查禁忌症及设备普及率低等局限性。相信随着PET/MR 成像技术和显像剂的不断发展,以及临床应用研究的不断深入和经验积累,乳腺癌将可能成为PET/MR 临床应用中的优势检查病种之一。

