基于静电喷雾法萝卜硫素微胶囊的制备与表征
王 枭,孟官丽,王齐蕾,汪浪红,范代娣,吕新刚,
(1.西北大学食品科学与工程学院,陕西 西安 710069;2.西北大学化工学院,陕西省可降解生物医用材料重点实验室,陕西 西安 710069)
萝卜硫素(sulforaphane,SF)是迄今为止从蔬菜中发现的抗癌活性最强的物质之一[1],同时具有较强的抗氧化、抗炎、抑菌等活性,广泛存在于西兰花等十字花科植物中,但其性质不稳定,易受氧、热、碱等条件的影响而降解,使其在食品、医药等行业中的应用受到限制。微胶囊化技术是保护目标成分的一种工具,可将有效成分截留在微纳米级基质中,提高其稳定性。蛋白或多糖等具有高度生物相容性和生物降解性的大分子聚合物常被用作包封基质。
目前反溶剂沉降、冷冻干燥、喷雾干燥、纳米沉淀、脂质体等技术已被用于制备SF微纳米载体,Wu Huahua等[2]利用共沉淀法将SF与羟丙基-β-环糊精包合,提高了SF对环境因子的抗性,但制备过程较为复杂。Ko等[3]利用冷冻干燥技术制备了SF-PLGA微球,用于治疗骨关节炎,但微球生产过程中涉及有机溶剂二甲基亚砜和二氯甲烷,应用于开发功能性食品或医药时,安全性受其残留率影响,而且耗时、成本高。Wu Yuanfeng等[4]通过喷雾干燥技术制备SF微胶囊,但包封率仅为12.6%~39.8%,较低的包封率主要是由于喷雾干燥器进风温度高(190 ℃)导致SF分解。静电喷雾是一种新型高效的非热加工包封技术,工艺简单、灵活、经济,对封装热敏活性物质十分有利[5],在疏水性(姜黄素、白藜芦醇、α-亚麻酸等)或亲水性(表没食子儿茶素没食子酸酯、花青素等)生物活性物质的包封中已多有报道[6],但其用于包封SF鲜见报道。
本研究以玉米醇溶蛋白(Zein)、壳聚糖(chitosan,CS)和明胶(gelatin,Gel)为载体,采用单轴和同轴静电喷雾技术制备负载SF的纳米粒子,应用扫描电子显微镜(scanning electron microscope,SEM)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)和热重分析表征微胶囊表面形貌、分子间相互作用和热行为,并研究了微胶囊在模拟胃肠环境和食品基质中的释放特性以及在高温下的贮存稳定性,以阐明应用不同壁材通过静电喷雾方法包封SF的可行性。该研究有助于进一步构建适用于SF的递送载体,进而促进其产业化应用。
1 材料与方法
1.1 材料与试剂
萝卜硫素 Sigma试剂(上海)有限公司;玉米醇溶蛋白 合肥博美生物科技有限公司;明胶 郑州万搏化工产品有限公司;壳聚糖 上海蓝季生物科技发展有限公司;无水乙醇、冰乙酸、甲醇 西安中佳科技有限公司。
1.2 仪器与设备
JDF05静电纺丝机 长沙纳仪仪器科技有限公司;UltiMate 3000型高效液相色谱仪 美国赛默飞世尔科技公司;Gemini 300 SEM 德国卡尔蔡司股份公司;IRAffinity-1S FTIR仪 日本岛津公司;STA 449F3热重分析仪 德国耐驰仪器制造有限公司;HL-25A台式电热恒温干燥箱 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 静电喷雾溶液配制
SF微胶囊静电喷雾溶液配制见表1,包封前溶液均需磁力搅拌均匀。

表1 聚合物溶液配制Table 1 Preparation of polymer solutions
1.3.2 SF微胶囊制备
静电喷雾系统由高压电源(0~30 kV)、注射泵和不锈钢板收集器组成。将聚合物溶液导入5 mL注射器中,置于注射泵的凹槽上,通过聚四氟乙烯导管与定制的不锈钢针头(22/17G)连接。针头固定在高压电源的正极上,与接地的收集器垂直放置。具体工艺参考文献[7]并根据本课题组前期预实验稍作改动,系统运行参数见表2。
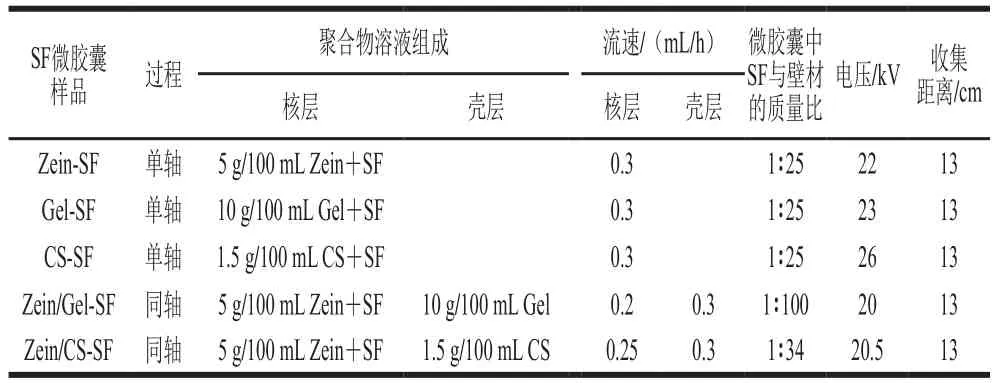
表2 制备SF微胶囊的系统运行参数Table 2 Operating parameters for preparing SF microcapsules
1.3.3 SF质量测定
根据吴元锋[8]的研究并结合实际情况确定测定SF质量的高效液相色谱方法。采用UltiMate 3000型高效液相色谱仪(配有二极管阵列检测器);色谱柱为Zorbax SB-C18(250 mm×4.6 mm,5 μm);检测波长195 nm;流动相为体积分数28%甲醇溶液(超纯水配制);等度洗脱,洗脱时间20 min;流速1.0 mL/min;柱温30 ℃;进样量10 μL。将不同质量浓度的SF标准溶液过0.22 μm滤膜后进样,以质量浓度和峰面积分别为横、纵坐标作标准曲线,标准曲线方程为y=515.34x-0.438 6(R2=0.999 9),SF峰值在15 min时出现,将样品在15 min时对应的峰面积代入标准曲线,通过换算计算SF质量,单位为mg。
1.3.4 包封率及负载量的测定
单轴微胶囊分别用各自溶剂溶解壁材,同轴微胶囊先用一定体积的体积分数50%乙酸溶解外层壁材,再用等体积的体积分数80%乙醇溶解内层Zein,然后使用高效液相色谱测定SF质量,根据式(1)、(2)分别计算包封率和负载量。

1.3.5 SEM观察
使用Gemini 300 SEM表征微胶囊形貌特征。加速电压5 kV、工作距离6.5~7.5 mm,观察前将样品黏附于导电胶上并在真空下用金溅射镀膜。使用Nano Measurer软件对每个测试样品的尺寸进行统计分析,以获得粒径的大小和分布区间。
1.3.6 FTIR分析
使用IRAffinity-1S FTIR仪分析微胶囊中的官能团和可能的化学相互作用。扫描范围为400~4 000 cm-1,分辨率为0.4 cm-1。
1.3.7 热重分析
采用STA 449F3热重分析仪,记录微胶囊质量和质量损失速率随温度变化的情况。从30 ℃加热到900 ℃,升温速率为10 ℃/min,动态氮气气氛,流速为100 mL/min。
1.3.8 体外释放行为考察
参考赵彬然[9]和Bhushani[10]等的方法并略加修改,考察模拟胃肠道消化对SF释放的影响。称取1.00 mg SF微胶囊,加入5 mL模拟胃液(pH 1.2),将混合物在37 ℃水浴振荡培养2 h,胃消化结束后,再加入5 mL模拟肠液(pH 7),37 ℃振荡反应4 h。消化期间每隔30 min取出0.5 mL并补充等量消化液。
根据欧盟法规EU 10/2011中规定,选用体积分数10%乙醇溶液和体积分数3%乙酸溶液分别模拟水性和酸性食品基质,考察SF在模拟食品基质中的释放情况。称取1.00 mg SF微胶囊,加入20 mL模拟基质溶液,50 r/min室温磁力搅拌,定时取样0.5 mL,并补充等量模拟基质溶液。采集的样品经乙酸乙酯萃取、真空旋转蒸发器浓缩、甲醇定容、0.22 μm滤膜过滤后,通过高效液相色谱法测定SF质量,根据式(3)计算SF累积释放率,并绘制释放曲线。
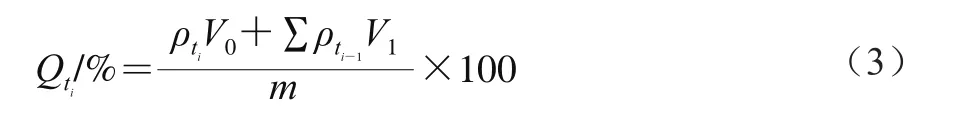
式中:Qti为ti时刻累积释放率/%;ρti和ρti-1分别ti和ti-1时刻待测液中SF质量浓度/(mg/mL);V0为释放介质体积/mL;V1为每次取样的体积(0.5 mL);m为样品中实际SF质量/mg。
1.3.9 热稳定性分析
参考Wu Huahua[2]和Wu Yuanfeng[11]等的方法并稍作修改,考察SF微胶囊的热稳定性。将SF微胶囊和等效的游离SF分装于离心管中,置于(60±2)℃恒温干燥箱中,每隔3 h取出一管,测定SF质量。以保留率来评价各壁材对SF稳定性的影响。

1.4 数据统计与分析
每组实验平行3 次,采用SPSS 24软件对数据进行统计,结果用平均值±标准差来表示,采用Origin Pro 8软件作图。
2 结果与分析
2.1 SF微胶囊的包封率和负载量
SF微胶囊的包封率和负载量见表3,Zein和Gel单轴微胶囊的包封率均高于95%,Zein/Gel和Zein/CS同轴微胶囊的包封率分别为(83.12±0.17)%和(68.01±7.50)%,这可能与SF和胶囊的质量比即理论负载量有关,负载量不同意味着芯材和壁材的分布不同,从而影响了微胶囊结构,使得SF的包封率产生了差异[12]。CS单轴微胶囊的包封率最低,仅为(10.77±1.19)%,可能是由于CS与SF之间发生化学相互作用,使SF未能从CS中完全脱离。总之,SF与壁材之间的质量比[13]、微胶囊的外观形态以及芯材与壁材聚合物之间的相互作用[14]都可能会影响包封率和负载量。另外,微胶囊中SF的提取和测定方法以及芯材在所选壁材溶液中的溶解度也会对微胶囊的包封率和负载量产生影响。

表3 SF微胶囊的粒径、包封率和负载量Table 3 Particle size, encapsulation efficiency and loading capacity of SF microcapsules
2.2 SF微胶囊的SEM分析结果
微胶囊的SEM图与粒径分布图见图1。3 种单轴微胶囊球形状良好、表面光滑,与Zein、Gel和CS良好的成膜能力有极大的关系[15],其中Gel-SF粒子一侧呈凹陷结构,可能与Gel溶液性质和喷雾条件有关。两种同轴纳米粒子的表面形貌区别于单一壁材制备的纳米粒子,其表面粗糙,呈现较多褶皱,可能是由于核壳结构内外溶剂挥发性的不同导致外部Gel或CS轻微凹陷,另外核壳壁材之间的相互作用也有一定的影响。
微胶囊平均粒径范围为427.80~1 857.04 nm(表3),粒径与电压、溶液浓度、流速等有关,一般随电压增大而减小,随浓度和流速增大而增大[16],也受复合因素的影响。从粒径分布图(图1F)中可以看出,Zein-SF、CS-SF和Zein/CS-SF微胶囊粒径分布较为集中,Gel-SF和Zein/Gel-SF分布较为分散。总之,静电喷雾技术可获得致密球形纳米粒子,所得结构的形态和粒径在很大程度上受溶液性质、工艺参数的影响,改变材料、浓度和喷雾电压、流速等可调整微胶囊形状。

图1 SF微胶囊的SEM图和粒径分布图Fig.1 Scanning electron micrographs and particle size distribution of SF microcapsules
2.3 SF微胶囊的FTIR分析结果
FTIR谱图可用于表征复合物的分子间相互作用。如图2所示,SF显示4 个特征峰,2 187~2 113 cm-1(—N=C=S伸缩振动吸收峰)、1 453 cm-1(C—H变形振动吸收峰)、1 350 cm-1(C—H变形振动吸收峰)和1 251 cm-1(C—N伸缩振动吸收峰)。
Zein和Gel的FTIR谱形基本相似,3 299 cm-1/3 279 cm-1(酰胺A带)和3 064 cm-1(酰胺B带)处的峰与N—H拉伸有关,2 958 cm-1(C—H伸缩振动)、1 645 cm-1/1 635 cm-1(酰胺I带)处的峰与C=O伸缩振动有关,1 536 cm-1(酰胺II带)和1 240 cm-1(酰胺III带)处的峰分别与N—H和C—N偶合有关[17]。Gel特征峰在1 332 cm-1(脯氨酸CH2振动)和1 082 cm-1(C—O—C伸缩振动)处。同轴Zein/Gel有Gel的特征峰(1 326 cm-1和1 082 cm-1)证明核壳结构的形成,这与Torkamani等[18]报道的结果一致,酰胺A带(3 294 cm-1)和酰胺I带(1 639 cm-1)的特征峰介于Zein和Gel位移波数之间,可能是由于Gel和Zein之间的氢键相互作用[19],酰胺B带(3 067 cm-1)和酰胺III带(1 246 cm-1)的特征峰均向高波数轻微转移,可能是静电相互作用的影响[20]。

图2 游离和微胶囊形式SF的FTIR图Fig.2 Fourier transform infrared spectra of SF in free and encapsulated forms
CS的FTIR谱图中3 250、2 878 cm-1归属于糖环内及糖环上C—H的伸缩振动,1 547、1 408 cm-1处的强吸收峰分别归属于酰胺I带和酰胺II带;1 065 cm-1处的强吸收峰对应于糖环上C—O键的伸缩振动。同轴Zein/CS有CS的特征峰(1 408 cm-1),表明形成了核壳结构,同时氢键带有轻微偏移,说明Zein和CS之间有氢键形成,另外在1 340~1 140 cm-1附近的谱图区别于Zein和CS,可能是由于CS中带正电荷的氨基与Zein中带负电荷的氨基酸残基间的静电相互作用[21]。SF微胶囊与对应壁材微胶囊的谱图基本一致,没有新的特征峰出现,表明壁材与SF间无新化学键形成,壁材仅用作SF载体而不改变其性质,属于物理包封[22]。另外Zein-SF、Gel-SF、Zein/Gel-SF在2 187~2 113 cm-1附近出现了SF特征峰(—N=C=S的伸缩振动),说明SF被成功包封,而CS-SF、Zein/CS-SF未发现SF特征峰,可能是由于SF负载量较低,被壁材的强特征峰所掩盖。
2.4 SF微胶囊的热重分析结果
微分热重图反映微胶囊降解速率与温度的关系,分别在100 ℃和300 ℃附近出现两个峰,在这两处微胶囊降解速率达到最大。100 ℃附近降解速率最大,可能是微胶囊残留的乙醇、乙酸以及吸附的水分蒸发所致,300 ℃附近降解速率最大可能是结合水、小分子化合物以及生物材料自身骨架分解的结果[22]。其中各壁材微胶囊最大降解速率对应的温度:CS<Zein/CS<Zein<Zein-Gel<Gel,SF微胶囊最大降解速率对应的温度:CS-SF<Zein/CS-SF<Zein-SF<Zein/Gel-SF<Gel-SF;可以发现同轴的微胶囊最大降解速率对应的温度介于对应的两壁材之间,SF微胶囊与对应壁材微胶囊的热重和微分热重曲线相似,最大降解速率所对应的温度一致。降解温度越高表明微胶囊越稳定,通过热重分析可知,微胶囊在300 ℃的高温下才大量降解,具有较高的热稳定性,另外相比CS,Zein和Gel作微胶囊载体热稳定性更好。
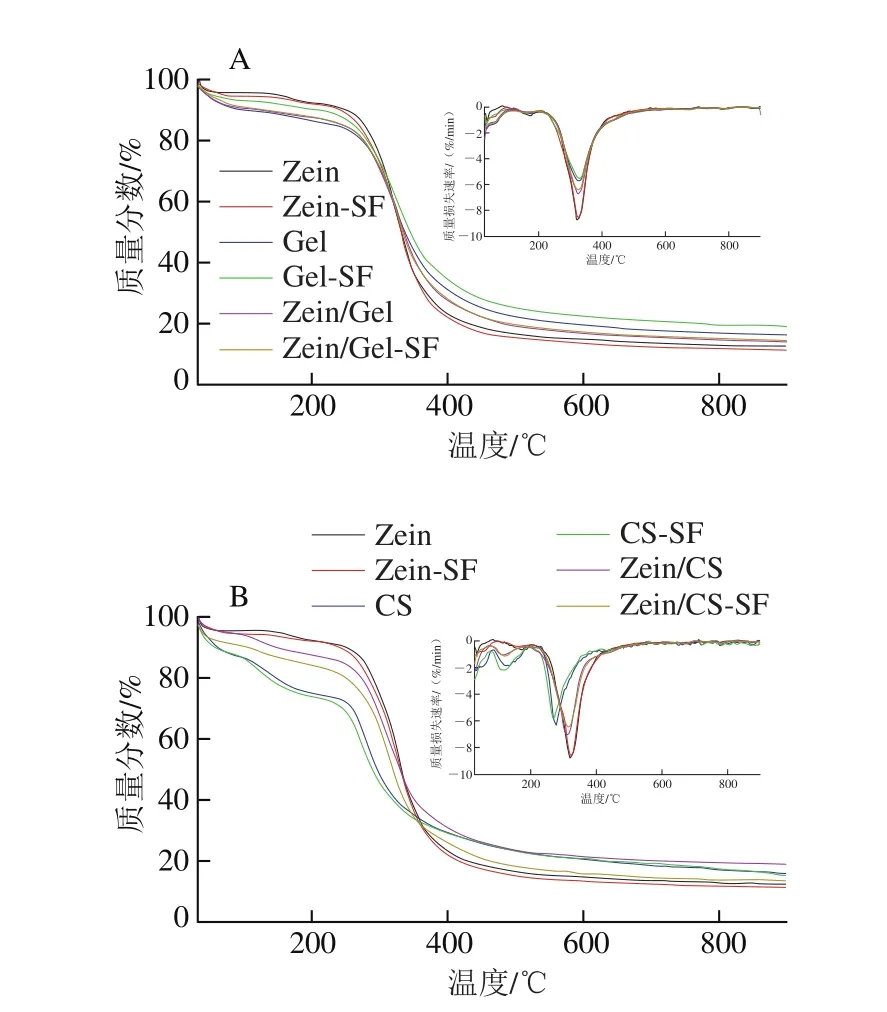
图3 SF微胶囊的热重分析和微分热重曲线Fig.3 Thermogravimetric analysis and differential thermogravimetric analysis curves of SF microcapsules
对于游离SF而言,袁海娜[23]在进行热重分析时发现,在检测温度范围内(20~230 ℃)无法获得SF的热重分析曲线。刘艳凤[24]在热重分析表征SF微胶囊时未检测游离SF含量。van Eylen等[25]通过在不同温度下加热样品20 min来考察SF的热稳定性,发现在90 ℃下处理20 min后SF降解率超过90%。吴元锋[8]在其研究中发现,SF在90 ℃不同pH值下加热6 h后,其残留量很少,有的甚至检测不到。这些结果可归因于SF的挥发性和对温度的敏感性,同时也证明了微胶囊对SF的保护作用,通过微胶囊化提高了SF的耐热性。
2.5 SF微胶囊在模拟胃肠液中的释放情况
SF微胶囊在模拟胃肠道消化下的动力学释放曲线如图4所示。SF在前期胃消化阶段释放速率快,Zein-SF、Gel-SF及Zein/Gel-SF前2 h累积释放率均高于80%,Zein/CS-SF高于60%,CS-SF最低,不足20%;在后期肠消化阶段均处于相对稳定状态,Zein-SF、Gel-SF及Zein/Gel-SF累积释放率较高(>80%),释放周期长,有良好的胃肠溶解性,Zein/CS-SF(<70%)和CS-SF(<20%)累积释放率较低,这与赵彬然[9]、苏军庆[26]的研究结果趋势一致。

图4 SF微胶囊在模拟胃肠道条件下的释放情况Fig.4 Release of SF microcapsules under simulated gastrointestinal conditions
SF微胶囊在胃环境中快速释放SF,可能是由于SF微胶囊与释放介质存在一定浓度梯度,以及微胶囊的高比表面积、高孔隙率,使分散在载体表面的SF释放,同时由于胃液中胃蛋白酶侵蚀壁材,使微胶囊逐渐崩解,适度快速释放可以使SF浓度迅速升高到有效治疗浓度[21];SF微胶囊后期在肠液中较稳定,肠是大多数口服制剂的主要吸收部位,多数活性物质需先从制剂中释放出来,以分子形式溶解在消化液中才能进行跨膜吸收[26],Zein-SF、Gel-SF及Zein/Gel-SF在肠液中一直保持较高的SF累积释放率,利于人体吸收,从而提高其生物利用度,发挥SF功效。然而Zein/CS-SF和CS-SF的SF释放率较低,可见微胶囊因其壁材成分的不同,其芯材在胃肠道环境中的释放和消化效果有着较大的不同,这与马铁铮等[27]的研究结论一致。
2.6 SF微胶囊在模拟食品基质中的SF释放情况
SF微胶囊在两种模拟食品基质中的SF释放曲线如图5所示。SF在模拟水性基质中的释放以Zein-SF和Gel-SF最迅速,在1 h累积释放率即达到约80%;在模拟酸性基质中,Zein-SF、Gel-SF、Zein/Gel-SF中SF的累积释放率在1 h达到74.5%~82.3%。鉴于以上形式的SF在模拟食品基质中的快速释放,故进一步研究了其在0~1 h SF的释放情况(图5)。总体上1 h内SF累积释放率线性增大,0~20 min,SF释放相对缓慢,而20~60 min的释放速率(曲线斜率)快速增加,其中Zein-SF的累积释放率始终保持最高。在最初的1 h内SF的快速释放通常与微胶囊表面或附近的生物活性分子的存在有关,当基质与释放介质接触后溶胀时,该分子会迅速释放[28],然后SF通过生物聚合物网络的网孔扩散,持续释放,呈现相对稳定趋势,这与Atay等[28]的研究结果一致。然而,SF的释放受食品模拟物的性质和壳基质的影响,在样品之间可以观察到细微差异。两种释放介质中Gel-SF最终SF累积释放率均在80%左右,CS-SF和Zein/CS-SF的最终SF累积释放率均低于20%,Zein-SF在体积分数3%乙酸溶液中的最终SF累积释放率略低于体积分数10%乙醇溶液,而Zein/Gel-SF与之相反,在酸性介质中释放较多,这可以归因于在酸性条件下Gel的溶解度更高,聚合物基质快速膨胀[29]。本研究所用的壁材均为食品级,具有良好的生物可降解性,Zein-SF和Gel-SF微胶囊可添加到水性或酸性食品基质中,Zein/Gel-SF微胶囊可添加到酸性食品基质中,有利于进一步开发SF新型功能食品。

图5 SF微胶囊在模拟食品基质中的释放Fig.5 Release of SF microcapsules in simulated food matrices
2.7 SF微胶囊的热稳定性分析结果
大多数生物活性化合物对热敏感,贮存和进一步加工受其热稳定性的限制[30]。以SF保留率为指标,评价游离和微胶囊形式的SF在60 ℃条件下的稳定性。由图6可知,所有样品随加热时间的延长保留率都呈现不同程度的下降,24 h时SF保留率为CS-SF(未检测到)<Zein/CS-SF<游离SF<Gel-SF<Zein/Gel-SF<Zein-SF。游离状态下的SF损失较为严重,仅剩20.14%;CS-SF和Zein/CS-SF微胶囊SF检出率低,可能是因为微胶囊粒径较小,一部分SF吸附到表面,暴露在高温环境中降解,或者是由于CS的导热性使内部SF损失。Zein-SF、Gel-SF、Zein/Gel-SF微胶囊的SF保留率在80%左右,SF稳定性明显提高,可能是微胶囊化的SF受壁材的保护其结构未被直接破坏,表明有效的微胶囊化可以使SF避免高温降解。
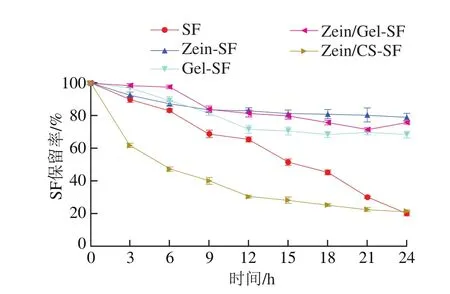
图6 游离和微胶囊形式的SF在60 ℃下的热稳定性Fig.6 Thermal stability of SF in free and encapsulated forms at 60 ℃
Wu Yuanfeng等[4]通过喷雾干燥将由5 种不同壁材料制成的样品在35 ℃下贮存,研究微胶囊的贮存稳定性,也发现SF稳定性受壁材选择的影响很大,阿拉伯胶/β-环糊精微胶囊化对SF的保留率远低于麦芽糊精包合物。但不可否认的是,有效的微胶囊化确实可以提高活性物质的稳定性,Fahey等[31]将SF/α-环糊精包合物与游离SF分别在室温与高温下长时间放置,发现包合物中的SF更稳定。毛莹等[32]以海藻酸钠为壁材,经研究发现基于内源乳化法制备的花色苷微胶囊有效提高了其对温度的稳定性。可以得出结论:Zein-SF、Gel-SF、Zein/Gel-SF微胶囊发挥了载体对目标成分的保护作用,能够有效减少热对SF的影响,提高其热稳定性,有利于延长SF货架期和进一步加工利用。
3 结 论
Zein和Gel可用作静电喷雾包封SF的壁材,SEM观察结果显示Zein-SF和Gel-SF微胶囊表面光滑完整,整体呈球状结构,微胶囊大小均匀;Zein-SF和Gel-SF微胶囊包封率均高于95%;FTIR谱图表明Zein-SF和Gel-SF微胶囊中SF被成功包封;热重分析曲线表明Zein-SF和Gel-SF微胶囊有较高的热稳定性;体外模拟实验结果表明,以Zein和Gel为壁材制备的SF微胶囊具有良好的胃肠溶解和释放性能;另外,稳定性实验说明经微胶囊化处理后的SF对温度的稳定性有显著提高。总之,Zein和Gel通过静电喷雾技术可以形成有效的SF递送载体,有利于促进SF的产业化应用。

