中药植物羌活种子休眠解除的代谢组分析
李爱花, 蒋顺媛, 郭娜, 黄璐琦
(1.北京市植物园, 北京市花卉园艺工程技术研究中心, 北京 100093; 2.中国中医科学院中药资源中心, 国家道地药材重点实验室培育基地, 北京 100700; 3.四川省中药科学研究院, 四川省中药质量和创新研究重点实验室, 成都 610041; 4.中国中医科学院实验研究中心, 北京 100700)
羌活(NotopterygiumincisumTing ex H.T. Chang)伞形科(Umbelliferae)羌活属(Notopterygium)植物,为我国特产,多年生草本,生长于海拔2 000—4 000 m的林缘及灌丛内。羌活为我国传统大宗药材,以根及根茎入药,主治外感风寒、头痛无汗、寒湿痹、上肢风湿疼痛。长期以来,羌活药材资源主要依靠采挖野生资源为主,导致羌活资源已经处于近危状态[1]。目前,羌活已被甘肃省、西藏自治区、宁夏自治区列为省级重点保护药用植物[2-4]。为了保证其在中医药领域的应用,亟需对其进行人工驯化栽培。
由于羌活种子存在形态生理休眠,自然发芽率低,休眠期长,限制了羌活的人工驯化和栽培种植,导致其人工种植发展缓慢。羌活种子成熟脱落时,胚未发育完全,需要待胚发育完全后,再进行低温处理才能解除休眠,最终萌发[5]。杨旻[6]研究发现,低温层积能够明显解除羌活的种子休眠。
近年来,一些学者利用代谢组学解析作物种子发育、萌发过程的代谢物变化[7-11],但对于种子休眠解除过程的代谢组学分析少见,且对于羌活种子休眠解除的代谢机理研究还未见报道。本研究通过对不同休眠解除阶段的羌活种子进行取样,利用UPLC(ultra performance liquid chromatography)对其进行代谢物质变化分析,以解析羌活种子休眠解除过程的物质代谢变化规律,并试图找出种子休眠解除的关键化学物质,以期为羌活的人工驯化栽培提供理论背景,为具相似休眠特征植物种子的栽培种植提供重要理论参考。
1 材料与方法
1.1 试验材料及试剂
羌活(N.incisum)种子采自四川省甘孜藏族羌族自治州小金县。
琼脂为分析纯,氟啶酮(fluridone,FL)、赤霉素(gibberellin 3,GA3)均为分析纯,均购自上海生工生物工程有限公司。
1.2 试验设计
1.2.1预处理成熟干种子1∶1拌细河沙,在15/5 ℃条件下,进行暖-冷层积预处理,以完成羌活种子胚的生长,即解除其形态休眠(morphological dormancy,MD)。预处理过程中,每隔15 d取样20粒,直至150 d结束。取样种子在奥林巴斯解剖镜(SZX7,日本奥林巴斯)下进行解剖、形态观察及拍照;并进行胚长和种子长的测量。同时将部分种子速冻后保存在-80 ℃冰箱。选取预处理0(0MD)、15(1MD)、60(3MD)、90(5MD)、120(7MD) d进行后续检测。
胚率=胚长/种子长×100%
(1)
1.2.2生理休眠(physiologicaldormancy,PD)解除处理将经过预处理的种子进行以下4种处理:分别用蒸馏水(对照,CK)、100 mg·L-1氟啶酮(FL)、400 mg·L-1赤霉素(GA)浸泡24 h后,流水冲洗,播种到1%琼脂培养基。另将部分种子继续进行5 ℃混沙低温处理(cold stratification, CS)3个月,分别在预处理+低温层积(CS)150 d(0PD)、150+30 d(3PD)、150+ 60 d(5PD)、150+110 d(10PD)进行取样。低温层积结束的种子播种到1%琼脂培养基观察种子萌发情况,萌发试验每个处理3个重复,每个重复100粒种子。萌发条件如下:15 ℃,光照12 h/黑暗12 h,光源为冷光源,1 000 lx。 每隔一周观察一次种子萌发情况。同时,将休眠解除处理0PD(CK)、FL、GA和CS 4个处理的种子取样,速冻保存在-80 ℃冰箱,进行后续代谢物检测分析。
1.3 代谢物检测
利用UPLC-MS/MS平台检测羌活种子内代谢物。提取检测方法参考Evans等[12],并稍作修改,简要描述如下:将储藏在-80 ℃的样品研磨成粉。称取0.1 g研磨样品,加入到1 mL甲醇,超声提取30 min。离心取上清液,反复提取3次,合并提取液。氮气吹干,真空干燥。50 μL甲醇超声溶解,上机检测。
色谱条件:Waters Acquity UPLC-I-Class system (Waters Corporation, Milford, MA),Acquity BEH C18色谱柱,柱温40 ℃,流速350 μL·min-1。流动相:0.1%甲酸水为水相,甲醇为有机相。线性洗脱梯度:(0—0.5) min,100%水;(0.5—6.0) min,60%甲醇;(6.0—6.5) min, 98%甲醇;(6.5—8.0) min,100%甲醇;进样量1 μL。
质谱条件:电喷雾离子源(ESI),采取ESI (+)离子模式,离子源温度分别为100 ℃和450 ℃,毛细管电压分别为0.5 kV和2 kV,锥孔电压为40 V,低能量碰撞电压6 eV,高能量碰撞电压分别为6 590 eV和40~70 eV。扫描范围 质荷比50~1 000 m·z-1。
1.4 数据处理与分析
用Origin 8.0的Boltzmann模型进行羌活种子胚的生长曲线拟合。代谢物检测数据用Progenesis QI软件进行分析。原始数据进行Z-score归一化处理后,用SPSS 11.0进行PCA和聚类分析。
2 结果与分析
2.1 羌活种子预处理过程的内部结构变化
图1显示,羌活种子成熟散布时,种子内部大部分为胚乳,仅在果疤一端有一团未分化的透明物质为原胚, 0.1~0.2 mm,原胚的顶端有1个白色胚结构。在形态休眠解除的处理过程中,胚不断长大,至150 d时,胚长至约为种子长度的三分之二,胚乳软化。在胚发育过程中,随着处理时间的推移,胚率的变化表现为S曲线,处理80 d左右时,胚率的变化速度最快,即羌活种子的胚生长最快,这是加速胚发育速度的关键时间点。
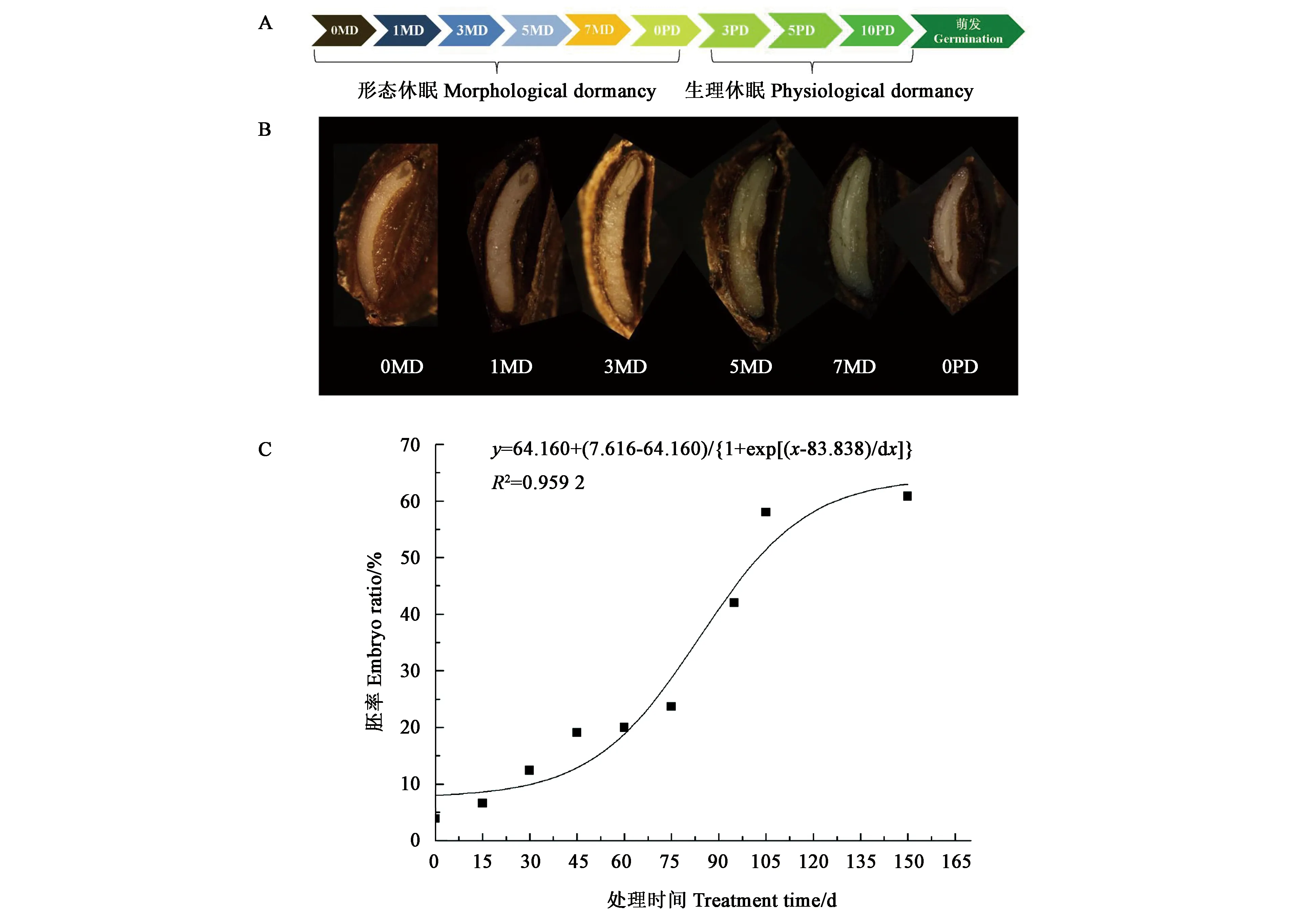
A:种子休眠解除处理过程;B:关键时间点的胚形态;C:胚生长曲线
2.2 羌活种子预处理过程的代谢组分析
对羌活种子的整个预处理及低温层积过程取样,进行代谢物检测。对正离子模式原始检测结果归一化处理后,进行H聚类分析,结果(图2)发现,0MD、1MD、3MD聚类到一组,5MD、7MD、0PD、3PD聚类到一组,而5PD、10PD聚类到一组。可见,总体来看,在羌活种子的整个处理过程中,种子内化合物的代谢模式,分为3个阶段:0—60 d、90—(150+30) d和(150+60)—(150+110)d。其中第3个阶段的两个处理5PD和10PD的羌活种子已具备萌发能力,5PD的种子通过ABA抑制剂处理已可以萌发,而10PD的种子可以直接萌发[13]。而0PD、3PD甚至之前处理阶段的羌活种子不萌发,且经过氟啶酮处理后也基本不萌发。

注:色度条表示代谢物的丰度,以相对于所有处理平均值的变化来表示。
对检测结果进行PCA分析,结果见图3。可见,羌活种子处理整个过程的不同阶段可以有很好的区分度,随着时间的推移,不同处理的代谢物表现出顺时针的旋转模式,0MD、1MD、3MD、5MD、7MD沿着t[1] 主成分轴由小到大排列,0PD、3PD、5PD、10PD按照t[2] 主成分轴由大到小排列。即t[1] 主成分所代表的化合物能够很好地将0MD、1MD、3MD、5MD、7MD区分开,而t[2]主成分所代表的化合物对0PD、3PD、5PD、10PD能够很好地分开。那么,t[1]、t[2]主成分所代表的化合物即是这些处理之间发生代谢变化的关键化合物。
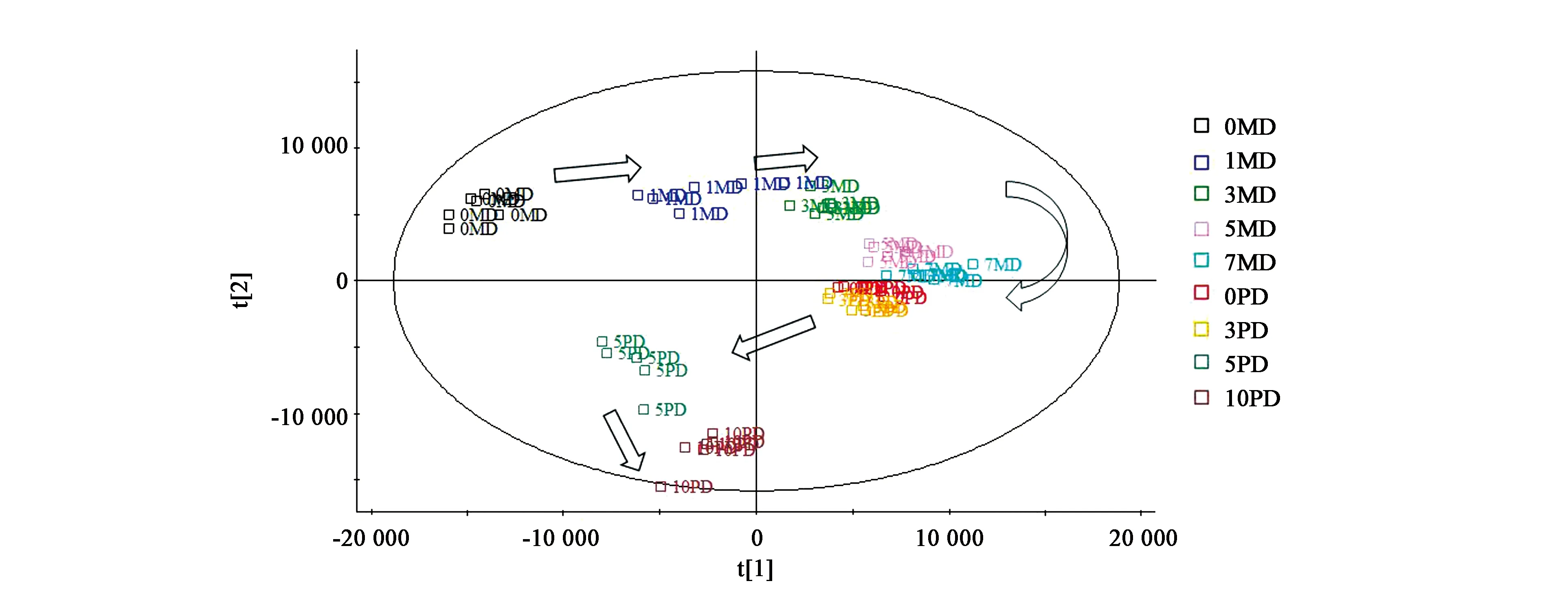
图3 羌活种子处理过程代谢物的PCA分析
2.3 羌活种子休眠解除处理的代谢组分析
对羌活种子休眠解除处理的代谢物检测结果进行PCA分析,结果(图4)显示,对完成形态休眠羌活种子进行的休眠解除处理(5PDFL、5PDGA和10PD)的代谢物的PCA分析结果,与5PD处理可以显著区分。而3个解除休眠处理间,5PDFL与5PDGA和10PD可以明显区分,但是5PDGA与10PD不能区分。t[1] 主成分所代表的化合物能够很好地将5PD、5PDFL、5PDGA和10PD区分开,而不能将5PDGA和10PD 区分。萌发试验显示,5PDFL和10PD的种子可以萌发[13],而5PDGA的种子萌发率很低(未发表)。

图4 休眠解除过程羌活种子代谢物的PCA分析
2.4 羌活种子休眠解除处理的关键化合物
通过分析可萌发处理5PDFL和10PD的共有代谢物,及二者与不能萌发处理(5PD)的差别代谢物,结果(图5)发现,正离子模式的加荷粒子 411.1607:[M+Na]+和389.1416:[M+H]+,碎片离子包括307: [M+Na-CH3COOH-CO2]+、351: [M + Na-CH3COOH]+、335: [[M+Na-CH3CO-H2O]+和371: [M+H-H2O]+。表明该化合物的分子式可能为C31H42O17。负离子模式的质谱图,显示加荷粒子387.1652:[M-H]-,表明该化合物的经验分子式为C31H42O17。这与独脚金内酯(strigolactones,SLs)化合物列当醇乙酸酯(orobanchyl acetate)的分子式一致(图6)。 离子片断分析表明,列当醇乙酸酯脱下一个糖基和1个分子H2O (180 Da)。基于UPLC-MS/MS检测的列当醇乙酸酯的峰面积,计算5PDFL和10PD处理相对于5PD的列当醇乙酸酯变化,发现FL和CS处理的列当醇乙酸酯水平分别显著升高12.1和 28.5倍(图7)。
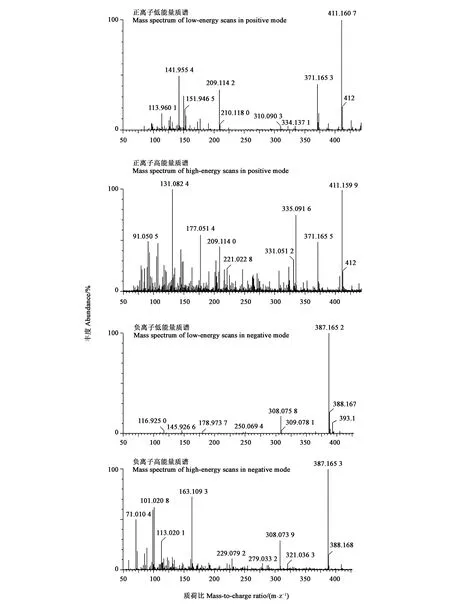
图5 羌活种子中列当醇乙酸酯的质谱图

图6 列当醇乙酸酯的结构式
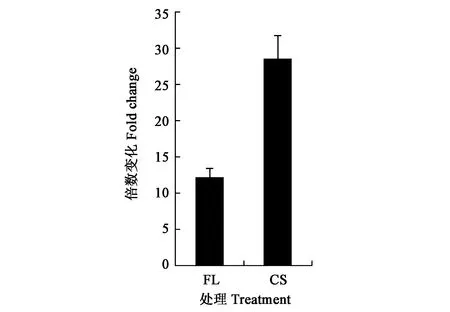
图7 羌活种子中列当醇乙酸酯的含量变化
3 讨论
研究发现,完成形态发育的羌活种子胚仍然不能萌发,低温层积3个月(CS)处理可以达到73.5%的萌发率;用氟啶酮溶液(FL)浸泡后,也可以达到81.3%的萌发率;不经过处理的种子(Con)仅有12.8%萌发;GA3溶液浸泡(GA)的种子萌发情况与未处理(Con)种子萌发情况类似[13]。可见,羌活种子通过预处理完成种子胚的发育,但是发育完全的胚仍然不能全部萌发,需要通过低温层积3个月解除休眠而萌发,氟啶酮也可以有效解除完成胚发育种子的休眠。
本研究对羌活种子取样进行代谢物检测后发现,羌活种子整个处理过程分为3个阶段:0—60 d(0MD、1MD、3MD)、90—180 d(5MD、7MD、0PD、3PD)、210—260 d(5PD、10PD),第三个阶段的两个处理5PD和10PD种子已具备萌发能力。t[1] 主成分所代表的化合物能够很好地将形态休眠阶段(即0MD、1MD、3MD、5MD、7MD)区分开,表明这些化合物是0MD、1MD、3MD、5MD、7MD胚发育处理过程发生主要变化的化合物。t[2] 主成分所代表的化合物对生理休眠阶段(0PD、3PD、5PD、10PD)很好地区分,表明这些化合物主要是在生理休眠解除过程中发生变化的。而t[1]、t[2]主成分所代表的主要代谢化合物的分析鉴定,还需要进一步研究。
独脚金内酯是一种来源于类胡萝卜素的植物激素,能够诱导寄生植物Orobanchesp.和Strigasp.种子萌发[14],促进丛枝真菌分枝、抑制地上分枝的作用[15],然而其是否能够诱导非寄生植物的种子萌发,尚未见有报道。本研究发现,在ABA抑制剂(FL)处理和低温层积处理诱导羌活种子休眠解除过程中,列当醇乙酸酯,一种SLs化合物,发生显著积累。FL处理后SLs的生物合成水平升高12.1倍,显著低于CS处理后SLs的合成水平升高倍数(28.5倍)。推测FL处理抑制八氢番茄红素脱氢酶(PDS)活性[16],也降低了种子休眠解除过程SLs的生物合成水平。Li等[13]研究也发现,SLs的合成酶基因NiD27、NiCCD8、NiCYP711A1和NiDAD2在5PDFL和CS处理中均显著上调表达。因此,推测SLs的含量变化可能是羌活种子休眠解除过程是关键环节。

