阿帕替尼对人胆管癌细胞增殖和凋亡的影响
侯丽霞,庞丽娜,龚 帅,何 炜
(郑州大学第一附属医院肿瘤科,河南 郑州450052)
胆管癌(cholangiocarcinoma,CCA)作为仅次于肝细胞癌的第二大常见肝脏恶性肿瘤,包括多种胆管上皮性肿瘤,其中,肝内胆管癌占10%~20%,肝门部胆管癌占50%,远端胆管癌占30%~40%[1]。CCA占所有原发性肝癌病例的10%~15%,占所有恶性肿瘤的比例不到1%,但在过去的40 a里,全球CCA的发病率逐年增加[2-3]。
胆管癌患者的预后差,5 a总生存率不到5%,主要是由于该肿瘤发病隐匿、诊断晚并且缺乏有效的非手术治疗手段[4]。因此,对于胆管癌的治疗迫切需要更多更有效的治疗药物,特别是分子靶向治疗药物。
血管内皮生长因子(vascular endothelial growth factor,VEGF),又称血管通透因子,是上皮细胞产生的一种信号蛋白[5]。其是多种肿瘤新生血管形成和细胞增殖的关键因素,如胃癌、肺癌、胰腺癌、卵巢癌、乳腺癌、结肠癌和肝细胞癌(包括CCA)[6]。临床资料显示VEGF在CCA中显著升高[7-8],阻断VEGF/血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)通路可有效抑制多种肿瘤的增殖、迁移、侵袭和黏附能力,如肝细胞癌、胃癌和肺癌[9-10]。最近的研究证实自分泌VEGF在促进肿瘤细胞增殖和抑制其凋亡中有重要作用[11-13]。
阿帕替尼(YN968D1)是最新的口服型VEGFR2酪氨酸激酶高选择性抑制剂之一,在治疗多种实体瘤方面有着令人鼓舞的临床前和临床资料[14-15]。VEGFR-2是VEGF介导的一种重要的抗凋亡因子,通过VEGFR-2/PI3K/Akt/mTOR途径抑制凋亡。经Ⅲ期临床试验证实,阿帕替尼是治疗无化疗指征的晚期胃癌的唯一有效药物[16]。因此,阿帕替尼于2014年被国家食品药品监督管理局批准并认定为晚期或转移性难治性胃癌的后续治疗药物[17]。在我国的Ⅱ~Ⅲ期临床试验中,阿帕替尼对多种肿瘤均显示出良好的治疗效果,如肝细胞癌[18]、非小细胞肺癌[19]、乳腺癌[20-22]和结直肠癌[23]。然而,阿帕替尼是否对人类CCA具有抗肿瘤作用尚不清楚。在本研究中,我们观察了阿帕替尼对体内外CCA细胞的增殖和凋亡的影响,并探讨其作用机制。
1 资料与方法
1.1 细胞系和试剂阿帕替尼(YN968D1)由江苏恒瑞医药股份有限公司提供;抗Bcl-2(目录号sc-7382)抗体购自美国Santa Cruz Biotechnology公司;抗cleaved caspases-3(目录号9661)抗体购自美国Cell Signaling Biotechnology公司;抗Ki-67(目录号MA5-14520)抗体购自美国Thermo Scientific公司。
人CCA细胞系HCCC9810和HuCCT1购自美国ATCC细胞库。细胞培养在含高糖的DMEM培养基中,并在37 ℃、体积分数5%CO2条件下添加胎牛血清(美国Gibco公司)、100 u/mL青霉素和100 μg/mL链霉素。细胞培养按照ATCC要求的培养条件。
1.2 细胞增殖实验细胞(每孔1×103个)接种于96孔板中,隔夜培养后,用不同浓度的阿帕替尼(0、2.5、5、10和20 μmol/L)处理细胞,并培养24、48和72 h,然后添加20 μL Cell Titer 96 Aqueous One Solution试剂(美国Promega公司),将细胞再培养1 h,最后在492 nm处读取光密度(optical density,OD)值。
1.3 锚定非依赖性细胞生长实验下层为质量分数0.6%琼脂和含不同浓度阿帕替尼的完全培养基,上层为质量分数0.3%琼脂和含相同浓度阿帕替尼的完全培养基,细胞(每孔8×103个)悬浮于上层的完全生长培养基中,然后在37 ℃,5%CO2培养箱中培养14 d,最后使用Image-Pro Plus v.6.0程序(美国Media Cybernetics公司)在倒置显微镜下对集落进行计数。
1.4 Annexin V/PI染色法用凋亡检测试剂盒进行Annexin V/PI染色。将细胞(每孔3×105个细胞)接种于6孔板中,培养24 h,并用不同浓度(0、2.5、5、10和20 μmol/L)的阿帕替尼处理24 h,然后洗涤细胞两次,用磷酸盐缓冲液再悬浮并在室温下用Annexin V-异硫氰酸荧光素(FITC)和碘化丙啶孵育10 min。用BD Acuri C6进行细胞凋亡分析。
1.5 裸鼠中抗肿瘤作用的测定BALB/c裸鼠,雌性,6~8周龄,购自自郑州大学实验动物中心,小鼠饲养在无菌动物室中,提供标准鼠料及蒸馏水,让其自由采食及饮水。把悬浮于磷酸盐缓冲液的HuCCT1细胞与基质胶(美国BD Biosciences公司)11混合,抽取0.25 mL混合物(HuCCT1细胞量约3×106)接种于小鼠右侧皮下,每3天测量一次肿瘤体积和体质量,肿瘤体积公式:肿瘤体积(mm3)=1/2×长×宽2。当肿瘤体积大小达到50~100 mm3时,将小鼠随机分为3组(n=6~8,对照组,阿帕替尼50 mg/(kg·d)组,阿帕替尼100 mg/(kg·d)组)。小鼠被处死后移除肿瘤,将肿瘤组织用福尔马林固定,石蜡包埋并切片,进行免疫组化分析。
1.6 免疫组织化学法从每个石蜡块中获取一系列4 nm的切片,组织切片经二甲苯脱石蜡后,用10 mmol/L枸橼酸钠缓冲液(pH=6.0)进行抗原修复,接着用体积分数0.03%过氧化氢孵育15 min以阻断内源性过氧化物酶的活性,然后将切片在正常血清中封闭30 min,并在4 ℃下与一抗一起孵育过夜,最后在室温下用二抗孵育60 min。所有切片均使用Vectastain ABC 试剂盒(美国Vector实验室)和苏木精在显微镜下(200×)进行复染。使用Image Pro Plusv.6.0程序(美国Media Cybernetics公司)进行IHC染色定量分析。

2 结果
2.1 阿帕替尼抑制CCA细胞增殖和集落形成对CCA细胞的细胞增殖和集落形成能力的评估显示,阿帕替尼以时间和剂量依赖的方式抑制HCCC9810和HuCCT1细胞系的增殖,其中,对HuCCT1细胞系的增殖抑制作用更为明显(图1)。在2株细胞系中,阿帕替尼处理24 h的抑制作用弱于处理48 h和72 h。经阿帕替尼处理72 h,不同浓度(2.5、5、10和20 μmol/L)阿帕替尼组与对照组之间的疗效比较差异均有统计学意义(P<0.05)。
软琼脂中的细胞集落形成也被阿帕替尼以剂量依赖的方式抑制,在HuCCT1细胞中最为显著(图1),这表明阿帕替尼可以抑制CCA细胞增殖,值得进一步研究。
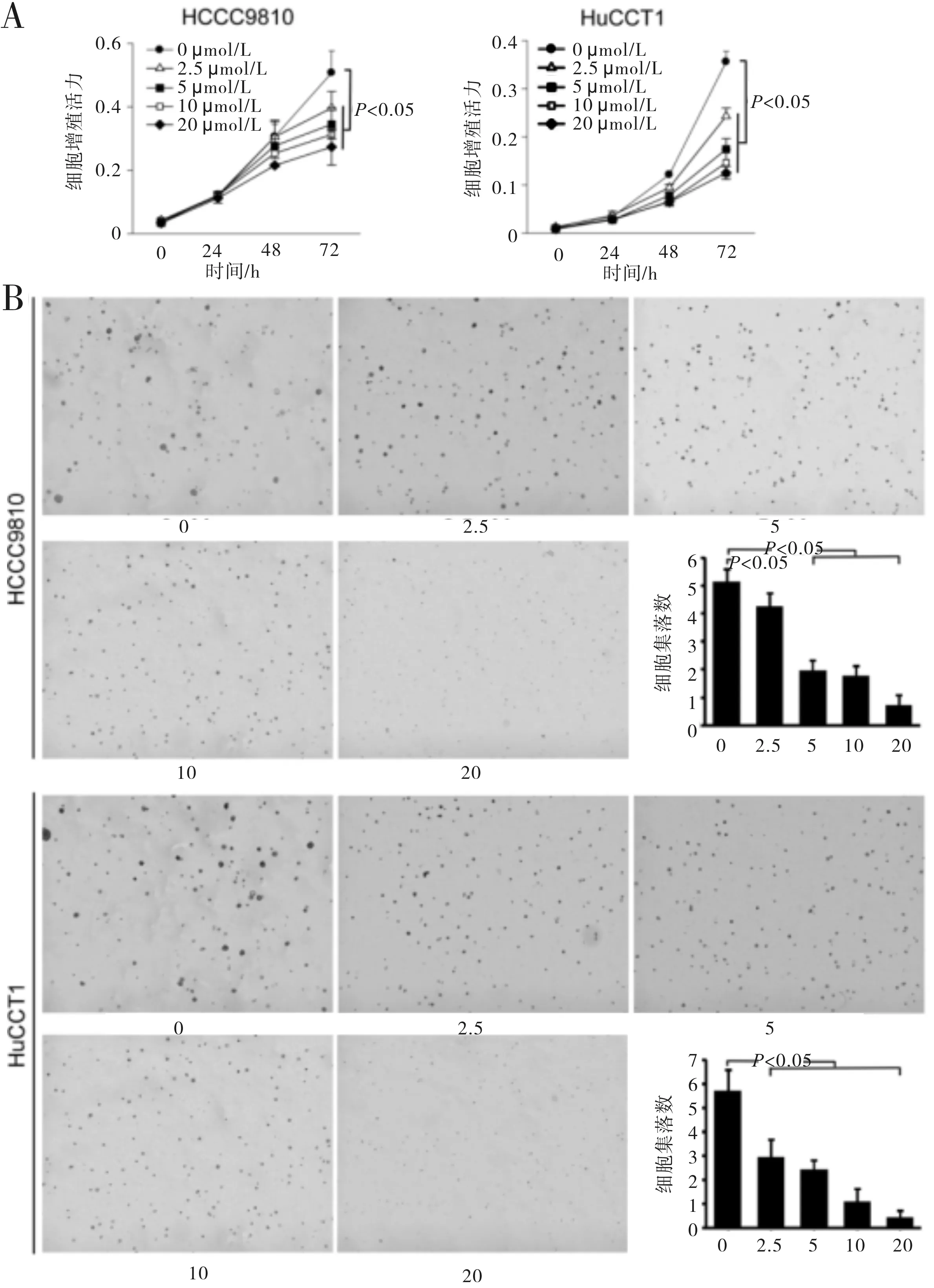
图1 阿帕替尼(μmol/L)抑制CCA细胞增殖及集落形成
2.2 阿帕替尼促进CCA细胞凋亡采用Annexin V/PI双染色法和流式细胞术探讨阿帕替尼对CCA细胞的抗增殖作用是否与诱导细胞凋亡有关。用2.5、5、10和20 μmol/L的阿帕替尼处理CCA细胞24 h,结果显示,与对照组相比,经阿帕替尼处理后早期凋亡和晚期凋亡细胞均有所增加,而且经阿帕替尼处理后细胞凋亡率也显著增加(P<0.05)(图2)。
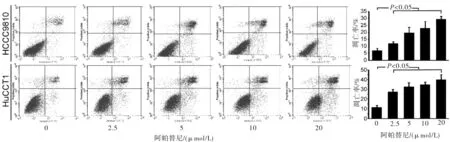
图2 阿帕替尼促进CCA细胞系凋亡
2.3 裸鼠移植瘤模型中阿帕替尼抗CCA作用的研究阿帕替尼50 mg/(kg·d)治疗组与对照组治疗期间体质量比较差异无统计学意义(P>0.05),然而,阿帕替尼100 mg/(kg·d)治疗组与对照组的体质量减轻比较差异有统计学意义(P<0.05)(图3)。阿帕替尼100 mg/(kg·d)治疗组和阿帕替尼50 mg/(kg·d)治疗组的肿瘤体积明显减小,与对照组相比差异均有统计学意义(P均<0.05)(图3)。
为了解释上述现象,我们采用免疫组织化法检测Ki-67、Bcl-2和cleaved-caspase 3的表达水平,进而对阿帕替尼的分子作用机制进行研究。研究发现,相比于对照组,阿帕替尼治疗组ki-67和Bcl-2的表达明显降低,而cleaved-caspase 3的表达显著升高(P<0.05)(图3)。这表明阿帕替尼可以通过调节Ki-67、Bcl-2和cleaved-caspase 3的表达水平发挥抗肿瘤作用。
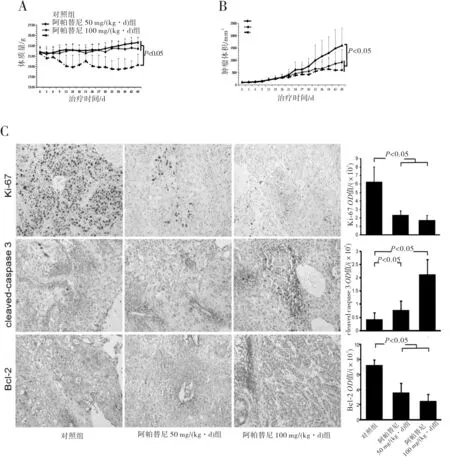
图3 阿帕替尼能抑制裸鼠中HuCC1肿瘤情况
3 讨论
本研究旨在探讨阿帕替尼对体内外CCA细胞的抗肿瘤作用及其作用机制,因此我们进行了细胞增殖实验、凋亡实验,并建立了裸鼠移植瘤模型。细胞增殖实验显示,阿帕替尼以时间和剂量依赖的方式直接抑制HCCC9810和HuCCT1细胞系的细胞增殖和集落形成。在既往的研究中,阿帕替尼能抑制肝癌、胆管癌和其他类型肿瘤的肿瘤细胞增殖[24-25]。Annexin V/PI染色显示,阿帕替尼诱导CCA细胞凋亡,这与细胞增殖实验的结果一致。
裸鼠移植瘤实验结果表明,在整个过程中,阿帕替尼50 mg/(kg·d)治疗组的小鼠体质量并未明显减轻,但仍需对其长期应用进一步研究,阿帕替尼100 mg/(kg·d)治疗组的小鼠体质量明显减轻(P<0.05)。在临床中,我们也发现一部分患者在经阿帕替尼治疗后体质量减轻。然而阿帕替尼50 mg/(kg·d)治疗组与100 mg/(kg·d)治疗组的小鼠肿瘤体积均有明显减小(P<0.05)。另外,阿帕替尼能降低Ki-67和Bcl-2表达同时增加cleaved-caspase 3的表达。这些均表明阿帕替尼能抑制体内CCA细胞增殖并促进细胞凋亡,与体外实验的结果一致。
胆管癌起源于胆管上皮细胞,其中90%以上为腺癌。到目前为止,根治性手术切除是其可能治愈的唯一治疗方法。然而,只有20%到40%的患者可以进行手术切除,因为大多数患者在诊断时肿瘤已经发生转移或者局部晚期,放化疗是近几十年来的主要治疗手段。局部晚期或转移性胆管癌的标准一线治疗是吉西他滨加氟尿嘧啶或铂,替吉奥已被研究作为吉西他滨难治的晚期胆管癌患者的二线治疗[26]。在一项标准的、实用的临床调查(ABC-2研究)中,410例晚期胆管癌患者被随机分配接受吉西他滨联合顺铂或单独使用吉西他滨,联合治疗组患者的中位总生存期为11.7个月,单用吉西他滨组患者的中位总生存期为8.1个月,然而,与其他临床试验相比,联合治疗获益很小,而且研究的患者数量也很少[27]。
因此,迫切需要新的药物或化疗方案作为胆管癌患者的治疗选择。我们先前报道了一例肝内胆管癌患者,在经吉西他滨和顺铂联合化疗进展后,接受了阿帕替尼靶向治疗,达到了6个月的无进展生存期[28]。此次实验研究结果表明,阿帕替尼通过影响CCA肿瘤细胞的增殖和凋亡,对CCA有很强的抗肿瘤作用,阿帕替尼可能是治疗CCA的新选择。

