石墨烯对牙髓干细胞增殖、迁移能力及细胞形态的影响
孙靖宣,李艳萍,潘爽,何丽娜,孙翔宇,张爽,牛玉梅
哈尔滨医科大学附属第一医院,哈尔滨医科大学口腔医学院,黑龙江 哈尔滨(150001)
牙髓干细胞(dental pulp stem cells,DPSCs)由Gronthos等[1]于2000年首次报道,因其具有获取相对简单、高度增殖、多向分化及免疫原性较低等优点,近年来已逐渐被应用于组织工程领域,被视为是组织工程学重要的种子细胞[2]。细胞支架对细胞生物学行为有重要的影响,寻求理想的支架材料是近年来组织工程学研究的热点。
石墨烯(graphene)是一类单原子层二维原子晶体,于2004年首次从石墨中分离获得,因其具有良好的电学、力学以及热学性能而被逐渐应用于生物医学领域[3⁃4]。本文针对石墨烯的理化特性,探究其对DPSCs生物学行为的影响,从而评估其在组织工程学中的应用潜力。
1 材料与方法
1.1 主要试剂与仪器
DMEM高糖培养基(SH30022.01,Hyclone,美国);胎牛血清(10099⁃141,Gibco,美国);MTT溶液(M6180,Biotopped,中国);TritonX⁃100(1139ML100,BioFroxx,中国);10 000 U/mL青霉素⁃链霉素混合溶液(SV30010,Hyclone,美国);石墨粉(青岛美瑞特,中国);STRO⁃1抗体(MAB4315,Sigma,美国);FITC标记兔抗小鼠IgG(H+L)(WLA032,万类,中国);二甲基亚砜(1084ML100,BioFroxx,中国);BSA(143183,BioFroxx,中国);罗丹明标记的鬼笔环肽(CA1610,索莱宝,中国);DAPI(AR1176,Boster,中国);激光拉曼光谱仪(Jobin Yvon HR800,Ra⁃man spectra,法国);原子力显微镜(Dimension Icon,Bruker,德国);酶联免疫检测仪(Multiskan FC,Thermo Fisher Scientific,美国);倒置相差显微镜及照相系统(Olympus CKX41,Olympus,日本);培养箱(seriesⅡwater jacket,Thermo Fisher Scientific,美国)。
1.2 牙髓干细胞的分离培养与鉴定
本实验已获得哈尔滨医科大学附属第一医院伦理委员会批准。于哈尔滨医科大学附属第一医院口腔颌面外科门诊收集18~25岁患者因正畸或阻生而拔除的健康前磨牙及第三恒磨牙,研究均获得患者及家属知情同意。原代细胞体外培养与鉴定步骤如下:采用组织块法培养原代细胞,用含20%胎牛血清的DMEM培养基培养,每3 d更换培养液,当细胞生长达到80%融合时,进行消化、传代,并鉴定。用矿化诱导液(含10%胎牛血清的DMEM培养液,8~10 mol/L维生素K,10 mmol/Lβ⁃甘油磷酸钠,1.5 g/L L⁃维生素C,2 mmol/L L⁃谷氨酰胺)培养第1代细胞14 d后,进行碱性磷酸酶(ALP)染色;将第1代细胞固定,用STRO⁃1抗体一抗稀释液(1∶200)4℃孵育过夜,洗去一抗,二抗稀释液(1∶500)孵育30 min,封片后荧光显微镜观察STRO⁃1染色效果。取第3代细胞用于后续实验。
1.3 石墨烯的制备与表征
1.3.1 石墨烯的制备 采用Hummers法将石墨氧化获得氧化石墨烯(graphene oxide,GO),将获得的GO配成0.5 mg/mL的溶液,用水合肼进行还原。洗涤干燥,获得石墨烯粉体。将粉体与聚乙烯吡咯烷酮按照质量比1∶0.6混入蒸馏水中配制成0.5 mg/mL溶液,超声震荡后离心获取上清液。
1.3.2 石墨烯的表征 使用激光拉曼光谱仪在458 nm波长下对石墨烯以及GO进行结构表征。用原子力显微镜观察两者表面形态。
1.4 MTT检测石墨烯对DPSCs增殖的影响
取对数生长期的DPSCs,以3×103细胞/孔接种于96孔板,24 h后,依次将培养液更换为石墨烯浓度为0、1、5、10、20、50、100μg/mL含10%胎牛血清的DMEM培养基,每组设置5个复孔。37℃、5%CO2细胞培养箱内培养。在第12、24、48、72 h分别检测各组细胞增殖情况。为排除石墨烯对吸光值可能的影响,将每孔的溶液更换为含有10%胎牛血清的DMEM培养基,加入MTT溶液(5 mg/mL)后继续培养4 h,加入二甲基亚砜(DMSO)溶液震荡10 min,使用酶联免疫检测仪在490 nm波长下检测各孔吸光值。
1.5 划痕实验
取对数生长期的DPSCs,以3×105细胞/孔接种于6孔板。细胞生长达到90%融合时,将培养液更换为不含胎牛血清的DMEM培养基。置于37℃、5%CO2细胞培养箱培养24 h后,用10μL枪头垂直于皿底于中央划痕,PBS洗净。实验组分别加入石墨烯浓度为10、20、50μg/mL的不含胎牛血清的DMEM培养基;对照组加入不含胎牛血清的DMEM培养基;每组设置3个复孔。于培养的第0、6、12、24 h,镜下观察并拍照。采用Image J软件测量细胞的迁移面积并计算细胞迁移率。各时间点细胞迁移率(%)=(1-不同时间点划痕面积/0 h划痕面积)×100%。
1.6 不同浓度石墨烯分散液对DPSCs形态的影响
划痕实验可见石墨烯浓度为10μg/mL与20 μg/mL的DMEM培养基对DPSCs的作用明显,后续实验在不抑制DPSCs的增殖的前提下,选择较高浓度即20μg/mL的石墨烯分散液讨论其对DPSCs细胞形态的影响。取对数生长期的DPSCs,以1×104细胞/孔接种于24孔板。置于37℃、5%CO2细胞培养箱培养24 h后,更换为石墨烯浓度0、20μg/mL的含10%胎牛血清的DMEM培养基,每组设置3个复孔。置于37℃、5%CO2细胞培养箱培养3 d后,于光学显微镜下观察细胞的形态,拍照。
1.7 免疫荧光染色
取对数生长期的DPSCs,以1×104细胞/孔接种于24孔板。37℃、5%CO2培养24 h后,更换为石墨烯浓度为0、20μg/mL的含10%胎牛血清的DMEM培养基,每组设置3个复孔。培养3 d后,弃去原培养液。4%多聚甲醛溶液室温固定30 min,随后每孔加入适量0.5%Triton X⁃100溶液,静置30 min;5%BSA封闭60 min后,每孔加入200μL罗丹明标记的鬼笔环肽工作液(1∶200),37℃避光孵育30 min。PBS洗涤细胞3次。每孔加入200 μL DAPI工作液,对细胞核进行染色。PBS清洗后,利用荧光显微镜分别观察各组细胞染色情况并拍照。采用Image J软件计算细胞荧光面积。
1.8 统计学分析
本实验数据采用GraphPad Prism 7软件进行分析。采用方差分析,所有实验至少独立重复3次。计量资料以均数±标准差表示。P<0.05,认为差异具有统计学意义。
2结果
2.1 牙髓干细胞的分离培养与鉴定
原代培养的人牙髓组织,在第5~10 d时可观察到组织周围有长梭形的细胞爬出(图1a),14~20 d可见细胞逐渐融合(图1b);矿化诱导14 d后,ALP染色结果呈阳性(图1c);荧光显微镜下可见基质细胞抗原(stromal cell antigen,STRO⁃1)单克隆抗体阳性表达(图1d)。结果表明分离DPSCs成功,具有间充质干细胞特性及形成矿化结节的能力,可进行后续实验。

Figure 1 Isolation,culture and identification of dental pulp stemcells图1 牙髓干细胞的分离培养与鉴定
2.2 石墨烯的表征
从GO与石墨烯的拉曼光谱可以看出,两种材料特征性的D峰(1 350 cm⁃1)与G峰(1 580 cm⁃1)非常显著。G峰代表石墨烯及GO表面特征性的C=C键;D峰代表石墨烯芳香环中的sp2碳原子氧化后转化为sp3结构。GO经还原得到的石墨烯ID/IG值减小(GO:ID/IG=1.06;Graphene:ID/IG=0.88),说明经过还原,有一部分的sp3结构被还原成了sp2结构。见图2。
原子力显微镜结果显示,GO与石墨烯主要以单层形式存在;与GO相比,经还原后石墨烯呈现出较为光滑的细小薄片状,尺寸分布比较均匀,厚度也有所减小(GO厚度约为1.2 nm;石墨烯为0.8~0.9 nm)。见图3。
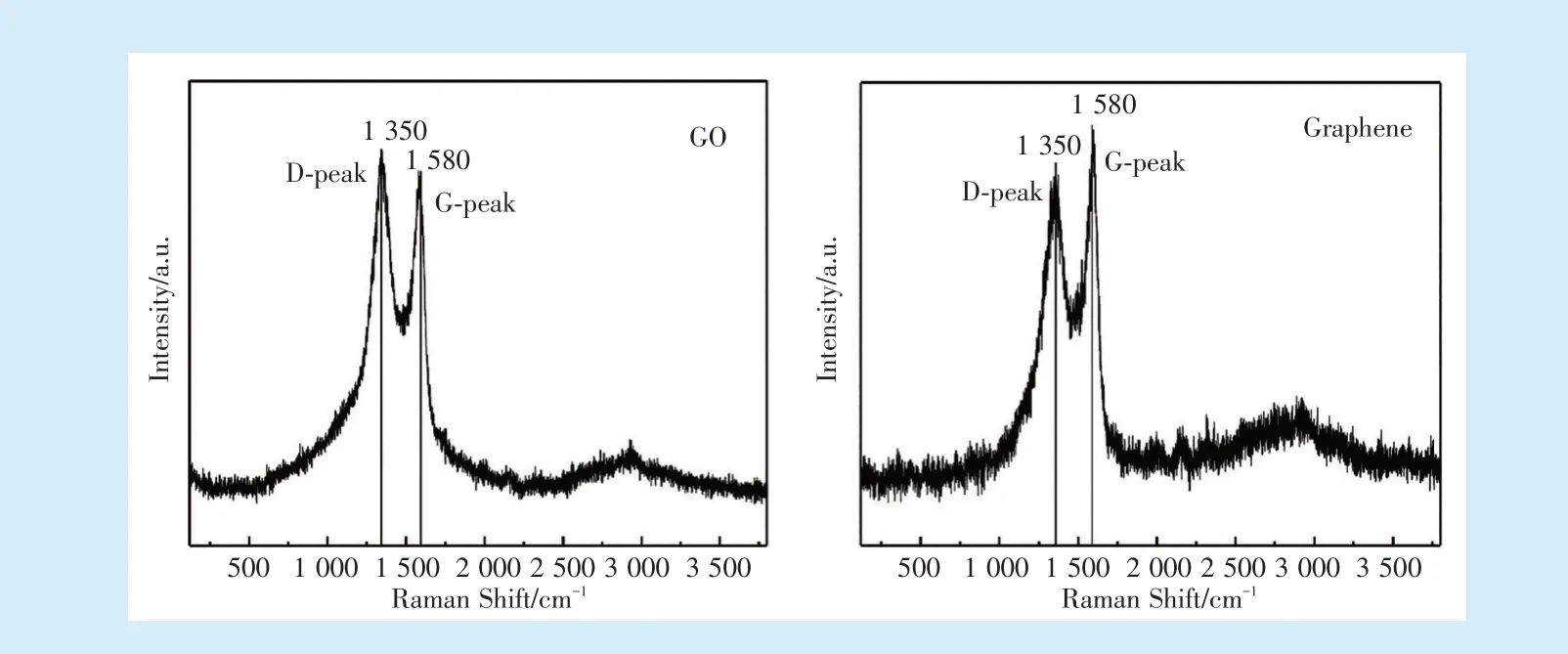
Figure 2 Raman spectra of GOand graphene图2 GO与石墨烯的拉曼光谱

Figure 3 The surface morphologies of GO and graphene were observed by atomic force microscopy图3 原子力显微镜观察GO与石墨烯的表面形貌
2.3 石墨烯对DPSCs增殖能力的影响
MTT结果显示,与对照组(0μg/mL)相比,仅100μg/mL组在72 h对DPSCs的增殖有抑制作用(P=0.012),其余各浓度组(石墨烯分散液1、5、10、20、50、100μg/mL)对DPSCs的增殖均没有显著影响(P>0.05)。见图4。
2.4 石墨烯对DPSCs迁移能力的影响
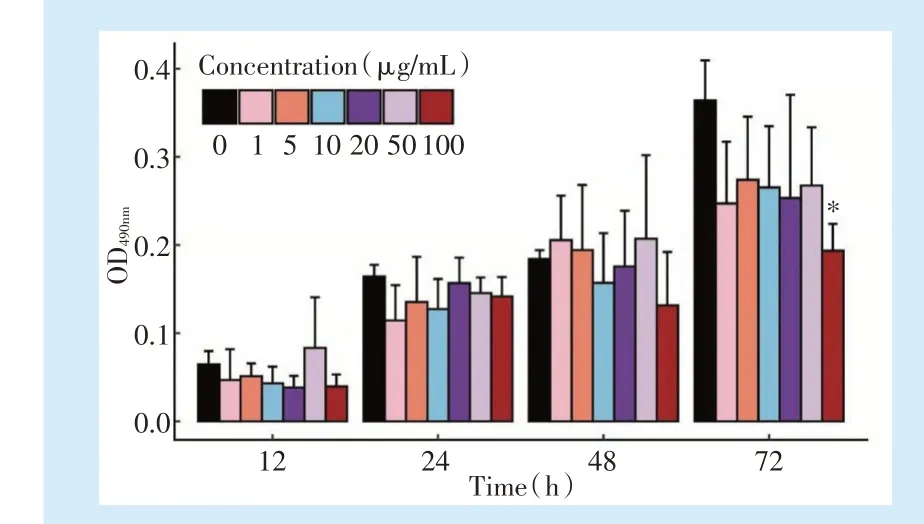
Figure 4 Effects of graphene on the proliferation ability of dental pulp stem cells图4 石墨烯对牙髓干细胞增殖能力的影响
划痕实验结果显示,培养6 h后,各组细胞划痕边缘有散在细胞爬出;12 h后,各组细胞划痕面积均减小,但是各组间迁移率没有显著性差异(P>0.05);24 h后,细胞划痕面积明显减小,石墨烯分散液10μg/mL组与20μg/mL组部分区域已有融合,10 μg/mL组迁移率最大,其次为20μg/mL组,均显著高于对照组(10μg/mL组vs.对照组:P<0.001;20μg/mL组vs.对照组:P=0.003);50μg/mL组与对照组(0μg/mL)无显著性差异(P=0.320)。见图5。
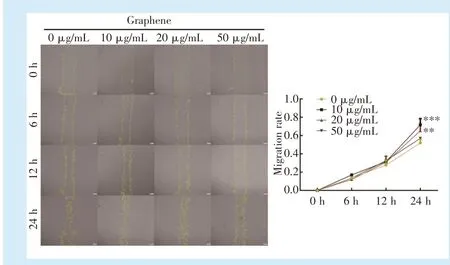
Figure 5 Influence of graphene on the migration ability of DPSCs图5 石墨烯对DPSCs迁移能力的影响
2.5 石墨烯对DPSCs细胞形态的影响
20μg/mL石墨烯分散液培养DPSCs 3 d后,可见实验组细胞梭形胞体收缩,向类圆形胞体转变,突起变长,呈现神经细胞样形态;而对照组(0μg/mL)细胞形态无明显变化。见图6。

Figure 6 Effect of graphene on the morphology of DPSCs(×100)图6 石墨烯对DPSCs细胞形态的影响(×100)
免疫荧光结果显示,经过3 d培养,20μg/mL石墨烯分散液组细胞铺展面积大,荧光素密度高,可见粗大且有序排列的细胞骨架结构,部分细胞呈现长突触、多边形形态。20μg/mL组细胞荧光面积与对照组(0μg/mL)相比无显著性差异(P=0.729)。石墨烯对细胞铺展面积没有显著的影响,部分细胞呈现出神经细胞样形态。见图7。

Figure 7 Effect of graphene on the morphology of DPSCs图7 石墨烯对DPSCs细胞形态的影响
3讨论
石墨烯是一种二维碳纳米材料,具有诸多优良特性。研究表明,石墨烯及其衍生物具有良好的生物相容性,可以诱导细胞成骨及成神经向分化[5⁃6]。DPSCs为神经嵴来源的间充质干细胞,具有多向分化潜能。近年来,被认为是组织工程良好的种子细胞[7]。本实验将石墨烯配制成不同浓度的分散液培养DPSCs,研究石墨烯对DPSCs增殖、迁移能力及细胞形态的影响,探讨石墨烯未来应用于组织工程学的可能。
对于纳米材料的细胞毒性大小,研究者们一直存在争议,但普遍认可的是纳米材料细胞毒性的大小呈现浓度依赖性,受生产工艺及材料表面形态的影响,并与细胞与材料作用方式及细胞培养方法有关[8⁃9]。目前对于制备培养细胞的石墨烯的方法没有统一的标准,且多将石墨烯改性或制备成石墨烯片来培养细胞。而本实验通过氧化还原法获得的石墨烯具有特征性D峰与G峰[10⁃11],表面较为光滑且尺寸均匀。将其配制成不同浓度的分散液培养DPSCs,使其与细胞充分作用,与对照组相比,仅100μg/mL组在72 h对DPSCs的增殖有抑制作用,其余各组对DPSCs的增殖均没有显著的影响。这与文献报道的结果相似,低浓度石墨烯培养上皮细胞或巨噬细胞,没有明显的细胞毒性且细胞摄取率较低,而高浓度石墨烯会引起细胞氧化应激,降低细胞活性[12⁃13]。
研究表明,石墨烯复合物会增加细胞迁移能力[14],本实验中显示,适宜浓度的石墨烯分散液会促进DPSCs的迁移。而在组织损伤修复与再生领域,细胞迁移能力的增加会促进组织的愈合与再生[15]。以上结果表明,本实验所制备的石墨烯具有良好的生物相容性。
石墨烯是一种以sp2杂化的碳原子组成的片层状纳米材料,除了良好的电学、机械学和热学性能,还展现出优异的生物特性,在组织工程和再生医学中具有巨大前景。本实验中用20μg/mL的石墨烯分散液培养DPSCs 3 d后,可见DPSCs形态发生改变,细胞体由长梭形转变成类圆形,细胞由双极性转变为多极性,细胞突起伸长,呈现出神经样细胞的形态[16⁃17]。有证据表明石墨烯可以增强神经细胞的分化并促进神经修复过程[18]。这可能是由于石墨烯具有良好的导电性,而适宜的电信号可以为细胞的生长提供适宜的微环境,通过传导电流刺激促进神经细胞增殖、迁移、分化及发育。
随着对纳米材料认识的加深,石墨烯由于诸多优良特性成为近年来生物医学领域研究的热点。有证据表明,石墨烯及其衍生物可以促进细胞的成骨向分化,石墨烯本身具有良好的导电性,而神经元主要是靠神经电活动行使其功能,因此越来越多的学者认为石墨烯有利于细胞成神经向分化及神经组织修复再生。目前对于石墨烯促进细胞成神经向分化的研究多采用雪旺细胞与神经干细胞,但两种细胞的获取方式具有一定的侵入性。DPSCs来源于颅神经嵴,来源广泛且免疫原性低,可在诱导下分化成神经元,故本实验选取DP⁃SCs进行研究。本实验中合成的石墨烯具有良好的生物相容性,还可能具有促进DPSCs成神经向分化的潜能,这与文献报道的石墨烯可以促进雪旺细胞分化的结果一致。
目前,对于石墨烯对DPSCs成神经向分化的影响及其机制仍然存在争议。因此,后续实验中将对石墨烯是否可促进DPSCs成神经向分化及其机制进一步研究。
【Author contributions】Sun JX processed the research and wrote the article.Li YP,Pan S,He LN,Sun XY and Zhang Srevised the ar⁃ticle.Niu YM reviewed the article.All authors read and approved the fi⁃nal manuscript as submitted.

