中药多糖定性鉴别与糖谱的研究进展*
万晓莹,刘振丽,宋志前,彭诗涛,梁东蕊,宁张弛,王 淳
(中国中医科学院中医基础理论研究所,北京 100700)
复方是中医临床用药的主要形式,是依据君臣佐使等组方原则将不同单味中药配伍而成的整体。中药作为复方的原料,其质量与中医临床疗效密切相关[1]。中药的真伪与质量优劣是影响复方临床疗效的重要因素[2-3]。因此,为保证中医的临床疗效,通过科学合理的方法对复方中的单味中药进行质量评价,以严格控制原料药的真伪和质量优劣十分必要。
多糖是普遍存在于中药中的一类化学成分,很多中药如灵芝[4]、黄芪[5]和铁皮石斛[6]等所含的多糖,是其发挥药效作用的重要物质基础。多糖是由10个或10个以上的单糖聚合而成的天然高分子类成分[7],具有提高免疫力、抗肿瘤、降血糖和抗氧化等多种活性[5-8]。因此,建立科学合理、切实可行的中药多糖质量评价方法,对于保障中药质量的稳定可控、开发新药和探究多糖生物效应及机制至关重要。除根据中药自身的性状和显微特征进行的定性鉴别外,中药所含化学成分和指纹图谱的分析,是目前中药质量评价最常采用的方法[9-13]。目前国家标准在中药多糖质量评价方面还比较薄弱。《中华人民共和国药典》2020版是采用理化法对中药多糖进行定性鉴别,即通过多糖与碱性酒石酸铜试液反应生成红色沉淀以确定中药中是否存在多糖[14],该方法因中药成分复杂多样而存在很多干扰因素,影响结果的准确性。此外,多糖生物活性还与其单糖组成、分子量及其分布等结构因素密切相关[15]。因此,该方法并不能显示中药多糖的真实状态。随着检测仪器的不断发展,许多先进的仪器分析方法已用于中药多糖定性鉴别和糖谱分析,本文对此进行了归纳总结分析。
1 中药多糖定性鉴别
1.1 依据多糖分子量及其分布的中药定性鉴别
中药多糖大多属于不同分子量分布范围的混合物[16],其分子量的表述方式有多种,包括重均分子量(Mw)、数均分子量(Mn)、黏均分子量(Mv)和Z均分子量(Mz)。文献中报道的一般是Mw[17]。多糖分子量的传统测定方法主要有渗透压法、蒸气压法、端基法、光散射法、黏度法、超滤法、凝胶渗透色谱法、凝固点下降法。随着分析仪器的发展,高效凝胶渗透色谱法(high performance gel permeation chromatography, HPGPC)、质谱法(mass spectrum, MS)已成为目前最常用的方法,此外黏度法也有采用。
1.1.1 HPGPC法 HPGPC法是目前测定多糖分子量最常用的方法。它能克服凝胶渗透色谱法耗时长、操作繁琐的缺点,被广泛用于分析和制备分离水溶性多聚物、低聚物、多糖、核酸和蛋白质等生物学物质。HPGPC法是通过测定已知不同分子量的葡聚糖标准品在凝胶色谱柱的保留时间(tR),绘制log Mw-tR标准曲线,然后根据多糖各色谱峰的tR,计算相应的Mw,以确定多糖分子量分布情况[18]。采用该方法测定,需要在分析前选择葡聚糖标准品的类型,确定供试品溶液制备方法,选择适宜的色谱柱、流动相和检测器(见表1)。

表1 HPGPC法测定中药多糖分子量及其分布的主要实验条件
HPGPC法常用的葡聚糖标准品(表1示),在不确定多糖结构的情况下,有文献同时采用2种标准品,以提高测定结果的准确性[18]。供试品溶液制备多采用水提醇沉法,也有采用超滤法对多糖进行分离后再测定[19]。采用的色谱柱多为不同截留分子量的凝胶色谱柱,如Agilent PL aquagel-OH 60、Agilent PL aquagel-OH 40、TOSOH TSK gel G4000 PWXL等。由于中药多糖的分子量分布较广,有时采用多个色谱柱联用[20],以实现全面表征多糖的分子量分布情况。常用的流动相为乙腈-水或无机盐(如氯化钠、硫酸钠)水溶液。因多糖不具有紫外可见吸收,一般采用的检测器有示差折光检测器(refractive index detector, RID)、多角度激光散射检测器(multi-angle laser light scattering detector, MALLS)、电雾式检测器(charged aerosol detector, CAD)、蒸发光散射检测器(evaporative light-scattering detector, ELSD)等,或采用多个检测器联用。王莹等[19]采用Shodex HQ-803、HQ-804和HQ-806色谱柱串联,0.2 mol/L氯化钠水溶液为流动相,RID-MALLS检测器测定三批灵芝提取物多糖的Mw。颜军等[21]采用YMC Park-Diol200(300 mm×0.8 mm)色谱柱和RID检测器,测得中性和酸性茯苓多糖的Mw分别为11721和44065。课题组前期发现,ELSD检测器的灵敏度高于RID检测器,且可采用梯度洗脱。但由于ELSD检测器要求样品需经过雾化和蒸发等处理,其重复性低于RID检测器。
1.1.2 MS法 MS法也可用于糖类分子量的测定。电子轰击离子源(EI)-MS要求样品易于气化,而糖类成分不具有挥发性,极大地限制了其在糖类分析中的应用[15]。电喷雾(ESI)-MS对真空度要求不高,可用于液质联用,采用ESI-MS分析糖类时样品不需要衍生化,就可得到准分子离子峰或者分子离子峰。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)是利用脉冲激光使基质激发,使被测高分子样品或生物大分子与基质相互作用发生离子化,从而通过样品离子的飞行时间测定其质荷比的软电离质谱[22]。该方法测定时无需对样品进行衍生化,且测定的分子量范围宽,可测Mw高达6×105,碎片离子少,测定速度快,近些年已逐渐被用于多糖分子量分布范围的测定[21-22]。MALDI-TOF-MS的检测方式分为反射式测定和线性测定2种,反射式测定模式主要适用于相对分子质量较小的聚糖测定,线性模式主要适用于相对分子质量较大的多糖[22]。应根据所检测样品的性质,选用适宜的检测模式。程安媛等[22]采用2,5-二羟基苯甲酸(DHB)为基质,测得天然白及多糖的Mw分布范围为6×104~3×105。
1.1.3 黏度法 黏度法通过测定聚合物溶液的黏度,可提供黏均分子量信息,常用于测定高分子的分子量,其适用的Mv范围为1×104~1×107[23]。对于分子结构相同的高分子聚合物而言,其特性黏度仅与其分子量有关。相对分子质量与特性黏度关系可用Mark-Houwink方程来确定[24]。如孙秀艳等[25]采用黏度法测定麦冬多糖及其水解产物的Mv为66836.5和39474.5。
1.2 依据多糖的单糖组成的定性鉴别
不同中药多糖的单糖组成不同,单糖组成分析是研究多糖结构、性质及构效关系的基础,是评价中药多糖质量的重要内容。其研究中主要包括多糖水解的方法和条件、衍生化方法和单糖检测方法。从这3个方面对实验条件进行优化,可提高多糖单糖组成分析的准确性。
1.2.1 多糖的水解 要确定多糖的单糖组成,首先需先将多糖水解成单糖。常用的水解方法主要有酸水解法和酶解法,此外还有氧化降解法、超声降解法、辐射降解法等。
酸水解法是采用强酸性试剂催化多糖水解,如盐酸(HCl)溶液/盐酸甲醇(HCl/CH3OH)溶液、硫酸(H2SO4)溶液、三氟乙酸(TFA)溶液等。多糖水解程度受水解条件影响,水解时需对酸浓度、水解时间、水解温度等进行考察。和法涛等[26-27]分别采用HCl溶液和H2SO4溶液对猴头菇多糖进行水解,考察了酸浓度、水解时间、水解温度对多糖水解的影响。结果显示,以HCl溶液和H2SO4溶液为介质,猴头菇多糖水解的最佳酸浓度均为2 mol/L,反应时间均为5 h,HCl溶液水解温度90 ℃略高于H2SO4溶液水解温度80 ℃,且两者水解程度差异无统计学意义。多糖水解时,如果水解条件温和,多糖不易水解完全,残留不溶物较多,可能导致二糖与单糖图谱重叠影响测定结果。而水解条件过于剧烈,降解出的单糖在酸性条件下易发生脱水或脱羧产生糠醛类副产物,同样影响测定结果的准确性[28],因此预实验时需要优化水解条件。
酶解法是采用糖苷酶对待测多糖进行定位水解,其专属性较酸水解高且条件温和。如Deng Y等[29]在测定太子参中水溶性非淀粉多糖的单糖组成时,采用果胶酶、纤维素酶、内阿拉伯聚糖酶和内切-1,4-β-D-半乳聚糖酶的混合溶液40 ℃过夜处理。
氧化降解法、超声降解法、辐射降解法也有被报道。如朱振元等[30]分别采用30% H2O2、2 U/mL 高温淀粉酶和超声波处理古尼虫草菌丝多糖,结果显示超声法降解的古尼虫草菌丝多糖产物分子量低于其他2种方法。肖凌云等[31]对比了HCl、TFA、H2O2、超声波和果胶酶降解黄芪-枸杞复合多糖的效果,结果表明H2O2法和超声法所获得的特征峰信息较少且处理过程繁琐,果胶酶因其酶促反应的特征专一性,得到的降解产物也较少。同为化学降解法,TFA法的单糖组分多于HCl法且特征峰易于辨认。李兆龙等[32]采用电子束辐照和敏化剂协同的方法降解壳聚糖,降解过程中吸收剂量、敏化剂的加入与否、敏化剂浓度和敏化剂类型等因素对多糖降解效果产生影响。随着吸收剂量的增加,多糖的降解效果增加。敏化剂的加入,可促进自由基产生,加速糖苷键的断裂,而氧化还原敏化体系比单纯敏化体系降解效果更好。
1.2.2 单糖的衍生化方法 图1示,多糖水解后的单糖不具有紫外与荧光吸收[33],因此采用高效液相色谱法(high performance liquid chromatography, HPLC)联用UV-Vis检测器或荧光检测器(FLD)测定时,需对单糖进行衍生化处理,使其成为具有紫外或荧光吸收的衍生物。
HPLC法采用的衍生化分为柱前衍生和柱后衍生。柱前衍生化法可相对自由地选择反应条件和衍生化试剂,不受反应动力学限制,衍生化的副产物可进行预处理以降低或消除其干扰,可允许多步反应的进行且不需要复杂的仪器设备,但形成的副产物可能影响色谱的分离,容易引入杂质或干扰峰或造成样品损失。柱后衍生法产生的副产物对色谱分离影响较小,被分析的样品可在其原有的形式下进行分析,但其需要额外的设备,对仪器要求较高,反应器造成峰展宽使分辨率降低,过量的试剂会对测定造成干扰。目前的衍生物主要为伯氨基衍生物和对氨基苯甲酸乙酯衍生物(PMP衍生物),常用的衍生化试剂有1-苯基-3-甲基-5-吡唑啉酮(PMP)、2-氨基吡啶(2-AP)、对氨基苯甲酸酯、8-萘胺-1,3,6-三磺酸(ANTS)、苯甲酰氯等。实验室最常用的为PMP试剂,因其能同时测定酸性、中性和碱性多糖[28]。
单糖亦不具有挥发性[33],因此采用气相法(gas chromatography, GC)测定多糖的单糖组成时,常对单糖进行硅烷化或乙酸酯化处理,使其成为易挥发且对热稳定的衍生物。目前的衍生物主要有糖的三甲基硅醚衍生物或糖腈乙酸酯衍生物、糖醇乙酸酯衍生物、糖的三氟乙酸酯衍生物等。硅烷化常用的衍生化试剂包括六甲基二硅氮烷、三甲基氯硅烷等,但硅烷化容易产生衍生物的异构体,使色谱图出现多个峰,影响测定结果的准确性。为避免产生衍生物的异构体,多采用衍生为乙酸酯的方法[34]。乙酸酯化常用的衍生化试剂有盐酸羟胺、硼氢化钠、醋酐和三氟醋酸酐等,反应溶剂多为吡啶和四氢呋喃。
1.2.3 单糖组成检测方法 图2示,单糖组成检测的基本步骤和方法。
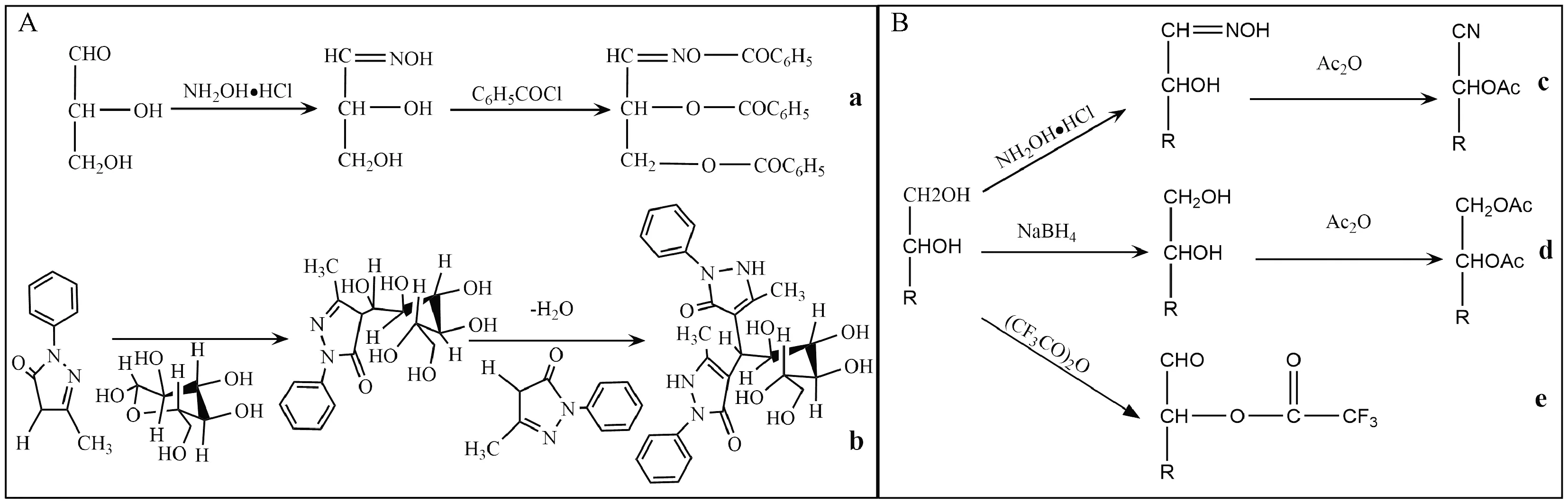
注:A.HPLC法;B. GC法;a.伯氨基衍生物;b.PMP衍生物;c.糖腈乙酸酯衍生物;d.糖醇乙酸酯衍生物;e.三氟乙酸酯衍生物图1 多糖的单糖衍生化原理
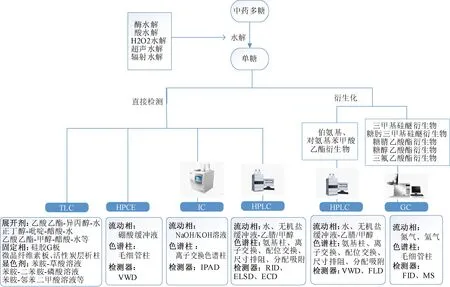
图2 多糖的单糖组成分析步骤与方法
(1)GC法:GC法是较早用于分析多糖单糖组成的检测方法,方法灵敏度高,各单糖的色谱峰的分离度良好。但GC法只适合测定中性多糖,不适宜测定糖醛酸及N-乙酰氨基糖的检测,原因是酸性多糖中的糖酸酸一经水解释放,容易发生内酯化,其内酯化程度难以重复,使测定结果重复性低[35]。若待检测的天然糖类物质中含有糖醛酸或N-乙酰氨基糖,则需要首先将其羧基还原成羟基,进行衍生化处理后再进行分析或采用较短的气相色谱柱进行检测。GC法测定多糖的单糖组成,常用的检测器包括氢火焰检测器(flame ionization detector, FID)、MS。刘源才等[35]采用糖腈乙酸酯法对水解后的枸杞多糖进行衍生化,经GC-FID法测定,确定枸杞多糖的中性多糖组成包括鼠李糖、阿拉伯糖、木糖等6种单糖。现也有文献采用GC-MS法联用测定多糖的单糖组成,通常以氦气为载气,以EI为质谱的离子源。如夏和先等[36]采用GC-MS法分析了不同种源的太子参多糖的单糖组成。
(2)HPLC法:HPLC法是测定多糖单糖组成的常用方法之一,较GC法更适用于单糖组成较为复杂的多糖检测。传统HPLC法使用最多的是键合相硅胶柱,如C18柱。但糖类是多羟基类成分,分子极性大,在键合相硅胶柱上不能有效的保留,导致保留时间短、分离效果差。现多用氨基柱分离多糖,但某些还原糖易与固定相上的氨基发生化学反应产生席夫碱,缩短柱的使用寿命,且氨基柱的流动相平衡时间长,不适用于大量样品的快速分析。目前基于离子交换、空间排阻、配位交换、分配吸附等多种分离原理的新型糖分析柱也日益应用广泛,如Sugar S系列、Sugar KS系列、Asahipak GS-220HQ、Asahipak NH2P系列色谱柱等。
表2示,HPLC法检测单糖时,常用检测器主要有VWD、FLD、RID、ELSD、CAD、电化学检测器(electrochemical detector, ECD)、二极管阵列检测器(diode array detector, DAD)。根据所用检测器的不同,可分为衍生化后测定和直接测定2种情况。一是联用VWD或FLD时,水解后的单糖需衍生化处理才能被测定,此法可检测酸性、中性和碱性多糖的单糖组成[29],但用于酮糖测定的衍生化法很少;二是联用RID、ELSD、ECD、CAD时,可无需对单糖进行衍生化[37]。胡坪等[33]采用HPLC-ELSD法直接测定麦冬多糖的单糖组成,并与HPLC-VWD法进行对比,以确证测定结果的准确性,结果显示2种方法结果一致。

表2 HPLC法联用的各检测器特征比较
(3)IC法:离子色谱法(ion chromatography, IC)是一种新型液相色谱技术,基于离子型化合物中的离子成分,可与离子柱表面的带电荷基团发生可逆性交换的原理,实现各化合物的分离。多糖水解后可直接通过IC法测定其单糖组成[37]。于青等[38]采用IC法测定灵芝孢子粉多糖的单糖组成,色谱柱为CarboPac PA10,流动相为2.5 mmol/LKOH溶液,检测器为积分脉冲安培检测器(integrated pulsed amperometric detector, IPAD)。
(4)TLC法:薄层色谱法(thin layer chromatography, TLC)测定单糖组成时,多糖水解后无需衍生化,因此也被用于中药多糖的定性鉴别。TLC法常用薄层板为硅胶G板[39]和微晶纤维素板[40-41]、活性炭层析柱[42],常用展开剂和显色剂见图2。邓勇等[40]采用纤维素薄层板测定不同虫草多糖的单糖组成,以乙酸乙酯-吡啶-醋酸-水(7.0∶3.0∶0.2∶1.4)为展开剂,以苯胺-邻苯二甲酸为显色剂,在410 nm波长处进行薄层扫描,显示不同种类的虫草多糖单糖组成相同,但单糖比例存在差别。TLC法对单糖分离度低,实验条件如温度、湿度、操作者的实验水平等,对实验结果的影响较大。
(5)HPCE法:高效凝胶电泳法(high performance capillary electrophoresis, HPCE)因操作简单、所需样品用量少和分离效率高,已逐步被用于测定中药多糖的单糖组成。陈传平等[43]运用HPCE法分析金樱子多糖的单糖组成,背景电解质为硼酸缓冲液,分离电压为20 kV,检测波长为250 nm,结果显示金樱子多糖由木糖等6种单糖组成。
2 中药多糖糖谱的建立方法
中药多糖的糖谱是通过多批次中药多糖分析而获取的共性信息建立的图谱。目前主要以多糖整体结构特征和单糖组成为依据建立糖谱。
2.1 以分子量及其分布为依据的糖谱
依据多糖整体结构特征的糖谱建立主要包括光谱法与色谱法。光谱法主要采用红外法(ion chromatography, IC)和近红外法(near infrared ray, NIR),色谱法主要采用HPGPC法,这些技术方法可以获取多糖的结构信息。如对10批次江西决明子多糖进行IR测定,通过统计分析显示,10批次样品的IR谱相似度在0.935~0.998之间,提示样品多糖官能团差异小,可快速鉴别其产地[44]。
2.2 以单糖组成为依据的糖谱
依据多糖单糖组成的糖谱建立主要采用HPLC法。如采用HPLC法测定黄精多糖的柱前衍生物糖谱,结果显示10批黄精中有10个共有峰,其中7个共有峰代表的单糖被鉴别,图谱相似度>0.99,显示该方法能较好地评价黄精多糖的质量[45]。
除了单味中药,糖谱也用于复合中药多糖的质量分析。肖凌云等运用HPLC法成功建立了黄芪-枸杞复合多糖的糖谱,10批次样品的相似度>0.9,说明复合多糖经过降解也能通过柱前衍生图谱对其进行质量评价[46]。
3 小结
多糖普遍存在于中药中,是中药的有效成分之一。多糖的结构是其生物活性的基础,但多糖结构复杂,分子量分布较广等特点加大了质量控制的难度。本研究对中药中多糖的定性鉴别和糖谱的建立方法进行了述评。除常用的TLC法和HPLC法,MS、HPCE和IC等具有高灵敏度的分析仪器也已用于中药多糖的定性鉴别。糖谱法的运用已成为多糖质量控制的热点。多种分析方法或检测器的联用,提高了检测的灵敏度和准确性,从而为中药多糖的质量控制提供了可靠平台,为保障中医临床疗效提供了技术支撑。

