板栗根际高效解磷菌的筛选
陈岩岩,叶项宇,常肖锐,徐碧林,吕锐玲,郑永良,3
(1.黄冈师范学院a.经济林木种质改良与资源综合利用湖北省重点实验室;b.大别山特色资源开发湖北省协同创新中心,湖北 黄冈 438000;2.华中农业大学 生命科学技术学院,湖北 武汉 430070;3.湖北中科产业技术研究院,湖北 黄冈 438000)
大别山板栗Castanea mollissima品种丰富,种植历史悠久,被列为国家地理标志产品。大别山板栗多生于丘陵缓坡地带的黄棕砂质土壤中。吴静等[1]通过对大别山板栗根际土壤理化性质的测定,发现其土壤贫瘠,有效磷含量仅8.39 mg/kg左右。磷元素在板栗生长发育过程中发挥着重要的作用,土壤中磷含量约为0.05%,其中可供植物吸收利用的磷仅占全磷含量的0.1%左右。
解磷微生物通过分泌一些代谢物质,改变土壤生境,溶解或矿化土壤中难溶性磷,将其转变为可溶性磷,供植物吸收利用。解磷微生物种类丰富,包括细菌、真菌、放线菌和藻类在内的多种微生物均具有溶磷能力[2-3]。微生物对磷增溶的机制:微生物通过产生有机酸、铁载体、质子、氢氧根离子、二氧化碳等使矿物态磷释放络合物;微生物胞外酶的释放(生化磷矿化);底物降解期间释放磷(生物磷矿化)[2,4]。利用微生物解决土壤缺磷问题成为国内外的研究热点[2,5]。以解磷微生物制成的微生物菌肥在农业上已有所应用。Gulati 等[6]经研究得出,接种解磷菌BIHB723 处理的玉米植株高度、枝条鲜质量、枝干质量、根长、根干质量以及土壤磷含量与对照相比均有显著增加。此外,解磷菌在小麦、甘蓝、青菜、莜麦等农作物上均有运用[7],有关解磷微生物在林业方面运用的研究报道较少。张晶晶等[8]从新疆核桃根际分离、筛选解磷菌,得到5 个属的解磷微生物,其中假单胞菌的解磷效果最好,且为优势菌属;邓小军等[9]从南方速生丰产林不同地区分离解磷微生物,筛选得到1 株高效解磷菌巨大芽孢杆菌。为揭示板栗根际微生物的解磷机制,本试验中通过从板栗根际土壤分离筛选高效解磷菌,对解磷菌株的解磷性能及其对板栗的促生效应开展了初步研究,旨在为开发应用于野外板栗的解磷微生物菌剂提供参考。
1 材料与方法
1.1 土壤取样
土壤样品采自湖北省麻城市木子店镇上马石村大别山板栗种植实验基地(31°15′9.92″N,115°25′29.66″E)。采用五点取样法,取板栗根际土壤,保存于无菌采样袋中。
1.2 培养基配制
解磷菌培养基Ⅰ,以无机磷磷酸钙为唯一磷源,配方:葡萄糖10 g,(NH4)2SO40.5 g、NaCl 0.3 g、MgSO4·7H2O 0.3 g、FeSO4·7H2O 0.03 g、MnSO4·4H2O 0.03 g、KCl 0.3 g、Ca3(PO4)22.0 g、琼脂17 g,加蒸馏水至1 000 mL,调节pH 至7.2~7.4[10]。此配方用于解磷细菌分离培养。在上述培养基中加入链霉素,终质量浓度为30 μg/mL,用于解磷真菌分离培养。
解磷菌培养基Ⅱ,以有机磷卵磷脂为唯一磷源,配方:葡萄糖10 g、(NH4)2SO40.5 g、NaCl 0.3 g、MgSO4·7H2O 0.3 g、FeSO4·7H2O 0.03 g、MnSO4·2H2O 0.03 g、CaCO35.0 g、KCl 0.3 g,pH为7.2~7.4,加入新鲜蛋黄液60 mL,加蒸馏水至1 000 mL[10]。蛋黄液为蛋黄和生理盐水体积比1∶1 的混合物。
LB 培养基配方:酵母浸粉5 g、胰蛋白胨10 g、NaCl 10 g、琼脂17 g,加蒸馏水至1 000 mL。
1.3 解磷菌分离和鉴定
1.3.1 分 离
称取土样5 g,加入盛有45 mL 0.9%无菌生理盐水的三角瓶中,30 ℃条件下180 r/min 振荡30 min,静置5 min。吸取1 mL 上清液于装有9 mL 0.9%无菌生理盐水的试管中,充分混匀,进行10 倍梯度稀释。将稀释液分别涂布在解磷菌培养基Ⅰ上,分离细菌的平板置于37 ℃恒温培养箱,分离真菌的平板置于28 ℃恒温培养箱,分别培养6 d。观察有无溶磷圈,将产生溶磷圈的菌株进行反复分离和纯化,直到得到纯培养菌株。采用十字交叉法测量溶磷圈直径(D)和菌落直径(d),计算菌株溶磷能力指标溶磷指数(α)。
α=D/d。
1.3.2 鉴 定
菌株的菌落形态观察及主要的生理生化特性测定参考文献[11]。
使用试剂盒( 生工Sangon Biotech Ezup柱式细菌基因组DNA 抽提试剂盒) 来提取菌株DNA,以细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′) 和1492R(5′-GGTTACCTTGTTACGACTT-3′) 进行16S rDNA 保守基因的PCR 扩增。将PCR 产物送华大基因科技股份有限公司进行测序,所测序列通过Blast 程序在GenBank 中搜索同源序列,采用Mega7.0 的Neighbor-joining 软件进行序列同源性比对分析,构建系统发育树。
1.4 解磷菌解磷能力分析
1.4.1 对无机磷磷酸钙的解磷能力
使用LB 培养基(未添加琼脂),将解磷菌株进行试管液体培养,用可见光分光光度计测定波长600 nm 处的吸光度,取吸光度为0.6~0.8的菌液,按1%的接种量接种到装有50 mL 解磷菌培养基Ⅰ(未添加琼脂)的三角瓶中,以无菌水为对照,每个处理设置3 个重复,180 r/min 摇瓶培养6 d。将培养好的菌液在4 ℃下离心,用钼蓝比色法测定上清液的可溶磷含量[12];用过硫酸钾消解法在121 ℃下消化30 min,然后将液体在4 ℃下离心,用钼蓝比色法测定上清液的总磷含量;用MYR0NL 6PFC 精密pH 计(上海迈哲电子科技有限公司)测定培养液的pH。
1.4.2 对有机磷卵磷脂的解磷能力
将菌株P6在解磷菌培养基Ⅱ中进行摇瓶培养,第6 天将菌液在4 ℃下离心,用钼蓝比色法测定上清液的可溶磷含量[12],以对硝基苯磷酸二钠为基质测定培养液上清液中磷酸酶活性[13]。
1.5 解磷菌回接
将解磷菌液体培养后制成菌悬液,离心,收集菌体,加入无菌蒸馏水,用可见光分光光度计测定并使其在波长600 nm 处吸光度为0.6~0.8,按1%接种量回接到苗期60 d 的板栗组培苗土壤中,以无菌水为CK。每处理5 个重复,将盆栽置于培养室培养90 d 后采样。测定植株的株高、茎粗、茎叶鲜质量、茎叶干质量等指标;测定植株不同部位的氮、磷含量;测定板栗根际土壤的基本理化性质[14]和土壤酶活性[13]。
1.6 数据处理
使用Excel 软件处理试验数据,使用SPSS 软件进行统计学分析,使用Origin 8.5 软件作图。
2 结果与分析
2.1 板栗根际解磷菌的分离
使用解磷菌培养基Ⅰ分离解磷菌,从板栗根际土壤中筛选出7 株能产生溶磷圈的菌株,分别命名为P1~P8(表1)。其中,P8 为解磷真菌,其他菌株为解磷细菌。平板培养6 d 后,采用十字交叉法测定菌株的溶磷圈直径和菌落直径,计算溶磷指数(α),根据α值初步判断菌株的解磷能力,规定α 值不小于2 为溶磷能力较强的菌株。
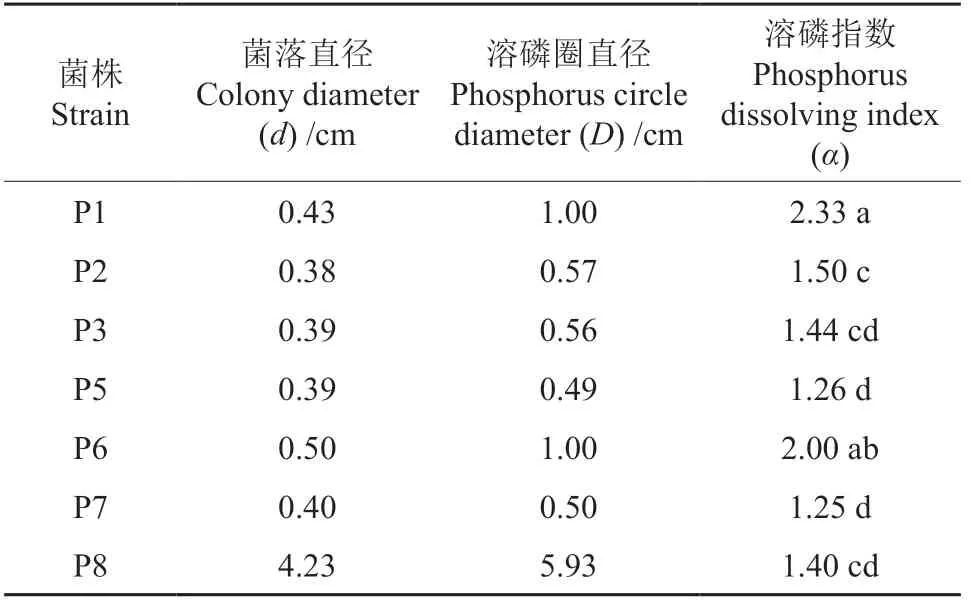
表1 采用透明圈法筛选出的板栗根际解磷菌†Table 1 Screening of phosphate-solubilizing microorganisms in chestnut rhizosphere by transparency circle method
从表1可以看出,分离菌株的α值为1.25~2.33。其中,菌株P1和P6的α值分别为2.33、2.00,菌株在平板上形成的溶磷圈如图1所示。
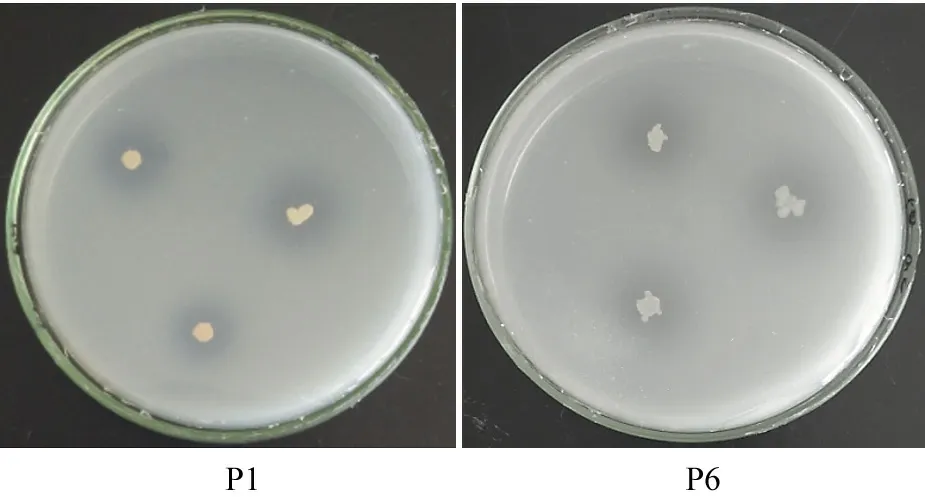
图1 菌株P1 和P6 在平板上形成的溶磷圈Fig.1 Phosphate dissolving circle of strains P1 and P6 in medium
使用解磷菌培养基Ⅰ(未添加琼脂),对初筛得到的2 株菌株P1 和P6 进行培养,6 d 后培养液中可溶磷含量与CK 相比均有所增加,分别为15.43、75.98 mg/L(图2),分别占培养液中总磷含量(135 mg/L)的11.40%、56.28%。结果表明,菌株P6 的解磷能力最强,确定菌株P6 作为后续研究的出发菌株。
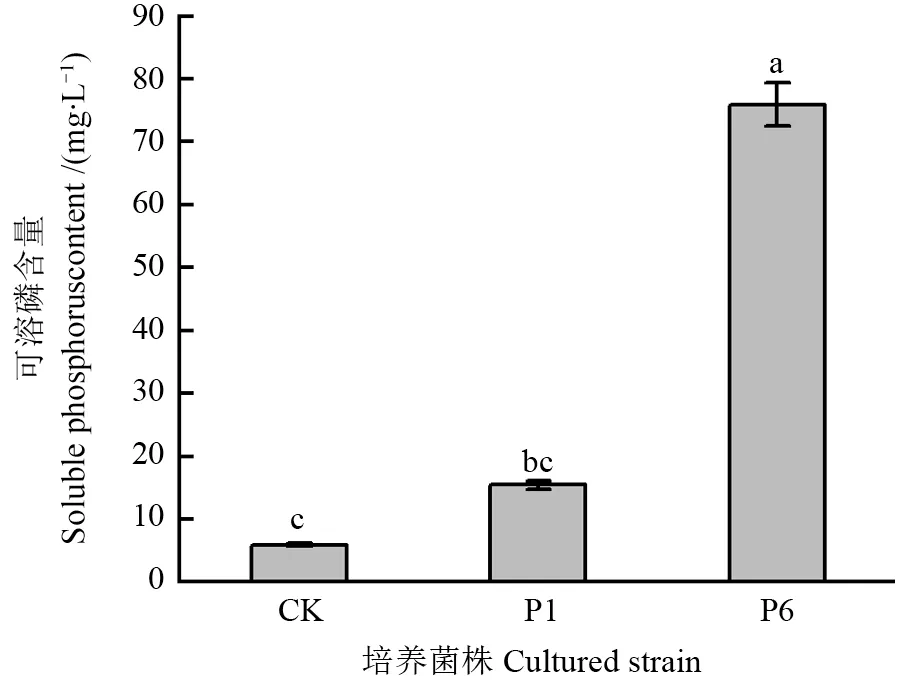
图2 初筛得到板栗根际菌株P1 和P6 培养6 d 后培养液的可溶磷含量Fig.2 Preliminary screening obtained the soluble phosphorus content of chestnut rhizosphere strains P1 and P6 after culture for 6 days
2.2 板栗根际解磷菌的鉴定
2.2.1 菌株P6 的形态及生理生化特征
将菌株P6 在LB 培养基上培养48 h 后,菌落为圆形,表面湿润,不透明,白色,边缘整齐,革兰氏阴性。菌株P6 的过氧化氢酶测试、乙酰甲基甲醇试验、甲基红试验、淀粉水解试验结果均显示阴性,吲哚试验、明胶试验、柠檬酸盐试验结果均显示阳性。
2.2.2 菌株P6 的16s rDNA 分子鉴定及系统发育分析
提取菌株P6 的全基因组DNA,利用通用引物进行PCR 扩增得到菌株16s rDNA 保守基因,对PCR 产物进行测序,将测序结果提交至Genbank,登录号为MT176502。Blast 在线相似性分析结果表明,菌株P6 的16s rDNA 的保守基因序列与Genbank 中的Burkholderia cepaciaGJ8 同源性高达99%,结合其形态和生理生化特性,初步鉴定菌株P6 为洋葱伯克霍尔德氏菌B.cepacia,菌株的系统发育进化树如图3所示。
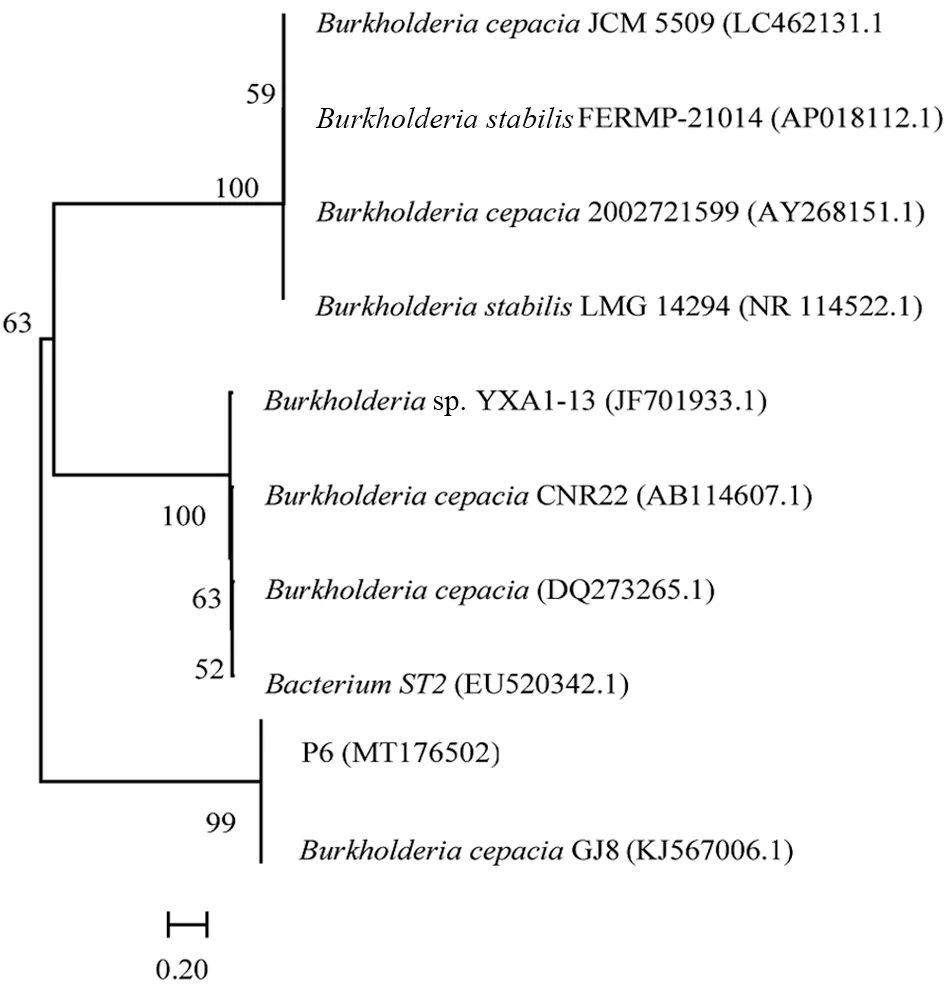
图3 板栗根际菌株P6 的系统进化树Fig.3 Phylogenetic tree of chestnut rhizosphere strain P6
2.3 板栗根际菌株P6 的解磷特性
2.3.1 对无机磷磷酸钙的解磷能力
使用解磷菌培养基Ⅰ(未添加琼脂),对菌株P6 进行培养后,培养液可溶磷含量及其pH 如图4所示。由图4可以看出,培养液可溶磷含量为75.98~78.84 mg/L,随着培养时间延长先升高、后逐渐下降,在培养4 d 后达到最大值。培养液pH 为3.41~3.59,差异不显著,随着培养时间延长逐渐增加,并趋于稳定。
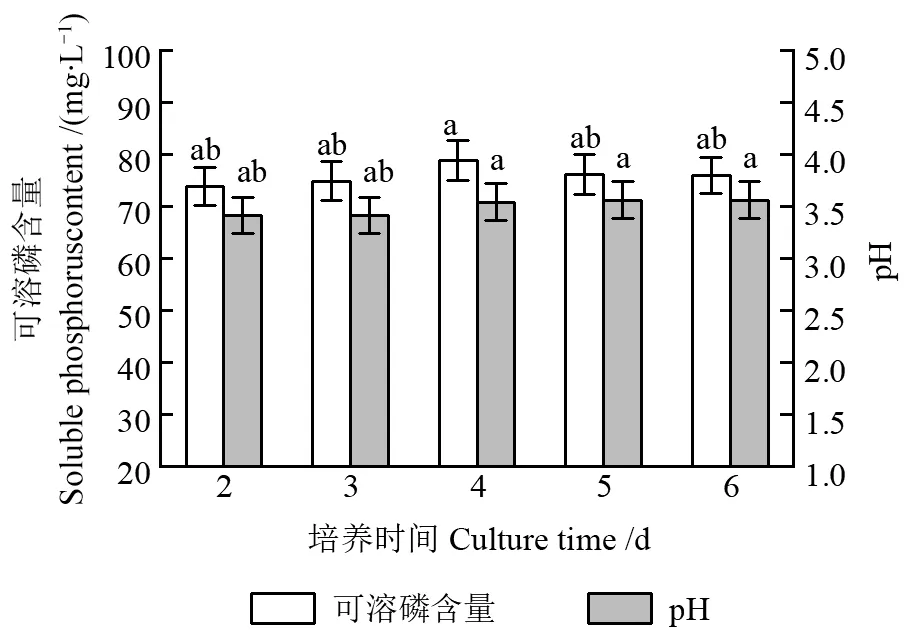
图4 培养板栗根际菌株P6 的解磷菌培养基Ⅰ的可溶磷含量及其pH 的变化Fig.4 The content of soluble phosphorus and the change of pH in phosphate solubilizing bacteria medium I for culturing chestnut rhizosphere strain P6
培养液可溶磷含量与pH 之间的相关性如图5所示。由图5可以看出,菌株P6 培养液中可溶磷含量与pH 呈线性关系,相关系数r=0.703,P<0.001,说明二者呈极显著正相关。
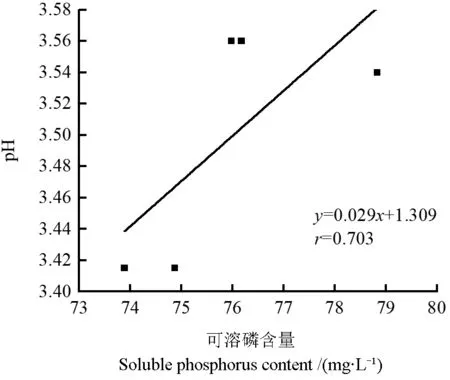
图5 板栗根际菌株P6 培养液可溶磷含量与其pH 的关系Fig.5 The relationship between the soluble phosphorus content and pH of chestnut rhizosphere strain P6
2.3.2 对有机磷卵磷脂的解磷能力
将菌株P6 在解磷菌培养基Ⅱ中进行摇瓶培养6 d 后,培养液可溶磷含量及其pH 如图6所示。由图6可以看出,菌株P6 培养液中可溶磷含量为44.06 mg/L,是CK 的7.16 倍,表明菌株P6 具有溶解有机磷卵磷脂的能力。培养液pH 显著下降,由5.69 降低至3.78(P<0.05)。
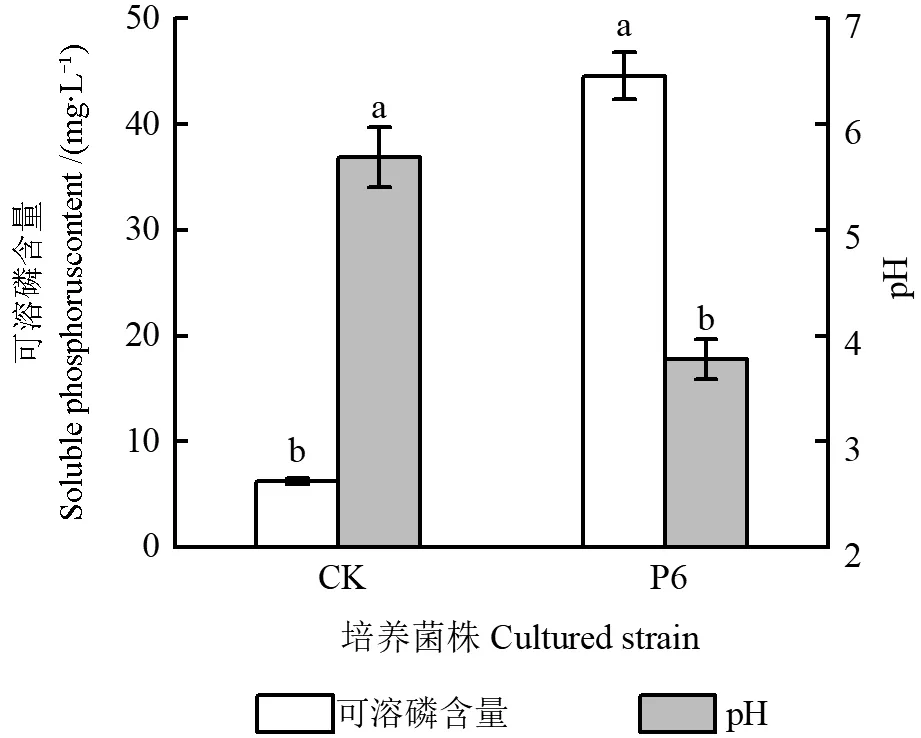
图6 培养板栗根际菌株P6(6 d 后)的解磷菌培养基Ⅱ的可溶磷含量及其pHFig.6 The soluble phosphorus content and pH of phosphate solubilizing bacteria medium Ⅱ for culturing chestnut rhizosphere strain P6 (after 6 d)
将菌株P6 在解磷菌培养基Ⅱ中进行摇瓶培养6 d 后,培养液的磷酸酶活性如图7所示。由图7可以看出,菌株P6 培养液的磷酸酶活性显著高于CK(P<0.05),碱性磷酸酶、酸性磷酸酶活性分别增加了16.62、24.61 mmol/(L·h)。

图7 培养板栗根际菌株P6(6 d 后)的解磷菌培养基Ⅱ的磷酸酶活性Fig.7 Phosphatase activity of phosphate solubilizing bacteria medium II for culturing chestnut rhizosphere strain P6 (after 6 d)
2.4 板栗根际菌株P6 对板栗苗的促生作用
菌株P6 对板栗植株生长及其氮、磷含量的影响见表2。由表2可知,与CK 相比,接种菌株P6 后,板栗幼苗的株高、茎粗、地上部鲜质量、地上部干质量、地下部鲜质量、地下部干质量分别比CK 增加了60.70%、21.67%、204.76%、223.08%、64.00%、80.00%,其中地上部鲜质量和地上部干质量增加极显著,表明接种解磷菌P6 促进了板栗幼苗的生长。接种菌株P6 后,板栗幼苗的地上部含磷量、地下部含磷量分别比CK 显著增加53.41%、52.33%,表明接种解磷菌P6 促进了板栗幼苗对土壤磷素的吸收。

表2 接种菌株P6 后板栗植株的生长指标及其氮、磷含量†Table 2 Growth index and nitrogen and phosphorus content of chestnut plant after inoculation with strain P6
菌株P6 对板栗根际土壤的理化性质和土壤酶活性的影响见表3。由表3可知,接种菌株P6 后,土壤pH 下降,土壤有机质、有效氮、总氮、有效磷、总磷含量分别增加了27.31%、146.86%、126.88%、85.59%、21.99%,表明接种菌株P6 后土壤环境改善。土壤酶的活性有所增加,其中碱性磷酸酶和酸性磷酸酶活性分别显著增加了145.54%、449.27%。结果表明,回接菌株P6 对板栗幼苗生长具有明显的促进作用。

表3 接种菌株P6 后板栗根际土壤的理化性质和土壤酶活性†Table 3 Physical and chemical properties and soil enzyme activity of chestnut rhizosphere soil after inoculation with strain P6
3 结论与讨论
本研究中,从板栗根际筛选出1 株高效解磷菌株P6,经鉴定为洋葱伯克霍尔德氏菌B.cepacea。该菌株可溶解难溶性无机磷磷酸钙和有机磷卵磷脂,以磷酸钙为磷源的培养液中可溶磷含量与其pH 显著相关。将菌株P6 回接至板栗幼苗根际土壤中,能改善板栗土壤生境,促进板栗苗对土壤磷的吸收,显著促进板栗幼苗的生长。
目前,从不同的植物根际所筛选的解磷微生物种类繁多,应用在农业上的解磷微生物主要包括芽孢杆菌属Bacillius、根瘤菌属Rhizobium、青霉Penicillium等[15]。本研究中从板栗根际土壤筛选出的高效解磷菌P6 可同时利用无机磷和有机磷,培养6 d 后培养液中可溶磷含量分别达到75.98、44.06 mg/L。Braz 等[16]经研究得出,洋葱伯克霍尔德菌对CaHPO4的溶磷量为0.57 g/L。林启美等[17]研究了解磷细菌对不同磷矿粉的解磷量,结果表明不同地区的磷矿粉解磷微生物的解磷能力不同。刘小玉等[18]筛选得到1 株B.capacia,该菌株对卵磷脂的溶磷量为201.38 mg/L。说明解磷微生物的溶磷能力不仅取决于微生物本身,还与磷的化学结构有关,同时与微生物的种类和生境密切相关。
解磷微生物通过分泌一些代谢物降低溶液pH来溶解难溶性无机磷是较常见的一种解磷机制[19],然而对于溶磷量与pH 之间的关系尚无定论。郝晶等[20]经研究得出可溶磷含量与pH 之间缺乏相关性;Braz 等[16]经研究发现,洋葱伯克霍尔德菌培养液的pH 范围在4.2~5.0,可溶磷含量与pH 之间显著相关。本研究中,菌株P6 培养液的pH 范围在3.42~3.59,可溶磷含量与pH 呈极显著相关,说明解磷微生物的解磷机制复杂,可能是因为不同菌株分泌代谢物的种类及总量有较大差异,或者多种微生物解磷机制并存。微生物通过分泌胞外酶,可使难溶性有机磷矿化,其中磷酸酶在磷元素代谢过程中发挥重要作用。Hidayat 等[21]经研究发现,酸性磷酸酶活性的抑制和解除抑制的调节,受磷酸盐浓度调节机制的控制;Braz 等[16]发现洋葱伯克霍尔德菌培养液的磷酸盐浓度与磷酸酶活性之间的相关性不显著。本研究中,在以卵磷脂为磷源的P6 菌株培养液中磷酸酶活性和溶磷量均高于CK,P6 菌株在解磷过程中调控磷酸酶活性的机制需要进一步深入研究。
解磷菌剂不仅可以促进植物的生长,还可促进植物对土壤磷的吸收。吕俊等[22]接种Burkholderiasp.显著提高了盆栽马尾松幼苗的苗高和鲜质量等;何雪香等[23]也研究了单接种解磷菌对秋茄苗高的促进作用。从盆栽试验结果来看,与CK 相比,接种菌株P6 可显著促进板栗幼苗的生长。闫小梅等[24]报道,接种荧光假单胞菌菌株Y1 明显促进了花生的生长及植株对土壤氮磷钾的吸收;Poonguzhali 等[25]报道,将从白菜根际分离的解磷菌假单胞菌对白菜进行回接,与CK 相比,增加了白菜的根长,但是对白菜吸收磷的影响不明显。
向珊珊等[26]通过对大别山林地小气候和土壤理化性质测定,发现在不同季节土壤温湿度及其理化性质差异显著。本研究中仅在第2 季度进行土壤根际采样,未考虑采样时间的影响,下一步的研究中应增加根际土壤采样的次数,进行不同季节根际土壤采样,来分离、筛选高效解磷菌。另外,筛选得到的菌株P6 仅运用在了室内板栗组培苗上,解磷微生物在板栗根部的定植受到多种因素的影响,实验室条件下菌株P6 表现出了较好的溶解磷能力,而解磷菌株野外回接可能受多种外界环境条件影响。为给基于菌株P6 的微生物菌肥研发提供参考,可进一步将解磷菌P6 进行野外板栗接种试验,研究其在板栗根际土壤的定植、对板栗的促生作用及对板栗土壤生境的影响。

