草菇自溶过程中果胶酶及纤维素酶的活力变化*
刘静华,欧阳钰,钟舒雅,马钰霖,陈诗依,吴 偲,刘 主
(韶关学院英东生物与农业学院,广东 韶关 512005)
草菇(Volvariella volvacea),担子菌亚门(Basidiomycatina) 层菌纲 (Hyoenomycetes) 伞菌目(Agaricales) 光柄菇科 (Pluteaceae) 草菇属(Volvariella)[1]。因在稻草上生长得名,又名秆菇、兰花菇、南华菇、中国蘑菇、美味包脚菇等。草菇具有较高的营养成分与保健价值。草菇含8种人体必需氨基酸,占其氨基酸总量的38.2%。草菇含有多糖类物质,能抑制癌细胞生长[2]。同时草菇属于低升糖指数食物,是糖尿病患的理想食物。草菇属于高温型腐生真菌,在10℃~44℃、相对湿度80%~95%时生长旺盛[3]。最适保存温度为15℃,高于或低于15℃均容易发生软化自溶[4]。草菇自溶可能是由于细胞壁结构改变、细胞壁成分降解所致。草菇的细胞壁含有果胶和纤维素等的物质,认为与草菇自溶有关[5]。通过测定不同温度下草菇自溶过程中果胶酶和纤维素酶的活性变化,以期探讨草菇自溶与这两种酶活性的变化关系,以期为草菇保鲜提供参考。
1 草菇细胞壁成分影响酶
1.1 果胶酶
果胶主要是由D-半乳糖醛酸以α-1,4糖苷键连接而成的直链聚合物[6]。果胶酶(pectinase) 是指能够催化果胶质分解的多种酶的总称[7]。果胶酶一般包含果胶酯酶 (pectinesterase)、聚半乳糖醛酸酶(polygalacturonase)、果胶裂解酶 (pectate lyase) 3种。酯酶水解果胶酯成为果胶酸和甲醇;解聚酶分为果胶水解酶和果胶裂解酶,可断开果胶中部分D-半乳糖醛酸的α-1,4糖苷键[8-10];真菌分解果胶类物质的酶主要是果胶裂解酶。果胶酶瓦解细胞壁中的果胶成分,破坏细胞壁,导致果实软化腐败。故果胶酶与草菇自溶理论上存在一定的关系[11]。
1.2 纤维素酶
纤维素酶(cellulase)是一种多组分复合酶,包含C1酶、Cx酶和β-葡萄糖苷酶3种。其中C1酶可水解天然纤维素成为无定形纤维素,Cx酶可将其继续水解为纤维寡糖,β-葡萄糖苷酶进一步水解纤维寡糖成为葡萄糖。研究认为,纤维素酶在某些水果如青梅[12]、桃[13]、甜樱桃[14]果实的软化中起主要作用。近年来对纤维素酶的研究显示,纤维素酶与果实早期的成熟软化有着密切联系[15],薛炳烨等[16]发现纤维素酶活性的升高是肥城桃果实硬度下降的首因。Tonutti等[17]报道,桃的果实在呼吸跃变前只有pI6.5的纤维素酶同工酶表现活性,呼吸跃变后出现了pI6.5和pI9.5共2种纤维素酶同工酶。部分真菌的细胞壁含有纤维素[18],纤维素酶能分解细胞壁中的纤维素,从而使细胞壁遭到破坏。因此纤维素酶也可能与草菇的自溶有关。
2 试验材料和方法
2.1 试验材料
草菇菌株V23,实验室保存;D-半乳糖醛酸,北京金泰宏达生物科技有限公司;葡萄糖,天津市科密欧化学试剂有限公司;醋酸钠缓冲液(0.2 mol·L-1,pH 4.8),西陇化工有限公司;0.25%果胶溶液,浙江一诺生物科技有限公司;二硝基水杨酸试剂(DNS试剂),天津福辰;羧甲基纤维素钠溶液(CMC-Na溶液),天津市大茂化学试剂厂;Ultrospec 2000紫外分光光度计,Pharmacia Biotech;HH-S28s恒温水浴锅,金坛市环保仪器厂;冰箱,华凌;恒温培养箱,广东省医疗器械厂。
2.2 试验方法
2.2.1 草菇粗酶液制备
选取新鲜无损伤、无褐变的草菇子实体1 000 g,无菌水洗净擦干,分为2组,每组各500 g,分别放置于4℃、30℃保存。4℃条件下,每隔2 d观察草菇的自溶情况,加双蒸水提取20 g草菇的液汁为粗酶液进行各项检测,共观察采样8次;由于高温条件下,草菇自溶较快,30℃保存的草菇每隔1 d观察其自溶情况,加双蒸水提取20 g草菇液汁作为粗酶液进行各项检测,共观察采样8次。
2.2.2 果胶酶的活力测定
果胶酶酶活力测定常用方法包括还原法、粘度法、还原糖法(DNS法) 等[16-17]。选用更精确的DNS法测定草菇果胶酶酶活力。3,5-二硝基水杨酸(DNS)与醛糖共热能够产生棕红色的氨基化合物,在一定范围内还原糖量与呈色物溶液颜色成正比,以标准半乳糖醛酸液作标准曲线,540 nm波长下测定待测液吸光值可算出半乳糖醛酸含量,从而计算果胶酶酶活力。
1)半乳糖醛酸标准曲线的绘制
准确称取100 mg分析纯半乳糖醛酸,用pH 4.8醋酸钠缓冲液配制成浓度为l mg·mL-1的半乳糖醛酸标准溶液。取7支刻度具塞试管,分别加入0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL 半乳糖醛酸标准液,加入1.5 mL DNS液混合均匀,在沸水浴中加热5 min,取出后立即用流水冷却至室温,每管加蒸馏水稀释到12.5 mL,摇匀,于540 nm波长处测定吸光值。以半乳糖醛酸浓度为横坐标,以光吸收值为纵坐标,绘制标准曲线。
2)DNS法测定果胶酶酶活力
取2支试管,各加入0.90 mL的0.25%果胶底物溶液(醋酸钠缓冲液配置),置于恒温水浴箱37℃保温5 min。其中1号管(空白管) 加0.20 mL煮沸失活的粗酶液,2号管(样品管) 加入粗酶液0.20 mL,将2支试管置于恒温水浴箱37℃温浴30 min;向各管加入DNS试剂1.50 mL混合均匀,终止反应;沸水浴5 min;流水冷却试管;向试管分别加入双蒸水7.40 mL,混匀;540 nm波长下,以空白管调零,测样品管吸光度,通过半乳糖醛酸标准曲线或用线性回归方程求出还原糖的含量,酶活力(X1,U·mL-1)的计算公式为:

式中:G1为半乳糖醛酸含量(mg);30为保温时间,即酶与底物作用时间(min);Ew为粗酶液的体积(mL)。
一个酶活力单位指在37℃、pH 4.8的条件下,每分钟催化果胶水解成1 μmoL半乳糖醛酸的酶量。
2.2.3 纤维素酶酶活力测定
1)葡萄糖标准曲线的绘制
准确称取100 mg分析纯无水葡萄糖(预先在105℃干燥至恒重),用蒸馏水,配制成浓度为 1 mg·mL-1的葡萄糖标准溶液。取7支刻度具塞试管,分别加入0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL葡萄糖标准液,加入1.5 mL DNS液(3,5-二硝基水杨酸试剂)混合均匀,在沸水浴中加热5 min,取出后立即用流水冷却至室温,每管加蒸馏水稀释到12.5 mL,摇匀,于520 nm波长处测定吸光值。以葡萄糖浓度为横坐标,以光吸收值为纵坐标,绘制标准曲线。
2)滤纸法(FPA) 测定纤维素酶酶活力
滤纸含有聚合度、结晶度适中的纤维素,可以定性滤纸为底物,经纤维素酶水解后生成还原糖,以还原糖的量来对标纤维素酶系总的糖化能力。即为滤纸酶活(FPA),此法应用广泛,且能够反映3类酶组分的协同作用[19]。取2支刻度具塞试管,1号为空白管,2号为样品管。分别向2支管中加入0.05 mol·L-1醋酸钠缓冲溶液 (pH 4.8) 2.00 mL,空白管则加入煮沸失活后的纤维素粗酶液1.00 mL,样品管中加入粗酶液1.00 mL,均使管内溶液浸没滤纸(3 cm×2 cm,揉成团),盖塞。将2支试管同时置于50℃水浴锅中水浴60 min。取出后立即加入DNS试剂3.00 mL,摇匀。将2支管同时放入沸水浴中水浴10 min,取出迅速冷却至室温,每管内容物用重蒸水稀释到25.00 mL,摇匀。520 nm波长下,以空白管调零,测样品管吸光度,通过葡萄糖标准曲线或用线性回归方程求出还原糖的含量,酶活力(X2,U·mL-1)的计算公式为:

式中:G2为葡萄糖含量(mg);60为保温时间,即酶与底物作用时间(min);Ew为粗酶液的体积(mL)。
一个酶活力单位指在50℃、pH 4.8的条件下,每分钟催化纤维素水解成1 μmol葡萄糖的酶量。
3) 羧甲基纤维素钠(CMC-Na) 法测定纤维素酶酶活力
纤维素酶能降解CMC-Na生成葡萄糖等还原糖,再用DNS法显色,用标准葡糖糖液作标准曲线,520 nm处测其吸光度[20]。取2支刻度具塞试管,1号为空白管,2号为样品管。分别向2管中加入CMC-Na溶液1.00 mL,空白管中加入煮沸失活后的纤维素粗酶液0.50 mL,样品管中加入粗酶液0.50 mL,混匀,盖塞。将2支试管同时置于50℃水浴锅中水浴30 min。取出后迅速加入DNS试剂1.50 mL,摇匀。将试管同时放入沸水中水浴10 min,取出迅速冷却至室温,每管用重蒸水稀释到12.50 mL,摇匀。520 nm波长下,以空白管调零,测样品管吸光度,通过葡萄糖标准曲线或用线性回归方程求出还原糖的含量,酶活力(X3,U·mL-1)的计算公式为:
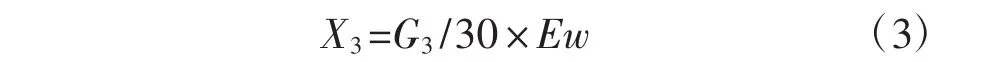
式中:G3为葡萄糖含量(mg);30为保温时间,即酶与底物作用时间(min);Ew为粗酶液的体积(mL)。
一个酶活力单位指在50℃、pH 4.8的条件下,每分钟催化纤维素水解成1 μmol葡萄糖的酶量。
3 结果与分析
3.1 草菇高温自溶对比
草菇自溶前后的对比见图1。

图1 草菇自溶前后对比图Fig.1 Volvariella volvacea before and after autolysis
由图1所示,草菇自溶的过程中,外观色泽逐渐变褐色,气味从鲜菇味变为有刺鼻异味,菇体从硬实有弹性变为软塌,表面出现粘液、出水,为草菇自溶过程发生软化,液化现象。
3.2 半乳糖醛酸标准曲线
半乳糖醛酸标准曲线见图2。
由图2可知,利用Excel 2010绘制标准曲线,得到回归方程及相关系数;对测得的结果进行F检验,F值为0.056 0,P值为0.009 1(P<0.01),差异极显著。R接近于1,说明其相关性较大。

图2 半乳糖醛酸标准曲线Fig.2 Standard curve of galacturonic acid
3.3 葡萄糖标准曲线
葡萄糖标准曲线见图3。

图3 葡萄糖标准曲线Fig.3 Standard curve of glucose
由图3所示,利用Excel 2010绘制标准曲线,得到回归方程及相关系数;对测得的结果进行F检验,F值为0.415 3,P值为0.006 9(P<0.01),差异极显著。R接近于1,说明其相关性较大。
3.4 低温自溶结果
草菇4℃储存条件下果胶酶活力变化曲线见图4。
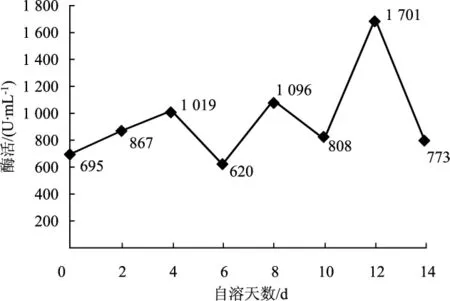
图4 4℃条件下果胶酶活力变化曲线Fig.4 Variation curve of pectinase activity at 4℃
由图4可知,随着冷藏时间的增加,果胶酶活力在草菇自溶前期趋于不变,但在自溶第12天时突然上升之后又下降;说明低温条件下,果胶酶在草菇自溶后期会产生有一定的影响。不同方法测定4℃储存条件下纤维酶的活力变化曲线见图5、图6。
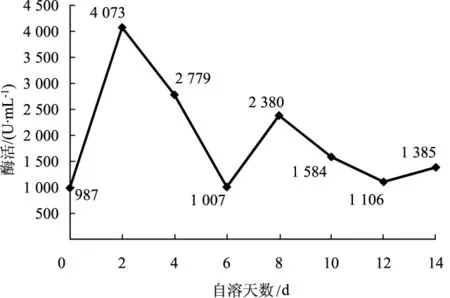
图5 4℃条件下CMC-Na法测定纤维酶的活力变化曲线Fig.5 Variation curve of cellulase activity by CMC-Na at 4℃
由图5、图6可知在草菇自溶前期,纤维素酶活性先上升后下降,后又趋于稳定。说明低温条件下,纤维素酶影响草菇的自溶前期。由于FPA法能反映纤维素酶中3类酶组分的协同作用,而CMCNa法反映的是内切葡聚糖酶的作用,所以从第6天、第8天、第10天的数据看,2种方法测得的酶活变化趋势略有不同。

图6 4℃条件下FPA法测定纤维素酶的活力变化曲线Fig.6 Variation curve of cellulase activity by FPA at 4℃
综上,草菇在4℃低温自溶过程中果胶酶与纤维素酶对草菇自溶都有一定的影响,但作用的时期不同。
3.5 高温自溶数据表
草菇30℃储存条件下果胶酶活力变化曲线见图7。
由图7所示,30℃处理条件下果胶酶在自溶第1天时,活力达到最大值,之后果胶酶活力随着时间的增加,活力逐渐下降,后期变化趋于平稳。不同方法测定4℃储存条件下纤维酶的活力变化曲线见图8、图9。
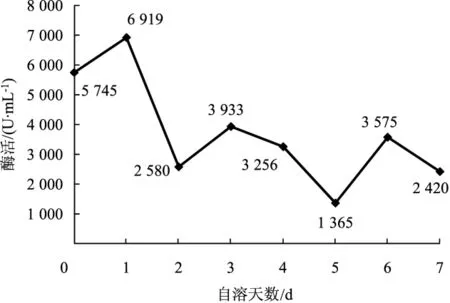
图7 30℃条件下果胶酶活力变化曲线Fig.7 Variation curve of pectinase activity at 30℃
由图8、图9可知,在草菇高温自溶过程中纤维素酶活性均为先升高后降低,之后趋于稳定,且在自溶第2天和自溶第3天时,纤维素酶的活力相近,达到最大值,说明纤维素酶在草菇自溶中期有重要影响。
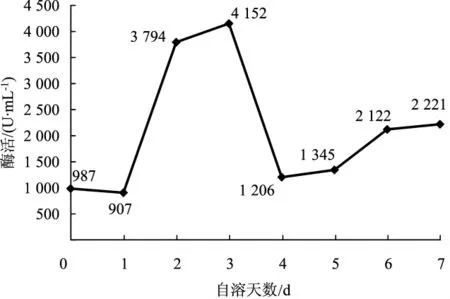
图8 30℃条件下CMC-Na法测定纤维酶的活力变化曲线Fig.8 Variation curve of cellulase activity by CMC-Na at 30℃
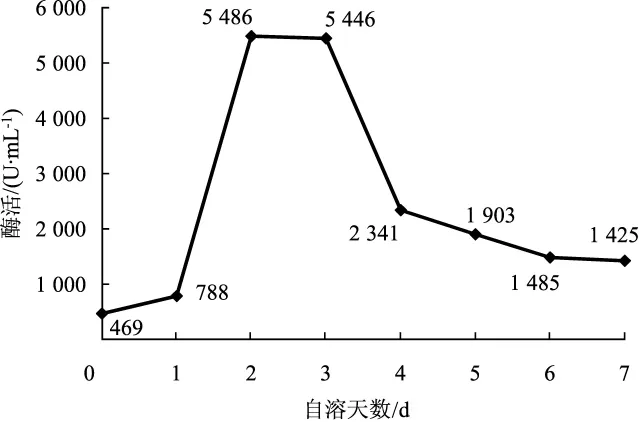
图9 30℃条件下FPA法测定纤维素酶的活力变化曲线Fig.9 Variation curve of cellulase activity at 30℃by FPA
4 结论
对比2组试验结果,草菇中果胶酶活性在低温自溶和高温自溶中变化趋势不同。而草菇纤维素酶在低温及高温自溶中的变化趋势相近。
草菇采后即切断了外部环境营养物质的供应,只能通过消耗自身糖类物质产能进行代谢活动[21]。此时菇体内的水解酶如果胶酶、纤维素酶作用于细胞壁、细胞质中的果胶和纤维素,使自身降解、软化、液化,甚至腐烂。试验表明,不管是低温自溶还是高温自溶,草菇内纤维素酶与果胶酶的活力变化对其自溶均有一定的影响;且作用的时期和机制不同。果胶酶在草菇低温自溶后期起主要作用;在高温自溶前期起主要作用。而纤维素酶在草菇低温及高温自溶的前中期起主要作用。表明草菇软化和自溶可能与果胶酶和纤维素酶的活性变化有关,且低温自溶和高温自溶的机制可能不同。对茶树菇(Agrocybe aegerita)[22]、双孢蘑菇 (Agaricus bisporus)[23]自溶机理与真空预冷技术的研究中,也提出在不同贮藏温度下茶树菇、双孢菇内果胶含量和果胶酶、纤维素含量和纤维素酶均有明显差异。

