海南省药品不良反应监测现状分析及对策
林丽君,苗会青,林 凯(.海口市药品不良反应监测中心,海南 海口 5703;.海南省药品不良反应监测中心,海南 海口 5706)
药品不良反应(adverse drug reaction,ADR)监测作为药品安全监管的最后一道防线,在药品安全性评价及风险控制方面发挥着至关重要的作用。我国逐渐形成国、省、市、县四级监测体系[1],各级监测机构的设置及人员的配置情况直接影响到全省ADR监测工作。医疗机构作为ADR报告的主体[2],提高医院报告的质量、降低漏报率是做好整体监测工作和发挥预警作用的重要环节[3]。药品上市许可持有人(marketing authorization holder,MAH)应对药品质量的监控与再评价承担主要责任[4],落实好MAH直接报告制度是药品全生命周期管理的重要环节和手段。笔者从监测机构、医疗机构及MAH三个角度对当前我省ADR监测现状进行研究及思考,旨为全面提升海南省ADR监测能力提供参考。
1 资料与方法
根据2015年1月– 2019年12月国家ADR监测系统(海南数据库),中国期刊全文数据库(CNKI),海南省MAH 2019年药物警戒年度报告及全省各市、县监测机构设置情况调研结果等数据,手工筛选剔除重复报告,采用Excel软件对数据结果进行统计、分析。
2 结果
2.1 监测机构设置及人员配置
海南省ADR监测机构中,省级监测机构有2个,分别为海南省ADR监测中心、海南省博鳌先行区ADR监测中心;市级监测机构有3个,分别为海口市ADR监测中心、三亚市ADR监测中心及海南省ADR监测中心儋州分中心;其余均为县级监测机构。全省21个ADR监测机构中,仅有博鳌先行区、海口市、三亚市3个中心为独立机构。经计算,全省独立机构仅占14.3%,省级监测机构平均编制数3.5人,市县级监测机构平均编制数1.3人。
2.2 医疗机构监测模式
2.2.1 组织机构 全省共有9家药械不良反应/事件监测站,均为省属三级医院,并成立了ADR监测领导小组,5家配备了专职人员,监测员中除1名为药学信息管理员外,其余均为药学专业。8家已建立ADR报告奖惩制度和临床药师查房制度。经调查,大部分二级以上医疗机构成立了ADR监测工作领导小组,但乡镇卫生院及卫生服务站仅配备了ADR监测员。
2.2.2 报告收集途径 我国近年实施的ADR监测属被动监测,即依靠医务人员发现ADR病例后上报[5]。近五年数据显示,ADR上报者(即第一发现人)主要是医生,其次为药师、护士。发现ADR途径有门诊病历、药房退药、患者投诉、临床医生或药师查房、护士反馈。详见表1。
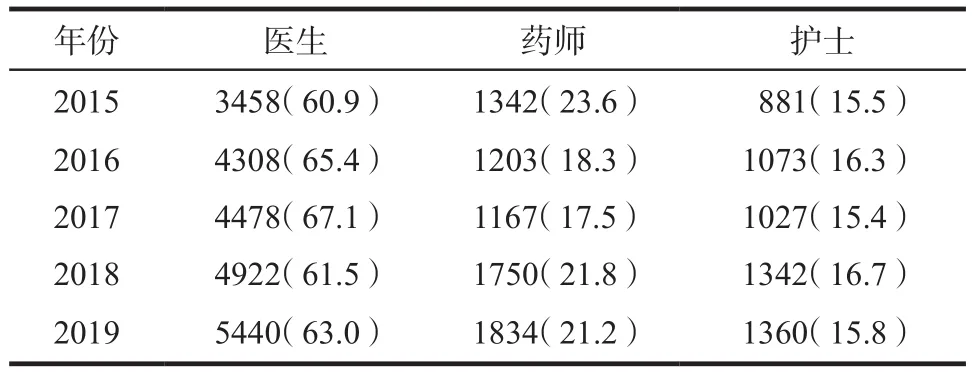
表1 2015 – 2019年医疗机构ADR报告人职业分布.例(%)Tab 1 Occupational distribution of ADR reporters in medical institutions from 2015 to 2019. case(%)
2.2.3 各级医疗机构报告情况 经对2019年国家ADR监测系统基层用户注册情况(“未标识级别”为基层用户注册时未勾选医疗机构级别,“其他”为基层用户注册时勾选医疗机构级别)统计分析,在上报ADR报告的医疗机构中,全年共上报8467例,主要以三级和二级医疗机构为主,共上报5998例,占医疗机构报告总数的70.8%,一级及以下医疗机构报告数量相对较低,51.3%的医疗机构存在“0报告”现象。见表2。

表2 2019年各级医疗机构ADR报告情况Tab 2 ADR reports of medical institutions at all levels in 2019
2.3 MAH监测体系建设
对海南省2019年MAH年度报告进行统计分析,76个MAH中,75个已初步建立药物警戒制度。已建立药物警戒专门机构的73个MAH中,37个为独立设置,余为非独立设置。60个MAH通过直报系统上报ADR报告,其中大部分报告源于监管部门反馈,仅有38个MAH通过医疗机构、药品经营企业、学术文献、电话和投诉等途径自主收集上报ADR报告,占报告总数的1.2%。
2.4 全省ADR报告情况
2.4.1 ADR报告单位来源 2015 – 2019年,全省ADR报告数量呈逐年增长趋势,虽然新的和严重ADR报告超过30%,但严重报告占比较低。全省ADR报告的主体为医疗机构,自2018年发布《关于药品上市许可持有人直接报告不良反应事宜的公告》(2018年第66号)[6]起,2018年生产企业报告比例较前几年明显增长。详见表3。
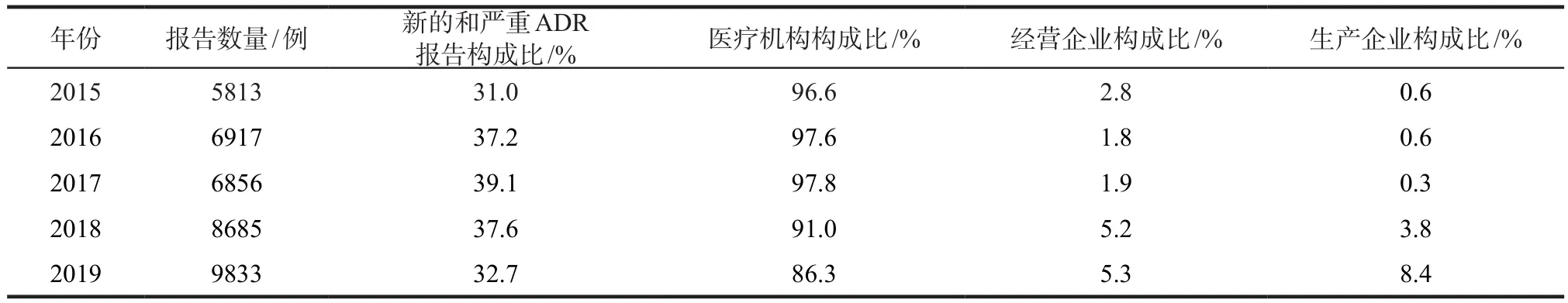
表3 2015 – 2019年海南省ADR报告来源Tab 3 Source of ADR reports in Hainan from 2015 to 2019
2.4.2 ADR报告质量评估 按照《药品不良反应病例报告质量评估指导意见(试行)》[7](以下简称“评估指导意见”)的要求,2017 – 2019年每年对国家ADR监测系统(海南数据)收到的全部报告按照不低于5%的比例进行抽样,依据“评估指导意见”的评分标准对报告的真实性、规范性、完整性三个方面逐项评估。报告的真实性判定主要依靠相似报告查重、患者信息的相似性、ADR过程描述的相似性、预警信号处置等方式对重复报告或虚假报告进行核实;报告的规范性结合报告类型、报告时限(新的和严重的报告在发现或获知15 d内上报)、ADR名称等6大项指标按正确率进行统计打分;报告的完整性结合原患疾病描述、用药情况、ADR发生时间等12项指标按照正确率进行统计打分。详见表4。
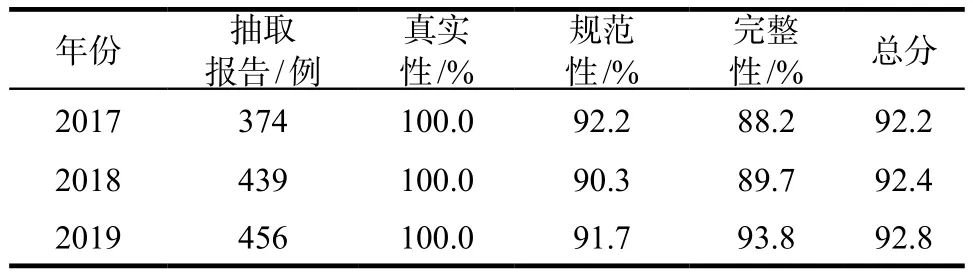
表4 2017 – 2019年ADR报告质量评估情况Tab 4 Quality assessment of ADR reports from 2017 to 2019
3 讨论
3.1 监测机构
全省ADR监测机构不健全,专业化监测队伍缺乏且不稳定。21个ADR监测机构中,非独立的监测机构占比85.7%。海南省ADR监测中心尚未独立,机构不健全,其挂靠于海南省博鳌先行区ADR监测中心,严重制约了我省ADR工作的深入发展。各市县中心大部分挂靠于市场监督管理局,基本每个ADR监测员都是“一人多岗”、“身兼数职”,需兼顾药品监管及ADR监测工作[8]。
3.2 医疗机构
各级医疗机构监测能力参差不齐,全省ADR报告主要来源于二级以上医疗机构,2019年二级及以上医疗机构报告数量占全省医疗机构报告总数的70.8%,一级及以下医疗机构“0报告”现象问题较为突出。由于基层医疗机构对监测工作重视度不够、上报意识不强、主动性不高、无专职人员等,造成ADR报告质量不高,新的和严重ADR报告占比低,且主要存在报告类型判断错误、报告超时限、报告填写不规范、描述混乱、描述不准确等错误。其主要原因是医疗机构对自身在ADR监测中的职责和义务的认识不够[9]。
3.3 上市许可持有人
我省MAH已初步建立药物警戒制度,但警戒体系尚需进一步完善。50.0%以上机构未独立,挂靠于质量保证部、医学注册部等部门。药物警戒负责人部分为兼职人员,ADR直报制度落实不到位,21.0%的MAH仍存在“0报告”现象。医疗机构作为ADR报告的主要机构,39.5%的MAH未畅通与医疗机构的沟通及建立有效的自主收集途径。在欧美国家,药品文号的持有人是申报的主体,FDA的ADR报告90.0%来源于MAH[10]。
4 对策
4.1 加强全省ADR监测机构建设,完善专业化监测队伍
《国家药监局关于进一步加强药品不良反应监测评价体系和能力建设的意见》明确要求:各级ADR监测机构应当根据业务需要配备足量具备监测评价能力的医学、药学、流行病学与卫生统计学等相关专业技术人才[11]。健全的监测机构和高素质的监测评价力量是提升基层ADR监测水平的重要保障[12]。因此,我省应加快健全各级监测体系和监测队伍建设,成立海南省ADR监测中心,完善人员配置,各市县中心配备具有医学、药学相关背景的专职监测人员队伍。
4.2 落实医疗机构职责,提升ADR监测实效
ADR报告数量、质量和报告及时性影响着ADR监测的效率[13]。各级医疗机构应建立长效的监测机制,将ADR监测工作纳入医护人员绩效考核、职称评定、岗位晋升等方式促进监测工作开展;一级医疗机构应注重强化监测人员及医务人员业务培训,夯实基层医疗机构报告基础。二级医疗机构应注重简化上报程序,利用快速上报信息化系统,从而减少ADR上报工作量[14],实现电子病历、药品信息等快速连接,降低二级以上医疗机构ADR漏报、错报率,提高ADR工作效率。三级医疗机构建议开通电子上报途径接口,进一步促进临床药师干预,主动开展药品重点监测和药品上市后安全性再评价,深入开展临床合理用药课题研究。
4.3 落实MAH药品全生命周期管理职责
我国正处于ADR监测体系逐渐向药物警戒体系过渡阶段[15],新修订《药品管理法》中首次明确提出建立药物警戒制度,药物警戒能有效地实现药物风险全过程监控。MAH应从人、机、料、法、环五个维度落实好药物警戒工作:1)成立药物警戒组织机构,配备具有医药学背景的专职人员;2)配备药物警戒系统、MedDRA字典、office软件等基本设备;3)畅通报告收集途径,建立面向医生、药师和患者的有效信息收集途径,主动收集临床使用、临床研究中的不良反应信息,将药物安全性信息纳入产品质量评价综合体系[16];4)依照相关技术指南,落实ADR直报制度,制定相关SOP;5)营造药物警戒和企业文化融合的工作环境,加强人员业务培训,提高人员对药物警戒工作的重视。药物警戒是警戒系统的基石[17],因此,MAH应严格按照《药物警戒质量管理规范》[18]相关要求,开展好药物警戒活动。
各级监测评价机构是监测评价工作“一体两翼”的“一体”,负责信息的收集、分析、报告等。医疗机构和生产企业是监测评价工作的“两翼”,依法承担不良反应、不良事件报告的义务。各级药品监督管理部门要加快构建以ADR监测机构为专业技术机构、MAH和医疗机构依法履行相关责任的“一体两翼”工作格局,促进ADR监测工作更好的服务于我省的医药产业。

