程序性死亡受体1抑制剂卡瑞利珠单抗治疗老年性晚期肺鳞癌1例并文献复习
罗详冲 毛贵兵 王周清
云南省曲靖市第二人民医院心胸外科,云南曲靖655000
肺癌是目前全球范围内发病率和病死率均最高的恶性肿瘤。2019年国家癌症中心数据显示,2015年中国新发肺癌病例及肺癌死亡人数分别约为78.7万例和63.1万例,均居所有恶性肿瘤的首位[1]。2020年美国最新癌症数据显示,自1990年起,截至2017年,男性肺癌患者病死率较高峰时下降了51%,而女性肺癌患者病死率下降了26%[2],这得益于肺癌基因靶向治疗和免疫治疗的进步。随着肺癌一系列致癌驱动基因的确定,携带驱动基因阳性如表皮生长因子受体(epidermal growth factor receptor,EGFR)敏感突变、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合或c-ros癌基因1(c-ros oncogene 1,ROS1)融合等的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC),尤其是肺腺癌(lung adenocarcinoma,LAD)患者,经靶向药物治疗后,预后及生存期得到了明显改善[3-4]。然而针对驱动基因阴性的晚期NSCLC患者既往经典的治疗方案为含铂双药的化疗[5],随着以程序性死亡受体 1(programmed death 1,PD-1)/程序性死亡配体1(programmed death ligand 1,PDL1)和细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)为靶点的免疫抑制剂如派姆单抗(pembrolizumab)、纳武单抗(nivolumab)、阿特珠单抗(atezolizumab)、特瑞普利单抗(toripalimab)、信迪利单抗(sintilimab)、卡瑞利珠单抗(camrelizumab)、替雷利珠单抗(tislelizumab)和伊匹单抗(ipilimumab)等[6-10]应用于肺癌领域并取得惊人的成果,彻底改变了驱动基因阴性的晚期NSCLC一线、二线和后线治疗选择。本文报道1例接受卡瑞利珠单抗一线治疗的老年性晚期肺鳞癌(squamous cell lung cancer,SQCLC)患者,截至投稿时持续有效,且耐受性良好,临床获益明显。
1 病例资料
患者男性,81岁,因“咳嗽、咳痰、气促、吞咽困难5月,加重1周”于2019年12月16日就诊于曲靖市第二人民医院。2019年12月17日行胸部计算机断层扫描(computed tomography,CT),检查提示:右肺门区病灶考虑中央型肺癌并右肺上叶及下叶支气管受侵、右肺下叶阻塞性肺炎并肺不张;病灶包绕右肺下动脉并向纵隔内侵犯食管;肺门及纵隔淋巴结增大;右侧胸膜腔少量积液(图1A)。行腹部CT、脑部核磁共振成像(magnetic resonance imaging,MRI)及全身骨扫描等检查未见转移。行痰液液基细胞学检查(liquid-based cytologic test,LCT)提示:见鳞状细胞癌。因患者高龄,无法耐受纤维支气管镜检查,未行组织学病理确诊。临床诊断为:右肺中央型肺鳞癌cT4N2M1a ⅣA期。采集血浆送基因检测提示:EGFR/ALK/ROS1均为野生型。体力状况评分(physical stamina,PS)为2分。患者拒绝行一线单药化疗。于2019年12月24日行卡瑞利珠单抗(200 mg)单药治疗,主要不良反应是免疫相关不良反应(immune-related adverse events,irAEs)表现为双下肢皮肤1级反应性毛细血管增生症(reactive cutaneous capillary endothelial proliferation,RCCEP),患者咳嗽、咳痰、气促及吞咽困难症状改善。2020年2月2日行胸部CT提示:右肺门病灶较前有缩小,右肺下叶阻塞性肺炎及肺不张较前吸收(图1B),根据实体瘤免疫治疗疗效评价标准(immune response evaluation criteria in solid tumor,iRECIST),疗效评价为疾病稳定(stable disease,SD)。于2020年2月3日行卡瑞利珠单抗(200 mg)单药治疗,主要不良反应为双下肢皮肤1级RCCEP,患者咳嗽、咳痰、气促及吞咽困难症状明显改善。于2020年3月10日行卡瑞利珠单抗(200 mg)单药治疗,患者双下肢皮肤RCCEP发生皱缩、干燥及颜色变黑,无其他不良反应,患者偶感咳嗽、咳痰及气促,进食通畅。2020年5月29日行胸部CT提示:右肺门病灶较前有缩小,右肺下叶阻塞性肺炎及肺不张较前基本吸收(图1C),结合iRECIST,疗效评价为疾病部分缓解(partial response,PR)。于2020年6月1日行卡瑞利珠单抗(200 mg)单药治疗,患者双下肢皮肤RCCEP已消退,未留瘢痕,偶感咳嗽、咳痰及气促,进食通畅。后因患者经济情况未再行治疗。截至2020年12月31日,电话随访观察,患者病情平稳,症状仍持续改善,疾病得到良好控制。
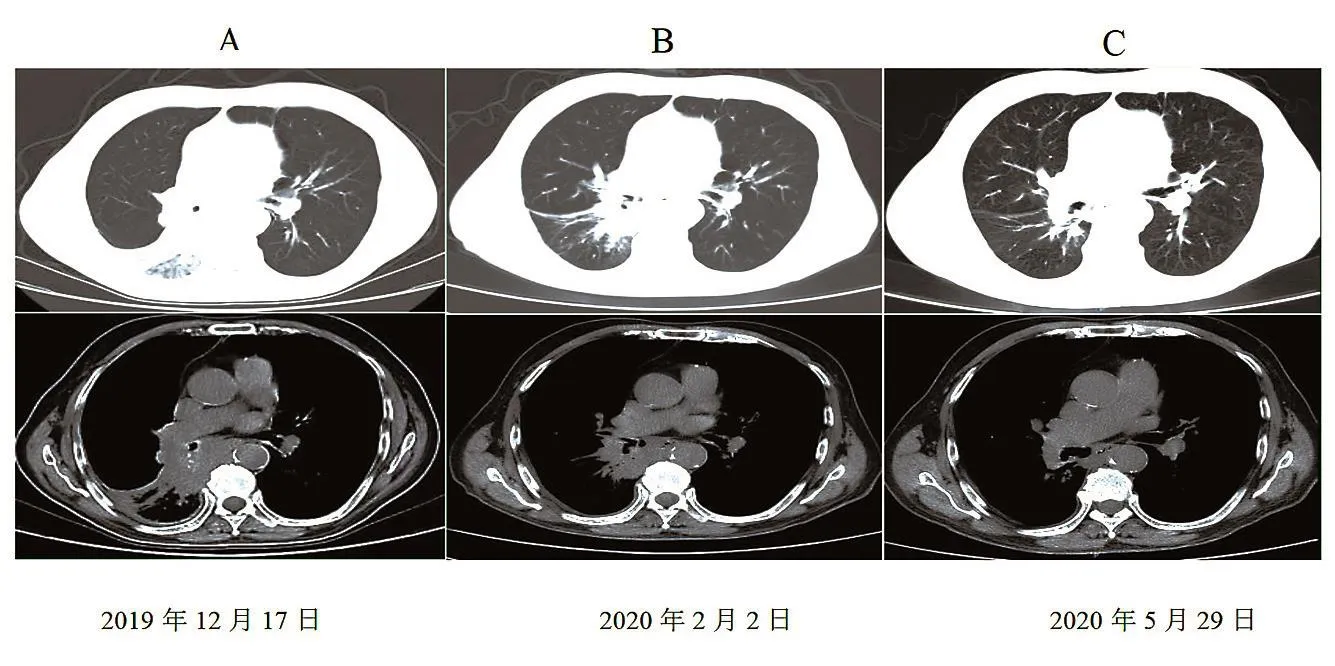
图1 患者治疗期间胸部CT表现
2 讨论
近年来,基因靶向治疗在驱动基因阳性的肺腺癌患者中取得了令人瞩目的成就。然而,由于肺鳞癌的高度异质性及高肿瘤突变负荷(tumor mutation burden,TMB),使得以驱动基因为靶点的治疗在晚期肺鳞癌患者中的探索屡屡失败。既往驱动基因阴性的晚期肺鳞癌的一线治疗仍以吉西他滨联合铂类或紫杉醇联合铂类化疗为首选,但疗效有限。随着免疫治疗的全面崛起,以PD-1抑制剂为首的治疗在晚期肺鳞癌领域中大放异彩,彻底改变了晚期肺鳞癌的一线、二线乃至后线治疗的选择[11]。
KEYNOTE-407[12]是一项多中心、随机、双盲、安慰剂对照的Ⅲ期临床研究,旨在评估帕博利珠单抗或安慰剂联合卡铂和紫杉醇或白蛋白紫杉醇治疗Ⅳ期肺鳞癌患者的疗效和安全性。结果显示,相比于安慰剂联合卡铂和紫杉醇或白蛋白紫杉醇化疗,帕博利珠单抗联合化疗显著提高患者的客观 缓 解 率(objective response rate,ORR)(57.9%vs.38.4%),明显延长患者的中位总生存期(overall survival,OS)(17.1个月vs.11.6个月)和无进展生 存 期(progression free survival,PFS)(8.0 个 月vs.5.1个月)。无论患者的PD-L1表达水平即肿瘤细胞阳性比例分数(tumor proportion score,TPS)如何,均可以从帕博利珠单抗联合卡铂和紫杉醇或白蛋白紫杉醇化疗中获益,且安全可控。基于KEYNOTE-407研究的成功,帕博利珠单抗联合卡铂和紫杉醇获美国食品及药物管理局(Food and Drug Administration,FDA)和国家药品监督管理局(National Medical Products Administration,NMPA)批准用于转移性鳞状NSCLC的一线治疗。至此,免疫治疗为驱动基因阴性的晚期肺鳞癌治疗带来全新的选择。
国内自主研发的PD-1抑制剂在晚期肺鳞癌治疗领域中也取得突破性进展。ORIENT-12研究[13]和BGB-A317-307研究[14]的亮眼数据使信迪利单抗联合化疗和替雷利珠单抗联合化疗成为晚期肺鳞癌治疗的又一利器。2020年ASCO会议上公布MA-NSCLC-Ⅱ-004研究[15],该研究为卡瑞利珠单抗联合阿帕替尼(Apatinib)用于晚期肺鳞癌一线治疗的Ⅱ期临床研究,结果显示,卡瑞利珠单抗联合阿帕替尼治疗晚期肺鳞癌患者疗效佳且安全可控,为肺鳞癌一线治疗的选择提供临床依据。此外,针对卡瑞利珠单抗联合化疗或单药治疗晚期肺鳞癌的临床研究也在相继开展,期待更好的数据。
本组病例为驱动基因阴性的Ⅳ期老年性肺鳞癌患者,PS为2分,拒绝行单药化疗,结合患者耐受性、意愿和经济情况,选择卡瑞利珠单抗单药作为治疗方案。从疗效看,本组病例获得良好的获益,考虑免疫治疗的拖尾效应,患者因经济情况未再行治疗,电话随访仍在进行中,OS尚未达到,患者疾病得到控制,生活质量得到明显改善。从安全性看,患者行4周期卡瑞利珠单抗治疗过程中,最大的副反应为RCCEP,RCCEP是一种主要发生于皮肤的并以真皮层毛细血管增多和毛细血管内皮细胞增生为病理学特征的形态学表现,且呈现出动态变化和自限性表现[16],该患者主要为双下肢皮肤的RCCEP,随着治疗进程的推进而自行消失,安全性可控。
综上所述,免疫治疗为肺癌患者带来了新的曙光,打破了肺鳞癌治疗壁垒,为晚期肺鳞癌患者治疗带来全新选择。与此同时,鉴于肿瘤和肿瘤微环境的高度异质性,免疫治疗仍需进行进一步探索,免疫治疗联合化疗、放疗、抗血管生存药物及双免联合如PD-1/PD-L1联合TIGIT抗体或IL-1β抑制剂已成为目前免疫治疗的新趋势。相信随着越来越多临床研究的深入,中国自主研发的卡瑞利珠单抗及其他免疫检查点抑制剂将为更多肺癌患者带来福音。

