右美托咪定对糖尿病心肌缺血再灌注小鼠肺损伤的保护作用及机制研究
李爱梅,李佳馨,陈思宇,王 江
(新疆医科大学第一附属医院麻醉科,新疆乌鲁木齐 830054)
心肌缺血再灌注损伤多见于心脏溶栓治疗、经皮冠状动脉介入手术、心脏外科等手术治疗,是一种常见的临床并发症[1]。心肌缺血再灌注损伤除直接诱导心肌损伤外,还可引发远端器官损伤,导致功能障碍和病理学损伤,其中肺脏是较易受累器官,而在糖尿病状态下损伤尤为严重[2]。心肌缺血再灌注引起的缺血缺氧可诱发内质网应激(ERS),且糖尿病诱导的低度慢性炎症和低氧微环境可导致内质网腔内异常折叠蛋白的积累,持续的内质网应激引起细胞内环境紊乱,诱导细胞坏死和凋亡,进一步加重组织损伤[3]。沉默信息调节因子2 相关酶1(Sirt1)被认为是一个多功能分子,因为它可以作用于多种活化分子、转录因子和信号分子。在不同原因引起的肺损伤模型中证实Sirt1 可充当一种“保护剂”,在不同类型的急性肺损伤中均发挥着重要作用[4]。右美托咪定(DEX)高选择性作用于α2 肾上腺素能受体,常用于手术麻醉、镇静及镇痛,且不抑制呼吸。DEX 对缺血再灌注相关疾病的保护作用已被广泛研究,研究证实右美托咪定可通过提高Sirt1 减轻糖尿病小鼠脑缺血再灌注损伤[5]。Li 等[6]证实DEX 可通过抑制细胞凋亡减轻糖尿病心肌缺血再灌注损伤。但DEX 对糖尿病心肌缺血再灌注所致远端肺损伤的作用仍未有研究证实。本实验旨在探讨DEX 对糖尿病小鼠心肌缺血再灌注诱发急性肺损伤的可能机制,在临床上为心脏手术患者提供良好的肺保护策略。
1 材料与方法
1.1 动物选择及分组
选 取15 周 龄、体 重55~65 g 的 雄 性dbdb 小 鼠40 只,小鼠血糖≥16.7 mmol/L 并伴随明显多饮、多食、多尿症状。实验动物由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0010。饲养于新疆医科大学SPF 级动物实验室,并给予高糖高脂饮食。本研究获得新疆医科大学第一附属医院动物伦理委员会批准。将实验动物随机分为4 组(n=10):假手术组(S 组)、缺血再灌注组(IR 组)、右美托咪定后处理组(POST-D)、右美托咪定预处理组(PRE-D)。
1.2 心肌缺血再灌注模型的制备
小鼠于实验开始前12 h禁食,不禁饮。腹腔注射阿托品1.2 mg/kg,氯胺酮80 mg/kg,甲苯噻嗪20 mg/kg,麻醉,维持体温36.5~37.5 ℃。麻醉后常规消毒,连接心电图,采集标准Ⅱ导联,气管插管后,连接小动物呼吸机,进行机械通气,潮气量0.6~0.8 mL/min,频率是100~120 次/min;I∶E=2∶1,于左胸部3~4 肋间开胸,腹腔注射肝素钠500 IU/kg 用以维持闭塞后再灌注,剪开心包,暴露左心耳及肺动脉圆锥,用5.0Prolene 线在冠状动脉前降支的起始部穿线备用。除假手术组外,余各组均以橡皮筋垫底,双线结扎冠状动脉前降支,阻断成功致心肌缺血标志为∶心电图ST 段明显上抬,T 波高耸(>0.12 mV),结扎线以下心肌颜色变暗,心肌收缩力降低。阻断30 min 后松开结扎线,恢复血流2 h,再灌注成功的标志位ST 段回落,心前区恢复红色。POST-D 组及PRE-D 组在手术开始之前及复灌时分别腹腔注射50 μg/kg 的DEX(批号:20010631,扬子江药业集团有限公司)。
1.3 肌酸激酶-MB(CK-MB)水平测定
再灌注后收集血标本,离心分离血清,按照说明书使用CK-MB 同工酶测定试剂盒(中国南京建成)测定血清CK-MB 水平。
1.4 光镜下肺组织形态学检查
实验结束后采集每组小鼠的左肺下叶,漂洗后4%多聚甲醛固定,石蜡包埋,组织切片,HE 染色,在光学显微镜200 倍视野下观察各组肺组织病理学变化。
1.5 肺湿干重比(W/D)
实验结束后取左肺上叶,称重,记录湿重,然后在恒温80 ℃烤箱中干燥48 h 脱水,然后再次称重,计算湿重与干重之比。
1.6 血清炎性因子的测定
复灌结束后取小鼠动脉血采用CBA 法检测血清中白介素6(IL-6)、干扰素γ(IFN-γ)、白介素10(IL-10)的水平。
1.7 肺组织氧自由基的测定
取部分左肺组织,制备组织匀浆,4 ℃离心后取上层悬液,硫代巴比妥酸法测定MDA 含量,黄嘌呤氧化酶法测定SOD 活性。
1.8 采用Western blot 法检测肺组织Sirt1、GRP78、CHOP 蛋白表达
取肺组织,研磨,将肺组织匀浆离心,采用BCA法检测上清液蛋白浓度。取蛋白样品,煮沸变性,聚丙烯酰胺凝胶电泳,将蛋白质转膜,5%脱脂奶粉封闭,TBST 漂洗,分别加入一抗Sirt1(1∶500)、GRP78(1∶500)、CHOP(1∶200)和β-actin 抗 体(1∶800)与PVDF 膜孵育,TBST 漂洗后加入二抗,37 ℃下孵育,最后,TBST 洗膜后,加入工作液曝光,显影,采用凝胶分析软件分析,得出蛋白吸光度值。
1.9 统计学处理
采用SPSS 23.0 统计学软件对数据进行分析,计量资料采用均数±标准差(±s)表示,组间比较使用单因素方差分析,以P<0.05 为差异具有统计学意义。
2 结果
2.1 各组小鼠血清CK-MB 水平变化比较(证明心肌缺血再灌注模型制作成功)
与S 组 比 较,IR 组、POST-D 组 及PRE-D 组 小鼠 血 清CK-MB 升 高(P<0.05)。与IR 组 比 较,POST-D 组 及PRE-D 组CK-MB 降 低(P<0.05)。PRE-D 组与POST-D 组CK-MB 变化无统计学差异(P>0.05)。见表1。
表1 各组小鼠血清CK-MB 水平的比较(U/L,n=10,±s)Tab 1 Comparison of serum levels of CK-MB in four groups of mice(U/L,n=10,±s)
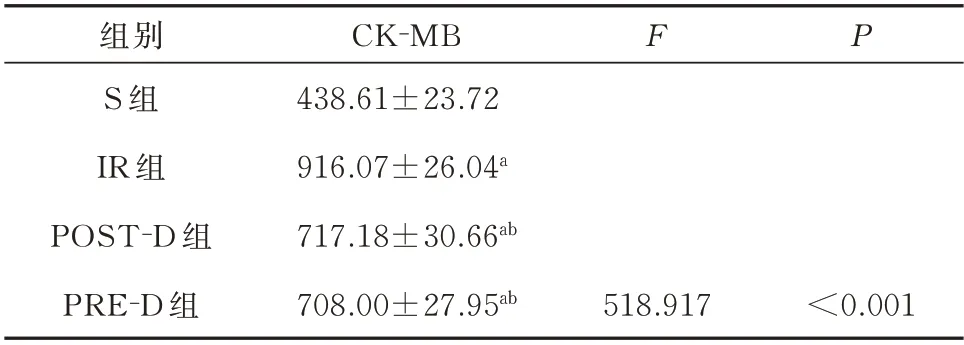
表1 各组小鼠血清CK-MB 水平的比较(U/L,n=10,±s)Tab 1 Comparison of serum levels of CK-MB in four groups of mice(U/L,n=10,±s)
注:与S 组比较,aP<0.05,与IR 组比较,bP<0.05。
组别S 组IR 组POST-D 组PRE-D 组CK-MB 438.61±23.72 916.07±26.04a 717.18±30.66ab 708.00±27.95ab F P<0.001 518.917
2.2 小鼠肺组织病理改变情况比较
S 组小鼠肺组织结构未见明显损伤性改变;IR组肺泡结构破坏严重,肺泡内及肺泡壁可见充血、出血,肺间隔增厚水肿,肺泡腔和间质可见大量红细胞漏出,大量中性粒细胞浸润。POST-D 组及PRE-D 组肺组织损伤程度减轻明显,肺泡及肺间质仅少量中性粒细胞浸润。见图1。

图1 各组糖尿病小鼠肺切片苏木精和伊红染色的代表性显微照片(200×)Fig 1 Representative micrographs of hematoxylin and eosin staining in lung sections of diabetic mice in each group(200×)
2.3 肺组织W/D 比较
与S 组 比 较,IR 组、POST-D 组 及PRE-D 组 小鼠肺组织W/D 增大。与IR 组比较,POST-D 组及PRE-D 组肺组织W/D 降低。与POST-D 组比较,PRE-D 组肺组织W/D 差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠肺组织W/D 的比较(n=5,±s)Tab 2 Comparison of wet-dry weight ratio of lung tissue of mice in each group(n=5,±s)

表2 各组小鼠肺组织W/D 的比较(n=5,±s)Tab 2 Comparison of wet-dry weight ratio of lung tissue of mice in each group(n=5,±s)
注:与S 组比较,aP<0.05;与IR 组比较,bP<0.05;与POST-D组比较,cP<0.05。
组别S 组IR 组POST-D 组PRE-D 组W/D 3.34±0.13 4.85±0.09a 4.41±0.27ab 4.33±0.15ab F- - -P- - -<0.001 68.782
2.4 血清IL-6、IFN-γ、IL-10 水平比较
与S 组 比 较,IR 组、POST-D 组 及PRE-D 组 小鼠血清IL-6、IFN-γ 升高,IL-10 降低(P<0.05)。与IR 组 比 较,POST-D 组 及PRE-D 组IL-6、IFN-γ 降低,IL-10 升 高(P<0.05)。与POST-D 组 比 较,PRE-D 组上述指标变化差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠血清IL-6,IFN-γ 及IL-10 水平的比较(pg/mL,n=10,±s)Tab 3 Comparison of serum levels of IL-6,IFN-γ and IL-10 in four groups of mice(pg/mL,n=10,±s)

表3 各组小鼠血清IL-6,IFN-γ 及IL-10 水平的比较(pg/mL,n=10,±s)Tab 3 Comparison of serum levels of IL-6,IFN-γ and IL-10 in four groups of mice(pg/mL,n=10,±s)
注:与S 组比较,aP<0.05;与IR 组比较,bP<0.05。
组别S 组IR 组POST-D 组PRE-D 组IL-10 377.51±19.88 153.45±16.22a 210.43±11.50ab 209.73±11.05ab 411.488<0.001 FP IL-6 408.81±28.74 805.17±41.25a 679.18±32.47ab 644.80±52.19ab 173.751<0.001 IFN-γ 5.81±0.43 9.25±0.33a 8.63±0.29ab 8.33±0.46ab 156.272<0.001
2.5 肺组织MDA 含量及SOD 活性比较
与S 组 比 较,IR 组、POST-D 组 及PRE-D 组 小鼠肺组织MDA 升高,SOD 活性降低(P<0.05)。与IR 组 比 较,POST-D 组 及PRE-D 组MDA 降 低,SOD 活 性 升 高(P<0.05)。与POST-D 组 比 较,PRE-D 组上述指标变化差异无统计学意义(P>0.05)。见表4。
表4 各组小鼠肺组织MDA 含量及SOD 活性比较(n=10,±s)Tab 4 Comparison of MDA content and SOD activity in lung tissues of four groups of mice(n=10,±s)

表4 各组小鼠肺组织MDA 含量及SOD 活性比较(n=10,±s)Tab 4 Comparison of MDA content and SOD activity in lung tissues of four groups of mice(n=10,±s)
注:与S 组比较,aP<0.05;与IR 组比较,bP<0.05;与POST-D组比较,cP<0.05。
SOD(U/mg)3.52±0.36 1.80±0.25a 2.86±0.23ab 2.90±0.30ab 62.478<0.001组别S 组IR 组POST-D 组PRE-D 组FP MDA(nmol/mg)4.05±0.16 6.92±0.16a 5.91±0.26ab 5.71±0.37ab 222.493<0.001
2.6 肺组织Sirt1、CHOP 及GRP78 表达水平比较
与S 组 比 较,IR 组Sirt1 蛋 白 表 达 下 调(P<0.05),与IR 组比较,POST-D 组 及PRE-D 组Sirt1蛋白表达上调(P<0.05),与POST-D 比较,PRE-D组Sirt1 蛋白表达差异无统计学意义(P>0.05)。
与S 组 比 较,IR 组、POST-D 组 及PRE-D 组CHOP、GRP78 蛋白表达上调(P<0.05),与IR 组比较,POST-D 组及PRE-D 组CHOP、GRP78 蛋白表达下调(P<0.05),与POST-D 组比较,PRE-D 组CHOP、GRP78 蛋白表达差异无统计学意义(P>0.05)。见图2、表5。
表5 各组小鼠肺组织Sirt1、CHOP、GRP78 表达水平的比较(n=10,±s)Tab 5 Comparison of the expression levels of SIRT1,CHOP and GRP78 in lung tissues of four groups of mice(n=10,±s)

表5 各组小鼠肺组织Sirt1、CHOP、GRP78 表达水平的比较(n=10,±s)Tab 5 Comparison of the expression levels of SIRT1,CHOP and GRP78 in lung tissues of four groups of mice(n=10,±s)
注:与S 组比较,aP<0.05;与IR 组比较,bP<0.05。
组别S 组Sirt1 0.562±0.012 GRP78 0.153±0.032 CHOP 0.404±0.076 IR 组0.343±0.072a 0.441±0.026a 0.863±0.116a POST-D 组0.572±0.051b 0.314±0.030ab 0.663±0.053ab PRE-D 组0.623±0.072b 0.272±0.027ab 0.702±0.067ab FP 14.118 50.004 16.364 0.001 0.001<0.001

图2 Western blot 法检测糖尿病小鼠肺组织Sirt1、CHOP、GRP78 蛋白含量Fig 2 Western blot detection of SIRT1,CHOP and GRP78 protein in lung tissues of diabetic mice
3 讨论
糖尿病患者围术期并发症的发生率较非糖尿病患者高出5 倍以上。糖尿病肺的发病机制与高血糖诱导的蛋白质非酶糖化,氧化应激和多醇途径等有关,可加速呼吸功能的下降。糖尿病患者在经历心脏疾病时,很容易出现严重的呼吸功能紊乱[7]。糖尿病心肌缺血再灌注后肺损伤较正常心肌严重,然而其具体机制亟待进一步阐明。本研究以糖尿病小鼠为研究对象,参照文献[8],采用阻断小鼠冠状动脉左前降支30 min 后复灌2 h 的方法,制备心肌缺血再灌注损伤模型。结果显示,与假手术组相比,IR 组和右美托咪啶干预组CK-MB 水平显著升高,而右美托咪啶干预组CK-MB 水平水平较IR 组低。与S 组比较,IR 组肺组织病理损伤严重,肺组织湿干重比值增加,血清IL-6、IFN-γ 升高,IL-10 降低,肺组织MDA 含量升高,SOD 活性降低。不仅提示成功构建了缺血再灌注损伤模型,而且表明右美托咪啶干预能显著降低心肌损伤和肺损伤。
DEX 具有强效和高选择性,并可发挥有效的镇静、镇痛、遗忘和交感神经阻滞作用,广泛应用于危重病人和麻醉病人,并具有最小的心血管效应[9]。既往研究表明右美托咪定可降低脂多糖、缺血再灌注和呼吸机诱导的肺损伤[10,11]。参照预实验结果,本研究选用右美托咪定的剂量为50 μg/kg,与之前研究一致,本研究证实右美托咪定组肺组织病理形态学损伤减轻,肺组织湿干重比值降低,血清IL-6、IFN-γ 降 低,IL-10 升 高,肺 组 织MDA 含 量 降 低,SOD 活性升高,表明右美托咪定预处理及后处理可减轻糖尿病心肌缺血再灌注后肺损伤。
内质网应激被认为参与许多脏器缺血再灌注病理生理过程[12]。众所周知,内质网应激激活多种信号通路,纠正未折叠或错误折叠的蛋白,维持细胞内稳态,统称为未折叠蛋白反应。在生理条件下,内质网的3 个主要传感器PERK、IRE1 和ATF6与GRP78 结合,活性被抑制。然而,在病理条件下,如缺血缺氧,当细胞遭受内质网应激时,不能纠正蛋白质错误折叠和恢复内质网的稳态,大量的错误折叠或未折叠的蛋白质在细胞中积累,GRP78 被激活并与内质网膜相关的传感器蛋白交互作用,进而导致下游凋亡信号通路的激活。CHOP 是一种ERS 特异性核转录因子,可作为内质网相关的促凋亡蛋白。在正常生理条件下,CHOP 表达水平极低,但在ERS 发生时被诱导大量表达,并被转移到细胞核中调控诱导凋亡相关基因的表达[13]。据报道,Tang 等[14]在心肌缺血再灌注后肾损伤模型中证实,心肌缺血再灌注可使肾组织GRP78、CHOP、ATF6 等表达水平增加,而DEX 可显著降低内质网应激,有效保护心肌缺血再灌注后肾损伤。与之描述一致,本研究通过Western blot 检测了肺组织内质网应激标记物GRP78 和CHOP 的蛋白水平。结果显示IR 组GRP78 和CHOP 蛋白表达上调,表明糖尿病心肌缺血再灌注诱导的肺损伤与内质网应激有关。而POST-D 组及PRE-D 组肺组织GRP78和CHOP 表达下调,证明了DEX 对糖尿病小鼠心肌缺血再灌注所致肺损伤的保护机制与抑制内质网应激相关。
Sirt1 是Ⅲ类组蛋白去乙酰化酶,为哺乳动物中第一个被发现Sirtuins 蛋白家族成员,对烟酰胺腺嘌呤二核苷酸依赖。Sirt1 参与了多种病理生理过程,包括抗炎症、DNA 损伤修复、细胞凋亡抑制、抗氧化应激、细胞寿命延长等,Sirt1 与其下游靶点构成了一个复杂的分子网络,通过去乙酰化其下游靶点保护组织免受缺血缺氧损伤[15]。在缺血缺氧条件下,Sirt1 的表达降低,增加了器官对缺血缺氧损伤的易感性,而提高Sirt1 的表达和活性可以发挥保护作用,这在许多组织中得到证实。研究证实Sirt1 可通过调控基因的转录来抵抗氧化应激、炎症以及细胞凋亡,对肺部细胞产生重要的保护效应[16]。另有研究表明DEX 可提高Sirt1 的活性来减轻缺血再灌注损伤[17]。本研究结果显示,IR 组Sirt1 表达下调,证实缺血再灌注可使其活性降低,而POST-D 组及PRE-D 组Sirt1 表达上调,提示DEX 可通过提高Sirt1 活性来发挥对糖尿病心肌缺血再灌注致肺损伤的保护作用。
本研究仍然存在一定的局限性,首先在肺损伤方面单纯使用病理结果来反映形态学损伤,未使用透射电镜来进一步反映肺损伤情况,内质网应激标志物方面只采用WesternBlot 检测了GRP78 及CHOP 两个标志蛋白,而其他通路上的内质网应激标志物尚未检测完全,且未使用PCR 法在mRNA水平反映蛋白的基因学表达,最后也没有采用内质网应激诱导剂及抑制剂来判定内质网应激是否是右美托咪定发挥保护作用的唯一途径。下一步工作将模拟临床上肺损伤模型,开展大动物实验,并且通过高通量测序或者利用生信分析完善Sirt1 信号通路上下游,为下一步调控Sirt1 信号通路提供依据,为后期深入糖尿病肺保护研究奠定实验基础。
综上所述,右美托咪定可减轻糖尿病小鼠心肌缺血再灌注诱导的急性肺损伤,其机制可能与激活Sirt1,抑制内质网应激相关。
作者贡献度说明:
李爱梅:实验、数据分析、文章撰写;李佳馨、陈思宇:数据收集;王江:文章修改校对。

