MCM-41-IL-4 对RAW 264.7 巨噬细胞的免疫调节作用研究
彭培轩,张一迪,孙晓琳,周延民
(1.吉林大学口腔医院种植科,吉林长春 130021;2.吉林省牙发育及颌骨重塑与再生重点实验室,吉林长春 130021)
骨缺损一直是临床治疗的难题,引导骨组织再生术(guided bone regeneration,GBR)是治疗骨缺损的重要术式。然而,对很多患者而言,由于侵入性的手术方式、功能损伤和移植物不太满意,GBR并不是理想的选择。此外,持续的慢性炎症是GBR后骨组织再生的主要障碍。因此,亟待开发具有炎症调节作用的骨替代品[1]。
具有免疫调节特性的生物材料对组织工程的快速发展起着重要的作用。在各种免疫细胞中,巨噬细胞在免疫防御过程中的作用至关重要,其极化状态与伤口愈合过程密切相关。巨噬细胞具有可塑性和多样性,它有两种不同的亚型:M1 型(“经典激活”)巨噬细胞可引起急性炎症和组织损伤。 M2型(“交替激活”)巨噬细胞可消除炎症并参与组织重塑[2,3]。据报道[4],白细胞介素4(interleukin 4 ,IL-4)介导的免疫调节可以通过M1 和M2 巨噬细胞的转化,显著增强支架介导的成骨和血管生成。
介孔二氧化硅纳米颗粒(mesoporous silica nanoparticles,MSN)自20 世纪问世以来[5],受到越来越多的关注。在用于载药的各种纳米颗粒中,MSN 具有独特的介孔结构、较大的表面积、良好的生物相容性、优异的化学稳定性和强大的靶向/控释能力[6]。高表面硅烷醇基团与其他官能团(如胺,羧酸盐,硫醇和芳环等)共价共轭[5,7]。 据报道[8],它精确的框架结构和良好的孔性可以改善所负载蛋白质的稳定性。
有文献报道,IL-4 负载的XL-MSN 在体内介导M2 巨噬细胞的极化[1]。IL-4 中的氨基可以与MSN上的硅烷醇基形成共价共轭,从而改善IL-4 的时空释放和局部效应。MCM-41 是一种孔径较小、合成方法简便的MSN。但是,IL-4 负载的MCM-41 对巨噬细胞的体外调节作用尚不清楚。 因此,本研究合成并表征了MCM-41 型介孔二氧化硅,并对其负载了IL-4,研究了IL-4 负载的MCM-41 对巨噬细胞的影响。此外,本研究还评估了MCM-41/RAW 264.7 和MCM-41-IL-4/RAW 264.7 条件培养基对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的成血管作用。
1 材料与方法
1.1 材料
十六烷基三甲基溴化铵(CTAB)、硅酸四乙酯(TEOS)、均三甲苯(Sigma,美国),氢氧化钠、盐酸(阿拉丁,中国),无水乙醇(北京化工厂),IL-4(Peprotech,美国),DMEM 培养基(Hyclone,美国),RPMI 1640 培养基(Gibico,美国),胎牛血清(Gibico,美国),CCK-8 试剂盒(新赛美生物,中国),Calcein-AM/PI 双染试剂盒(同人化学,日本),FITC 鬼笔环肽(翊圣生物,中国),DAPI(索莱宝,中国),RNAiso Plus、反转录试剂盒、TB Green qPCR Super Mixture 试剂盒(Takara,日本),多功能酶标仪(Thermo,美国),ABI 7300(ABI,美国)。
1.2 MCM-41 的制备
将1.0 g 的CTAB 和3.5 mL 的2.0 mol/L NaOH 溶解在480 mL 的水中,并在80 ℃下剧烈搅拌2 h,然后向溶液中加入7.0 mL 均三甲苯。 随后向溶液中滴加5.0 mL TEOS,在80 ℃下剧烈搅拌2 h。离心后得到沉淀物,用乙醇洗涤后在60 ℃下干燥。为除去CTAB 和均三甲苯,将1.0 g 制备的材料加入200 mL 乙酸乙醇溶液中,并在50 ℃下搅拌48 h。每个步骤在相同的受控条件下重复多次。
1.3 MCM-41-IL-4 的制备
将5 μg IL-4 溶 于400 μL 去 离 子 水 中,然 后 将10 mg MSNs 在冰上超声分散于溶液中。将溶液离心得到的沉淀用去离子水洗涤几次,冷冻干燥。
1.4 MCM-41 和MCM-41--IL-4 的 表 征
使用在200 kV 加速电压下运行的JEM-2200FS 透射电子显微镜(TEM)获取样品的TEM图像。使用S-4800 扫描电子显微镜(SEM)获得样品的SEM 图像。通过EDAX Genesis 2000X 射线能谱仪进行元素分析。使用RINT2000X 射线衍射仪对样品进行结构分析。氮气吸附-脱附曲线由Micromeritics ASAP 2020 Plus 比表面积/孔隙分析仪记录。使用Brunauer-Emmett-Teller(BET)算法和Barrett-Joyner-Halenda(BJH)模型在相对压力(P/P0)范围为0.05-0.30 的范围内计算材料的比表面积,孔体积和孔径。
1.5 细胞培养
鼠源巨噬细胞系RAW 264.7 细胞购自中国上海的赛百慷生物技术股份有限公司。RAW 264.7细胞在含有10% FBS 的DMEM 培养基中培养。HUVECs 是从吉林省牙齿发育与骨重塑重点实验室获得。HUVEC 在含10% FBS 的RPMI 1640 培养基中培养。两种细胞在37 ℃、5% CO2的恒温培养箱中培养,当细胞铺满培养瓶底部80%时进行传代。
1.6 细胞活性检测
将RAW 264.7 细胞接种到96 孔板中,孵育24 h后将培养液替换为浓度为25、50、100、200、400 μg/mL的MCM-41 和MCM-41-IL-4。孵育2 d 后,每孔加入10 μL CCK-8 溶液,在37 ℃下孵育2 h,用酶标仪在450 nm 处测量吸光度。用不含纳米颗粒的培养基作为对照。为了进一步评估用MCM-41 和MCM-41-IL-4 培养基培养的RAW 264.7 细胞的活力,将RAW 264.7细胞接种到24孔板中,并在37 ℃下孵育24 h 后将培养液替换为浓度为200 μg/mL 的MCM-41 和MCM-41-IL-4 培养1 d,用Calcein-AM/PI 双染试剂盒检测活细胞和死细胞。
1.7 细胞形态检测
将RAW 264.7 接种在24 孔板中,在浓度为200 μ g/mL 的MCM-41 和MCM-41-IL-4 中 培 养24 h。细胞用4%多聚甲醛固定30 min,并用PBS洗涤3 次。用FITC-鬼笔环肽对固定细胞的肌动蛋白染色30 min,加入DAPI 对细胞核进行染色15 min,在荧光显微镜下观察细胞的形态。
1.8 基因表达分析
将RAW 264.7 细胞接种在6 孔板中,在200 μ g/mL MCM-41 和 MCM-41-IL-4 中 培 养24 h。用RNAiso Plus 提取总RNA,根据试剂盒说明 逆 转 录 成 cDNA。 将 2 μ L cDNA、8 μ L ddH2O、1 μ L 前引物F、1 μL 后引物R、12.5 μL TB Green、0.5 μL ROX 混合后,以95 ℃×30 s;95 ℃×5 s→60 ℃×34 s(40 个循环);95 ℃×15 s→60 ℃×60 s→95 ℃×15 s 进 行 扩 增,运 用2-ΔΔCt法 计 算 基 因表达量。将RAW 264.7 细胞在200 μg/mL MCM-41 和MCM-41-IL-4 培养2 d 后,收集上清液,并与含有10% FBS 的RPMI 1640 培 养 液1∶1 混 合 作 为 条件培养基,培养HUVECs 3 d。检测MMP9 和VEGF 途径相关因子PDGFRα和血小板衍生生长因子受体-β(PDGFRβ)基因的mRNA 水平。
1.9 统计学处理
实验数据采用统计学软件Graphpad prism 9.0进行分析处理。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),以P<0.05 表示差异具有统计学意义。
2 结果
2.1 MCM-41 和MCM-41-IL-4 的表征
TEM 图像清楚地显示MCM-41 的介孔通道和典型六边形孔隙(图1A),并且粒径分布均匀(图1B)。负载IL-4 后,介孔通道被填充并变的无序(图1C、1D)。 MCM-41 和MCM-41-IL-4 的粒径分布如图2 所示。 MCM-41 和MCM-41-IL-4 的平均直径 分 别 为(99.822±26.923) nm 和(109.587±24.942)nm。SEM 图像显示MCM-41 呈球形或椭圆形,见图3。 MCM-41-IL-4 比MCM-41 的表面更粗糙(图3A、3B)并且具有一定的黏性(图3C、3D)。MSN 的SAXRD 图谱显示出一个强峰和两个弱峰,进一步证明合成的MSN 具有六方介孔结构,见图4A。MCM-41 的等温曲线为典型Ⅳ型吸附脱附曲线(图4B),提示样品具有中孔结构。 通过B E T 算法和B JH 模型,计算M C M-41 的比表面积、孔容积和孔径分别为1 037.949 7 m²/g,1.626 754 m2/g,6.269 1 nm,证明样品具有良好的载药能力。EDX 元素分析显示出Si,O 和C 元素的特征峰,见图4C。经计算,Si 占该材料重量的55.14%,O 占该材料重量的44.86%,证明了合成的介孔二氧化硅纳米粒子具有较好的纯度。

图1 MCM-41 和MCM-41-IL-4 的透射电镜图(A、C:105×;B、D:25 000×)Fig 1 TEM images of MCM-41 and MCM-41-IL-4(A,C:105×;B,D:25 000×)

图2 MCM-41 和MCM-41-IL-4 的粒径分布图Fig 2 Size distribution of MCM-41 and MCM-41-IL-4

图3 MCM-41 和MCM-41-IL-4 的扫描电镜图(A、B:4 000×;C、D:1 000×)Fig 3 SEM images of MCM-41 and MCM-41-IL-4(A,B:4 000×;C,D:1 000×)
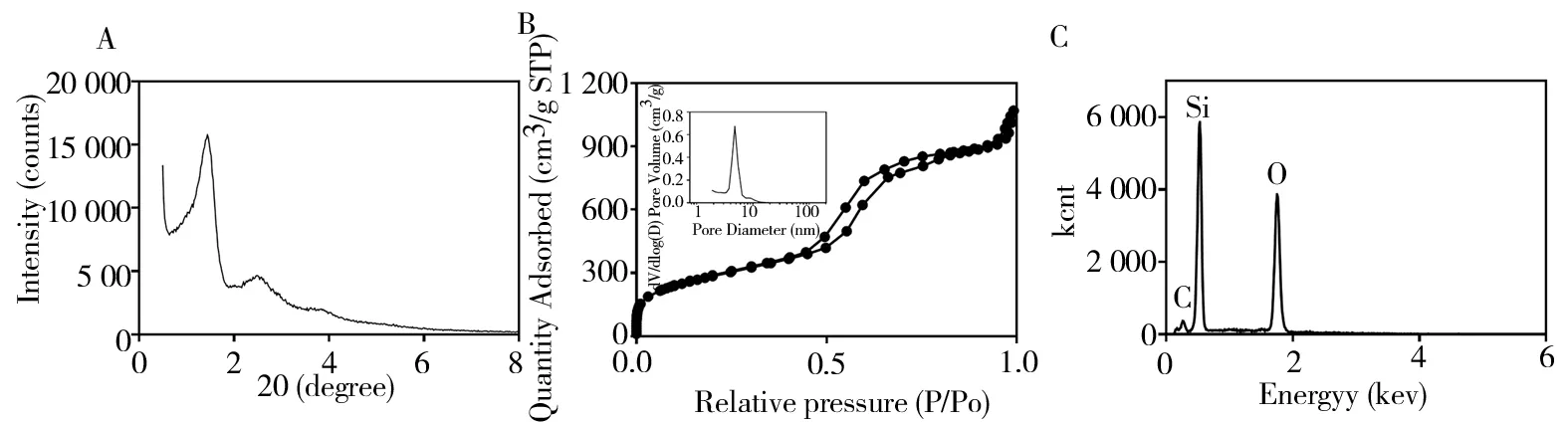
图4 MCM-41 的表征Fig 4 Characterization of MCM-41. A:EDX analysis;B:XRD analysis C:the nitrogen adsorption and desorption curve(inset is pore size distribution)of MCM-41
2.2 RAW 264.7 细胞细胞活性检测
通过CCK-8 对细胞活性进行检测,在不同浓度的MCM-41 和MCM-41-IL-4 中 培 养RAW 264.7 细胞48 h 后,细胞活性分析见表1,各组细胞存活率均大于80%,表明MCM-41 和MCM-41-IL-4 没有细胞毒性。其中12.5、25、50、400 μg/mL MCM-41-IL-4 组的细胞存活率显著高于空白对照组,说明MCM-41-IL-4 具备促进RAW 264.7 细胞增殖的能力。通过对RAW 264.7 细胞进行死活染色,Calcein-AM 染 色 后 显 示F-actin 纤 维 红 色 荧 光,DAPI 染色后显示细胞核为蓝色荧光,免疫荧光照片如图5,MCM-41 组、MCM-41-IL-4 组和对照组活细胞均占有很大比例,仅有极少量死细胞,证明所合材料有较好的生物安全性。
表1 RAW 264.7 的细胞活性水平(n=3,±s)Tab 1 Cell vitality of RAW 264.7 cells(n=3,±s)

表1 RAW 264.7 的细胞活性水平(n=3,±s)Tab 1 Cell vitality of RAW 264.7 cells(n=3,±s)
组别0 μg/mL MCM-41细胞存活率(%)100.00±13.23组别0 μg/mL MCM-41-IL-4 12.5 μg/mL MCM-41 102.50±9.20 12.5 μg/mL MCM-41-IL-4细胞存活率(%)100.00±14.93 128.67±13.05*25 μg/mL MCM-41 94.00±7.81 25 μg/mL MCM-41-IL-4 142.00±4.24**50 μg/mL MCM-41 85.00±21.07 50 μg/mL MCM-41-IL-4 130.50±13.44*100 μg/mL MCM-41 93.00±18.52 100 μg/mL MCM-41-IL-4 101.50±12.02 200 μg/mL MCM-41 111.00±2.83 200 μg/mL MCM-41-IL-4 95.00±7.07 400 μg/mL MCM-41 106.33±13.87 400 μg/mL MCM-41-IL-4 132.50±6.36*FP 0.98 5.902 0.482 6 F P 0.009 5

图5 RAW 264.7 细胞的死活染色图片(12×)Fig 5 Representative images of live-dead cell staining of RAW 264.7 cells(12×)
2.3 RAW 264.7 细胞细胞形态检测
FITC 标记的鬼笔环肽染色后显示细胞纤维状肌动蛋白(F-actin)为绿色荧光,DAPI 染色后显示细胞核为蓝色荧光,肌动蛋白丝发生解聚或重排,F-actin 的荧光强度会发生改变。免疫荧光照片如 图6 所 示,MCM-41-IL-4 组 的RAW 264.7 细胞相比于MCM-41 组和对照组F-actin 荧光强度增 强;200 μg/mL MSNs-IL-4 处 理 的RAW 264.7细胞相比与100 μg/mL MSNs-IL-4F-actin 荧光强度增强,提示MCM-41-IL-4 可以促进细胞骨架微丝结构重排、聚合发生改建。见图6。

图6 RAW264.7 细胞的FITC-鬼笔环肽-DAPI 染色的照片(70×)Fig 6 Representative fluorescence image of FITC-Phalloidin-DAPI staining of RAW 264.7 cells(70×)
2.4 RAW 264.7 细胞基因表达分析
qRT-PCR 结果表明,与对照组相比,MCM-41-IL-4 处理组的TGF-β、Arg-1,血管内皮生长因子-A(VEGF-A),碱性磷酸酶(ALP)mRNA 表达水平升高;与MCM-41 处理组相比,MCM-41-IL-4 处理组的IL-1ra、Arg-1、ALPmRNA 表达水平升高,IL-6的mRNA 表达水平降低;白细胞介素10(IL-10)表达水平在各组间无明显差异。 因此,MCM-41-IL-4可以升高RAW 264.7 细胞M2 型相关基因TGF-β、IL-1ra、Arg-1的 表 达,降 低M1 型 相 关 基 因IL-6的表达,见表2。
表2 MCM-41 和MCM-41-IL-4 刺激RAW 264.7 细胞1 d 后炎症因子的mRNA 水平(n=3,±s)Tab 2 The relative mRNA levels of inflammatory factors of RAW 264.7 cells after treated by MCM-41 and MCM-41-IL-4 for 1 d(n=3,±s)

表2 MCM-41 和MCM-41-IL-4 刺激RAW 264.7 细胞1 d 后炎症因子的mRNA 水平(n=3,±s)Tab 2 The relative mRNA levels of inflammatory factors of RAW 264.7 cells after treated by MCM-41 and MCM-41-IL-4 for 1 d(n=3,±s)
注:与Control 组比较,*P<0.05,**P<0.01,***P<0.001;与MCM-41 组比较,##P<0.01,###P<0.001。
mRNA Control 200 μg/mL MCM-41 200 μg/mL MCM-41-IL-4 F P TGF-β 1.08±0.48 3.76±1.45*5.15±0.91**12.180 0.007 7 IL-1ra 1.00±0.14 0.65±0.01*1.04±0.16##9.530 0.013 7 Arg-1 IL-10 IL-6 VEGF-A ALP 1.00±0.11 1.02±0.25 1.00±0.05 1.00±0.02 1.00±0.08 0.88±0.16 0.77±0.20 1.62±0.09***3.58±0.32***0.72±0.10**2.70±0.70***###<0.000 1 0.247 4<0.000 1 0.000 6<0.000 1 1.21±0.38 0.96±0.09###2.54±0.60**3.08±0.10***###44.720 1.779 154.500 32.750 582.700
2.5 HUVECs 的基因表达分析
为研究MCM-41 和MCM-41-IL-4 通过免疫调节的血管生成作用,检测了HUVECs 中血管生成因子和VEGF 通路相关因子的表达。MCM-41/RAW 264.7 条件培养基刺激可提高HUVECs 血管生成相关因子MMP9 和VEGF 通路相关因子PDGFRα 的表达水平。MCM-41-IL-4/RAW 264.7条件培养基刺激也可提高HUVECs 的MMP9 表达水平,见表3。
表3 MCM-41/RAW 264.7 和MCM-41-IL-4/RAW 264.7 条件培养基处理2 d 后HUVECs 的血管生成相关因子和VEGF 通路相关因子的mRNA 表达水平(n=3,±s)Tab 3 Angiogenetic factor and VEGF pathway-related factors mRNA level of HUVECs treated with MCM-41/RAW 264.7-conditioned medium and MCM-4-IL-41/RAW 264.7-conditioned medium for 2 d(n=3,±s)

表3 MCM-41/RAW 264.7 和MCM-41-IL-4/RAW 264.7 条件培养基处理2 d 后HUVECs 的血管生成相关因子和VEGF 通路相关因子的mRNA 表达水平(n=3,±s)Tab 3 Angiogenetic factor and VEGF pathway-related factors mRNA level of HUVECs treated with MCM-41/RAW 264.7-conditioned medium and MCM-4-IL-41/RAW 264.7-conditioned medium for 2 d(n=3,±s)
注:与Control 组比较,*P<0.05,***P<0.001;与MCM-41/RAW 264.7 组比较,###P<0.001。
组别Control MCM-41/RAW 264.7 MCM-41-IL-4/RAW 264.7 F P MMP9 1.01±0.18 4.28±0.54***1.34±0.57###44.93 PDGFRα 1.00±0.10 1.89±0.44*1.44±0.32 5.893 PDGFRβ 1.06±0.40 0.77±0.40 1.93±0.91 2.902 0.000 2 0.038 4 0.131 4
3 讨论
炎症在骨损伤修复和再生中具有重要的作用[4,9],且宿主对于骨替代材料的免疫反应受到越来越多关注[10,11]。这些研究主要集中在探索影响巨噬细胞的材料的表面修饰,如表面形貌、孔隙率和离子释放[11-16]。然而受到复杂的生物环境的影响,材料特性不能准确地调节材料-宿主反应。IL-4 是经典的诱导M2 型巨噬细胞极化的细胞因子。 据报道[4],适量的IL-4 可以产生最理想的M1/M2 巨噬细胞转化,从而产生有利于组织愈合的微环境。
孔径和孔体积对于MSN 的药物释放速率和载药量起重要作用[5]。据报道[17],介孔二氧化硅纳米颗粒扩大的孔径提高了药物递送的速率。由于其较高的包封率,更大孔径的介孔纳米材料每单位表面积具有更高的载药量和释放速率。通过CTAB模板法,制备典型的MSN 孔径小于3 nm,适用于小分子药物的应用,但无法负载大分子(例如DNA,RNA 和蛋白质)[5]。因此,本研究采用了改进的方法[8],通过向CTAB 模板中添加大量扩孔剂(均三甲苯)来制备具有较大的孔径(6 nm)和体积(1.63 cm3/g)的MSN,即可以负载高分子量蛋白质的MCM-41 型MSNs。
本研究结果表明,MCM-41-IL-4 可以刺激RAW 264.7 细胞的增殖,促进细胞骨架微丝结构重排、聚合发生改建;MCM-41-IL-4 可以升高RAW 264.7 细胞M2 型相 关基因TGF-β、IL-1ra、Arg-1的表达,降低M1 型相关基因IL-6的表达;MCM-41-IL-4/RAW 264.7 条件培养可以促进HUVECs的血管生成相关因子MMP9的表达。因此,MCM-41-IL-4 可以促进RAW 264.7 巨噬细胞的增殖,细胞骨架改建,以及M2 型极化,从而产生有利于组织再生的免疫微环境。
作者贡献度说明:
彭培轩:实验设计,实验完成,数据处理,论文写作;张一迪:死活细胞染色、免疫荧光实验指导,论文修改;孙晓琳:论文修改;周延民:论文修改。

