miR-34a蛋白在子宫内膜癌细胞中的表达及其对癌细胞增殖凋亡机制的影响
张碧艳 杨苗 金晓峰
子宫内膜癌作为高发性、病因未明性妇科恶性肿瘤,多见于围绝经期、绝经后妇女,伴阴道排液、腹部包块、出血及疼痛等临床表现。流行病学调查显示,随着社会快速发展,人们经济条件改善,生活方式改变,子宫内膜癌患病率逐年增高,对女性生命健康存在严重危害[1]。目前,临床针对子宫内膜癌形成、进展机制仍未阐明,但随着分子生物学、基因组织学深入研究发现,miRNA 存在抑癌基因、调控癌基因作用,于子宫内膜癌细胞组织内表达异常,能对癌细胞增殖、凋亡进行调控[2]。而miR-34a 作为miRNA 家族重要成员,与多种肿瘤的细胞增殖、迁移相关,参与肿瘤细胞发育、增殖、分化及凋亡过程[3]。本研究对miR-34a 在子宫内膜癌细胞组织中的表达进行分析,探讨其对子宫内膜癌细胞增殖和凋亡的影响。
1 资料与方法
1.1 材料 选择2018 年4 月至2020 年3 月本院手术切除获得的子宫内膜癌组织标本30 例、癌旁子宫内膜组织标本30 例,均由病理科医师通过严格的病理实验鉴定、确诊。患者于术前均未行全身治疗,手术切除组织样本后立即置入液氮环境下冻存。本研究经本院伦理委员会审批,患者知情并签署同意书。
1.2 方法(1)细胞培养、转染 ①细胞培养:经RPMI 1640 培养基(内含10%胎牛血清)开展人子宫内膜癌细胞Ishikawa 培养,在37 ℃的二氧化碳(浓度5%)培养箱内培养,每间隔2 d 对培养基进行更换,若细胞汇合>80%开展传代培养。②细胞转染:于转染前1 d,将Ishikawa 细胞准确接种在6 孔板内,选择无抗生素的无菌培养基实施细胞培养;在细胞密度显示为70%~80%情况下,依据Lipofectamine 2000 试剂盒的说明书实施细胞转染操作,转染6 h 后将6 孔板中培养基取出,并加入RPMI 1640 培养基,内含10%胎牛血清。再于37℃的二氧化碳(浓度5%)培养箱内正常培养。(2)荧光定量PCR 法检测miR-34a 表达 对总RNA 进行提取,经荧光定量PCR 法检测子宫内膜癌细胞组织、癌旁细胞组织内miR-34a 表达,严格按说明书实施操作。(3)MTT 法检测子宫内膜癌细胞增殖能力 经MTT法(四唑盐比色法)对细胞活力进行检测,即选择转染后人子宫内膜癌的Ishikawa 细胞,经0.25%胰酶开展消化离心处理,将5×103个细胞准确接种在96 孔板内,设定每孔为200l,于37℃的二氧化碳(浓度5%)培养箱内行3~4 h 培养,后于每孔内加入DMSO(150l),充分振荡5~10 min,使晶体充分溶解,并在酶标仪的490 nm 处对光密度进行测定,绘制MTT 检测曲线图。(4)基因分析 经生物信息学技术对miR-34a 和Notch1-3'UTR 间产生的碱基互补关系进行在线预测;并经点突变对Notch1-3'UTR 的3'UTR MUT(突变型载体)实施构建,再将miR-34a mimics、miR-34a 对照物miRNC、Notch1-3'UTR MUT(突变型载体)及MT(野生型载体)分别转染进Ishikawa 细胞。转染48h 后对细胞进行收集,并依据双荧光素酶报告基因测定试剂盒说明书实施操作,对细胞内萤火虫的荧光素酶、海肾荧光素酶相关活性进行检测。(5)流式细胞仪测定子宫内膜癌细胞凋亡 即选择转染后人子宫内膜癌的Ishikawa 细胞,取0.25%胰酶开展消化离心处理,于37℃的二氧化碳(浓度5%)培养箱内培养,行12h 细胞同步化处理后,将原培养液更换,并开展相应处理,在24h 后对细胞进行收集,行离心洗涤处理后,依据试剂盒说明书将流式缓冲液重悬细胞加入,并加入Annexin Ⅴ-TITC(5l)混匀,于4℃避光环境下孵育20~30 min,后加入PI 染液(5l),再孵育5 min,经流式细胞仪测定细胞凋亡情况,激发波长为488 nm,设定发射波长为530 nm,补偿调节荧光后设置十字门。将Q2+Q4 区域细胞比值代表细胞凋亡率。(6)Western-blot 法测定蛋白表达 对转染后人子宫内膜癌Ishikawa 细胞进行培养,处理后将蛋白裂解液加入并对细胞蛋白样品进行收集,定量后将等量蛋白样品开展SDS-PAGE 电泳分离及转膜处理,经5%脱脂奶粉行60 min 封闭,并加入稀释一抗,于室温下孵育60 min,再经PBS 溶液洗涤,后加入适量化学发光液进行显色处理,对成像进行拍照,并经相应软件分析灰度值。
1.3 统计学方法 采用SPSS 20.0 统计软件。计量资料以()表示,用t检验;计数资料以n(%)表示,以χ2校验,P<0.05 为差异有统计学意义。
2 结果
2.1 子宫内膜癌细胞组织内miR-34a 表达 经荧光定量PCR 分析发现,子宫内膜癌细胞组织内miR-34a 表达量明显低于癌旁组织,差异有统计学意义(P<0.05)。见图1。
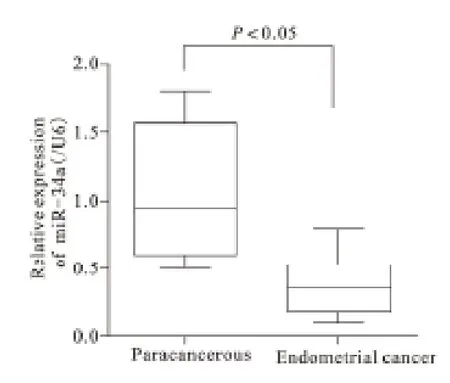
图1 癌旁组织和子宫内膜癌细胞组织内miR-34a
2.2 miR-34a 靶基因测定结果 经生物信息学技术对miR-34a 和Notch1-3'UTR 间产生的碱基互补关系进行在线预测结果,见图2。基因分析发现,相较于miRNC 和WT 共 转 染,miR-34a mimics 和Notch1-3'UTR WT 共转染的荧光强度显著降低,差异有统计学意义(P<0.05);但miR-34a mimics 和Notch1-3'UTR MUT 共转染荧光强度,与miR-NC 和MUT 共转染荧光强度对比,差异无统计学意义(P>0.05),见图3。
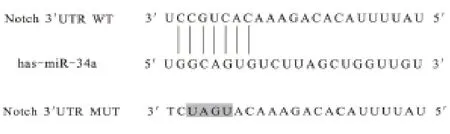
图2 靶基因的生物信息学技术在线预测结果
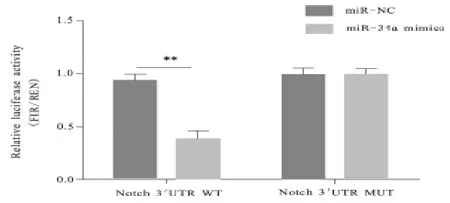
图3 双荧光素酶报告基因测定miR-34a靶基因结果
2.3 细胞活力 经MTT 法分析,与miR-NC组比较,miR-34a mimics组细胞培养1 d、2 d、3 d 后活力明显下降,差异有统计学意义(P<0.05);与miR-34a mimics组比较,miR-34a mimics 联合Notch1组的细胞活力明显增加,差异有统计学意义(P<0.05),见图4。
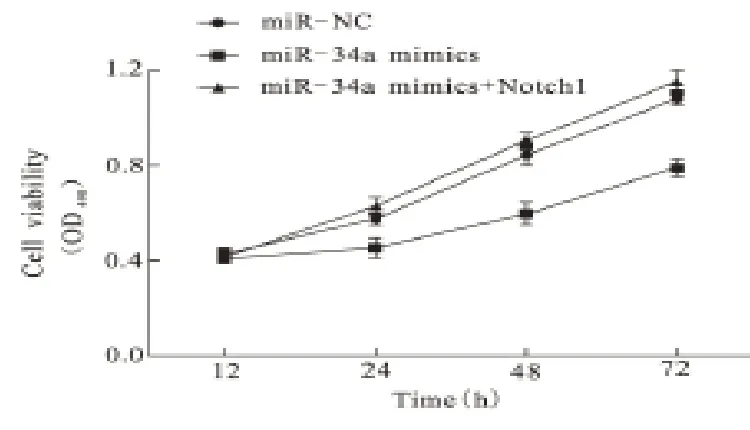
图4 miR-34a干扰子宫内膜癌Ishikawa细胞活力结果
2.4 子宫内膜癌细胞凋亡结果 经流式细胞术分析发现,相较于miR-NC组,miR-34a mimics组的细胞凋亡率明显增加,差异有统计学意义(P<0.05);相较于miR-34a mimics组,miR-34a mimics 联合Notch1组的细胞凋亡率明显下降,差异有统计学意义(P<0.05),见图5。
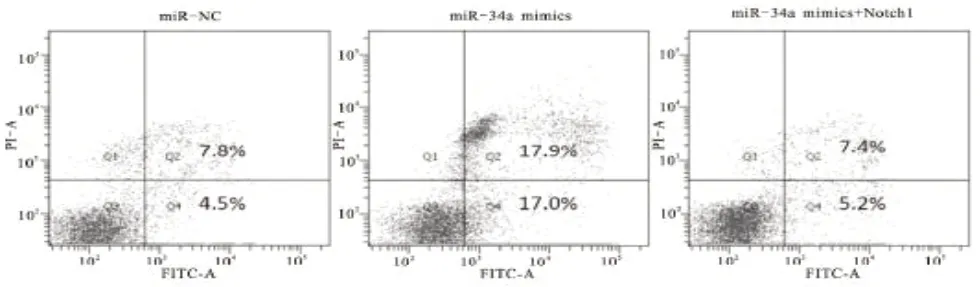
图5 miR-34a 干扰子宫内膜癌Ishikawa细胞凋亡结果
2.5 Ishikawa细胞内Notch1表达 经Western-blot法分析发现,与miR-NC组比较,miR-34a mimics组Ishikawa细胞内Notch1 表达明显下降,但PARP 降解产物表达明显增加,差异有统计学意义(P<0.05);与miR-34a mimics组比较,miR-34a mimics 联合Notch1组Ishikawa细胞内Notch1 表达明显升高,但PARP 降解产物表达明显下降,差异有统计学意义(P<0.05);见图6。
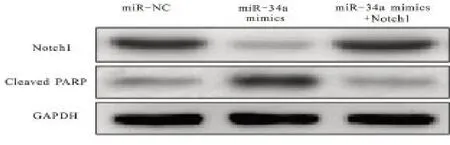
图6 miR-34a影响子宫内膜癌Ishikawa细胞内Notch1表达结果
3 讨论
近年来,随着子宫内膜癌致癌机制的深入探索,以及分子生物学研究的发展,针对子宫内膜癌早期诊断、分型、治疗、预后等的认知不断进步。其中,各种细胞蛋白、信号转导通路异常及基因突变已被证实与子宫内膜癌的形成、发展密切相关。与此同时,子宫内膜癌的形成和发展是由多种信号转导通路及基因异常相互作用,从而形成的一个复杂连锁的基因蛋白反应过程。miR-34a 作为高度保守miRNA,于哺乳动物体内广泛分布,存在组织特异性,于肺以外组织内广泛分布。研究显示,miR-34a 存在抑癌作用,能抑制肝癌、乳腺癌等相关肿瘤,故认为miR-34a 能明显影响子宫内膜癌[4-5]。
本研究结果显示,相较于癌旁组织,子宫内膜癌细胞组织内miR-34a 表达下降。miR-34a 对子宫内膜癌细胞组织增殖明显抑制,并加快细胞凋亡[6]。研究表明,miR-205 作为miRNA 家族中最为重要的成员之一,于卵巢癌细胞组织内呈高表达,和肿瘤细胞侵袭、转移存在相关性[7-8]。故抑制癌细胞增殖,诱导癌细胞凋亡是临床治疗肿瘤的关键[9]。
大量体外研究显示,化疗药物可对癌细胞凋亡进行诱导,进而发挥抗肿瘤作用。近年来,随着临床深入研究癌细胞增殖、凋亡发现,miR-34a 经对凋亡通路有关基因进行调控,能诱导细胞凋亡[10]。本研究显示,miR-34a 过度表达对子宫内膜癌细胞组织凋亡存在促进作用,提示miR-34a 过度表达可增加细胞凋亡标志蛋白-PARP 降解产物表达,明确miR-34a 可将细胞凋亡通路激活,加快子宫内膜癌细胞组织凋亡。研究指出,细胞凋亡信号通路较多,Notch1 信号转导通路主要由CSLD-NA 结合蛋白、Notch 受体及Notch 配体构成,参与细胞增殖、分化活动,能对细胞分化及增殖、凋亡进行调节,影响细胞生理及病理过程[11]。大量研究表明,Notch 信号存在促肿瘤作用,肿瘤细胞组织内Notch 表达明显高于正常组织,和肿瘤增殖、凋亡关联密切[12]。本研究经双荧光素酶报告基因测定实验明确miR-34a可结合Notch1 3'UTR,对Notch 启动子活性进行影响。同时,免疫印迹实验表明,miR-34a 可对Notch1 蛋白表达进行抑制,提示Notch1 为miR-34a 下游靶基因。而MTT、流式细胞凋亡测定实验发现,Notch1 表达过度可对miR-34a 介导细胞凋亡进行抑制,促进细胞增殖;提示miR-34a 调控子宫内膜癌Ishikawa 细胞增殖、凋亡,主要经干扰靶基因Notch1 蛋白表达[13]。分析miR-34a对子宫内膜癌Ishikawa 细胞增殖、凋亡的调控作用,可能与Notch 通路存在相关性,能为临床早期诊治子宫内膜癌提供理论依据、临床试验基础。但针对Notch1 蛋白对Ishikawa 细胞增殖、凋亡的影响机制仍需进一步明确,有待深入研究Notch1 蛋白和细胞凋亡标志蛋白PARP 降解产物间互相作用,为临床防治子宫内膜癌提供新选择[14]。
综上所述,Notch1 为miR-34a 重要的下游靶基因,miR-34a 经对Notch1 表达进行靶向调控,能对人子宫内膜癌Ishikawa 细胞的凋亡进行诱导,进而阻断Ishikawa细胞增殖。

