大黄素增强紫杉醇对小细胞肺癌裸鼠模型TTF-1、CD56、ProGRP的影响
王潘红 郑明 蔡云峰
小细胞肺癌(SCLC)是肺癌的一种特殊类型,约占所有肺癌的15%,相比于其他类型,SCLC 易出现侵袭性发展和远处转移,危害性较大[1]。SCLC 主要发生在吸烟人群中,由于吸烟人口逐年增多以及吸烟人口低龄化等情况,SCLC 的发病率每年都有所增长[2]。植物中提取的大黄素(EM)具有较高的药用性[3],有研究发现,大黄素对小鼠肝癌、淋巴肉癌、黑色素瘤和肺癌等均有较高抑制作用,可作为一种新型的抗癌药物。紫杉醇(TAXOL)是一种从植物红豆杉的树皮中所提取的天然有效成分,具有较好的抗肿瘤活性,在临床上已经用于多种癌症的治疗[4],但在SCLC 治疗中的应用较少,有学者指出,紫杉醇与其他抗肿瘤药物联合使用会有更好的治疗效果[5-6]。本实验拟通过建立SCLC裸鼠模型,探讨紫杉醇联合大黄素对模型裸鼠TTF-1、CD56、ProGRP 的影响,旨在为肺癌的临床治疗提供科学依据。
1 资料与方法
1.1 实验动物 BALB/ c-nu 裸鼠购自北京动物模型库。裸鼠4~6 个月龄,体质量20~24 g,在(21±2)℃、40%~70%的湿度和12 h 的光/暗循环环境下饲养,本实验严格遵守一般动物实验伦理学原则。
1.2 仪器与试剂 大黄素(批号:wkq16071004,纯度>98%)购自四川维克奇生物公司;紫杉醇(批号:130416-12,纯度>98%)购自西昌市凯源康药业公司;HE 染色液购自美国Origene;TTF-1、CD56、Pro-GRP抗体购自美国Sigma 公司;免疫组化试剂盒购自Abcam(中国)公司;NF05DH-1831 型血气分析仪购自广州华西科创科技有限公司;iTube 3000 全自动发光免疫分析仪购自烟台艾德康生物科技有限公司。
1.3 实验分组 通过胫骨结节骨髓腔注射方法构建SCLC 裸鼠模型[7]。将成功建模的裸鼠分为3组,分别为模型组、TAXOL组和TAXOL+EM组,每组各20 只,另选20 只健康裸鼠为空白组。其中TAXOL组裸鼠给药60 mg/mL 紫杉醇,TAXOL+EM组裸鼠给药30 mg/mL紫杉醇+30 mg/mL 大黄素,空白组和实验组用同种方法给予等量的溶剂,共给药14 d。
1.4 动脉氧分压(PaO2)检测 分别于给药第1、7、14 天采集大鼠动脉血0.2 mL,采用血气分析仪按照产品说明书进行检测PaO2。
1.5 肺、肝组织HE 染色观察 各组小鼠折颈处死,取其肺部组织。肺组织用体积分数10%甲醛固定、脱水、包埋、切片,然后对切片脱蜡和HE 染色,在光镜下(×400)观察组织病理形态。取裸鼠肝组织,操作同上述步骤,观察SCLC 肝转移的情况。
1.6 免疫组化检测TTF-1、CD56 水平 肺组织经切片、二甲苯脱蜡、梯度酒精水化、抗原修复。后加入一抗(1 ∶200),4℃过夜,PBS 洗3 次。加入生物素标记二抗,37℃孵育1 h。DAB 显色液染色。苏木素染核,酒精脱水,二甲苯透明30 min,中性树胶封片,于倒置显微镜100 倍视野下观察是否阳性。
1.7 CLIA 法检测ProGRP 水平 取各组裸鼠外周血,按照全自动发光免疫分析仪机器说明书操作,检测裸鼠血清中ProGRP 的水平。
1.8 RT-PCR 法检测TTF-1、CD56、ProGRP 的mRNA水平 取出大鼠肺组织,用Trizol 法裂解并提取总RNA,使用逆转录试剂盒将mRNA 反转录成cDNA。在冰上准备50 μL PCR 扩增反应体系:2XSYBR25 μL,上、下游引物各1 μL,cDNA 2 μL,双蒸水20.7 μL,TaqDNAPolymerase0.3 μL。在实时荧光定量PCR 仪上反应,反应条件:95℃预变性10 min,95℃变性10 s,60℃退火30 s,45 个循环,95℃10 s,65℃60 s,97 ℃1 s。记录各孔Ct 值,以β-actin 作内参,采用2-ΔΔCt计算各mRNA 的相对表达量,计算公式为:ΔΔCT=ΔCt 实验-ΔCt 空白,其中ΔCt=Ct 目的-Ct内参。引物序列及产物大小见表1。

表1 引物序列表(5'→3')
1.9 统计学方法 采用SPSS 22.0 统计软件。多组间比较用单因素方差分析,组间两两比较用LSD 检验,计量资料用卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组不同时间PaO2比较 模型组,TAXOL组和TAXOL+EM组在1 d、7 d及14 d PaO2水平均低于空白组(P<0.05);TAXOL组和TAXOL+EM组PaO2水平随着持续给药而升高,且均高于模型组(P<0.05);TAXOL+EM组各时间点PaO2水平均高于TAXOL组(P<0.05),见表2。
表2 不同时间段各组PaO2比较[mmHg,()]
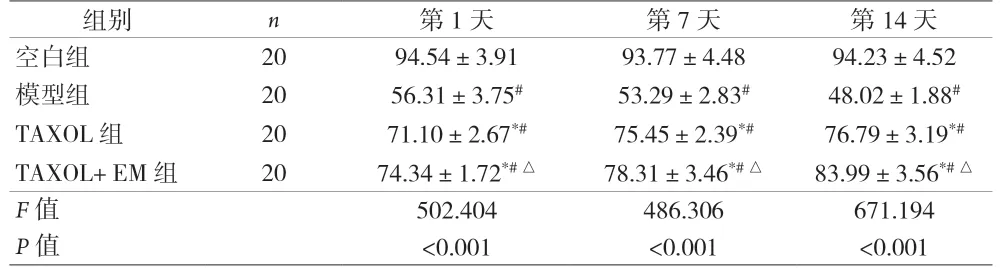
表2 不同时间段各组PaO2比较[mmHg,()]
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05;与TAXOL组比较,△P<0.05
2.2 肺组织染色结果比较 与空白组比较,其他组裸鼠肺组织明显发生病变,肺泡间隙变小;与模型组比较,TAXOL组和TAXOL+EM组肺部组织病变情况有所缓解;与TAXOL组比较,TAXOL+EM组肺组织恢复情况更好,见图1。
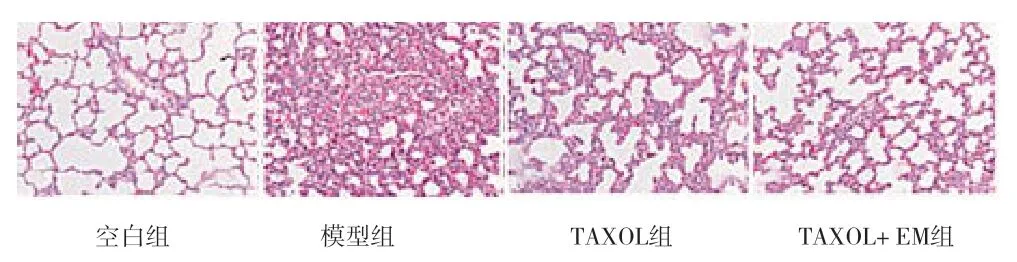
图1 各组肺组织HE染色情况
2.3 各组肝转移结果比较 与空白组比较,其他组裸鼠肝组织出现结节,病理染色结果与肺组织结果相似,提示肺癌细胞发生肝转移;与模型组比较,TAXOL组和TAXOL+EM组肝组织转移程度有所减轻;与TAXOL组比较,TAXOL+EM组肝组织情况更好。见图2。

图2 各组肝组织HE染色情况
2.4 各组TTF-1、CD56、ProGRP 水平比较 见表3。
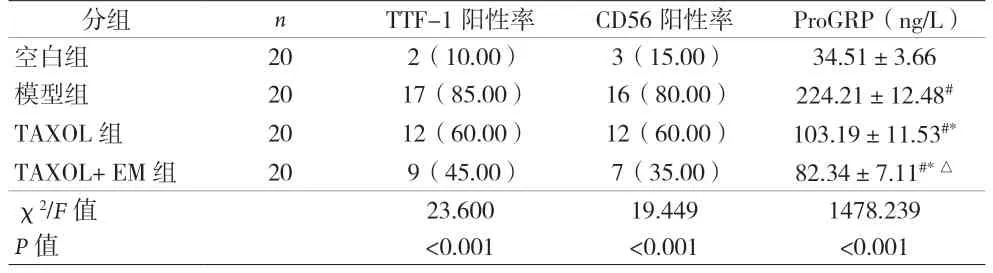
表3 各组TTF-1、CD56、ProGRP水平比较
2.5 各组TTF-1、CD56、ProGRP 的mRNA 水平比较 见表4。
表4 各组TTF-1、CD56、ProGRP的mRNA水平比较()
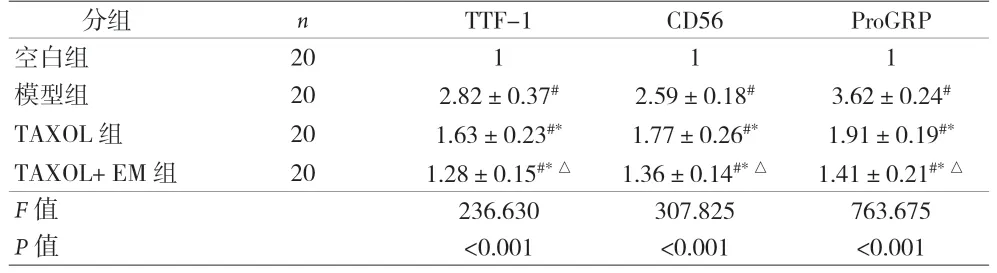
表4 各组TTF-1、CD56、ProGRP的mRNA水平比较()
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05;与TAXOL组比较,△P<0.05
3 讨论
SCLC 是神经内分泌型肺癌的一种,相比于其他类型的肺癌具有更高的侵袭能力。SCLC 由于其高增殖、转移快等特点,易复发和和恶化,是一类危害较大的恶性肿瘤[8]。SCLC 单纯通过手术切除治疗疗效欠佳,临床上通常联合使用化疗或放疗方法[9]。
紫杉醇是多种癌症化疗的常用药物,受到广泛的关注和研究。紫杉醇通过结合微管蛋白抑制其聚解,导致其排列异常并阻断肿瘤细胞正常的有丝分裂纺锤体发育和随后的细胞分裂达到抗肿瘤效果[10]。同时由于肿瘤细胞的抗药性等原因,单一使用紫杉醇治疗的手段急需改进。紫杉醇联合其他药物被认为可以有效增强其功效。刘晓洁等通过体外细胞培养实验发现,白藜芦醇联用紫杉醇可以通过增加P-gp 蛋白的表达,有效促进食管癌EC109 细胞的凋亡[11];TOMOYUKI 等[12]研究发现紫杉醇联合雷公藤治疗晚期胃癌患者具有更高的的疗效和安全性。卢娜等研究指出,姜黄素联合多西紫杉醇对人肺癌细胞放疗增敏机制与肿瘤细胞周期阻滞和诱导细胞凋亡有关,且在紫杉醇浓度为60 mg/mL时效果最好[13]。大黄素是天然的生物抑制剂,近年来作为抗癌药物被广泛研究。何敏等通过实验发现芦荟、大黄素联用顺铂可以增强乳腺癌细胞的凋亡[8]。
TTF-1 是NKX2 家族的一种转录基因核蛋白,常在肺组织和甲状腺组织及其癌变过程出现、表达,影响多种基因调控,>90%原发性SCLC 表达阳性TTF-1[14]。CD56 是一种跨膜神经细胞糖蛋白黏附分子,是肺神经内分泌肿瘤首选的特异性标志物[15]。PROGRP 是脑肠激素的一种,是SCLC 增殖因子胃泌素释放肽的前体,可作为SCLC 特异性肿瘤标志物[16]。
本研究结果显示,紫杉醇与大黄素联用可以有效降低裸鼠TTF-1、CD56、ProGRP 水平,抑制肿瘤细胞的增殖和转移,且效果比单一使用紫杉醇更好,这与上述研究结果相似。同时,随着给药时间的延长,单一使用紫杉醇的小鼠PaO2上升水平减缓,而紫杉醇和大黄素联用给药的小鼠PaO2持续上升,提示紫杉醇与大黄素联用的抗肿瘤效果不仅优于同浓度的紫杉醇,且可能在一定程度上能克服肿瘤细胞的抗药性,从而达到持续抑制的效果。
综上所述,大黄素可以增强紫杉醇对SCLC 裸鼠TTF-1、CD56 及ProGRP 的影响,降低TTF-1、CD56及ProGRP 表达水平,有效抑制SCLC,同时可以在一定程度上减少肿瘤细胞的抗药性,达到持续抑制的效果,为SCLC 的治疗提供新的科学思路。

