双氢青蒿素通过抑制上皮-间质转化减轻肾脏纤维化的作用机制分析
刘玲 杨亚珍 俞东容*
慢性肾脏病(CKD)已成为威胁数十亿人的全球性健康问题。据报道,中国CKD 的发病率达10.8%[1]。CKD 常导致肾脏纤维化,病因包括成纤维细胞聚集、间质小管的上皮-间充质转变(EMT)、小管细胞丢失以及肾小管周围微脉管系统稀疏[2]。EMT 是肾脏纤维化进展中的关键之一[3],其特征是失去E-cadherin 蛋白和细胞角蛋白等黏附分子,并出现新的间充质标记,如vimentin、α-平滑肌肌动蛋白(α-SMA),I 型胶原蛋白和纤连蛋白[4]。Wnt/β-catenin 信号通路是肾脏纤维化过程中关键的信号通路之一。尽管在正常肾脏中该信号通路处于非激活状态,但在多种肾脏损伤中,Wnt/β-catenin 信号被激活[5]。双氢青蒿素(DHA)是从青蒿中提取的青蒿素的半合成衍生物。除了抗疟疾,DHA还被发现具有较多潜在的药理作用,包括抗肿瘤、抗炎和抗纤维化。本研究通过TGFβ-1 体外诱导的HK2 细胞和体内单侧输尿管阻塞(UUO)模型,探讨DHA 的抗纤维化作用。
1 材料与方法
1.1 细胞培养 用含有10%胎牛血清(FBS),1.2 g/L碳酸氢钠,1%青霉素/链霉素的DMEM/F12 培养基,在37℃和5%CO2中条件下培养人肾近端肾小管上皮细胞系细胞(HK2)。用0.2%胰蛋白酶(Sigma)和0.02%EDTA 将HK2 细胞消化后接种到6 个孔板中。当HK-2细胞生长到80%时,用无血清DMEM/F12 饥饿过夜。饥饿24 h 后,用TGFβ-1(Peprotech)和DHA 处理HK2细胞。将HK2 细胞随机分为6组:正常组(normal组),TGFβ-1组(5 ng/mL),TGFβ-1(5ng/mL)+DHA(10 μM)组,TGFβ-1(5 ng/mL)+DHA(25 μM)组,TGFβ-1(5 ng/mL)+DHA(50 μM)组 和TGFβ-1(5ng/mL)+DHA(100 μM)组。所有细胞培养24 h 后进行后续处理。
1.2 逆转录聚合酶链反应(RT-PCR)肾脏组织和HK2 细胞中的总RNA 分离采用RNA 分离试剂盒(TaKaRa)进行分离。2 μg 总RNA 用于逆转录。采用StepOnePlus实时PCR系统(Applied Biosystems)和SYBR Premix Ex Taq(TaKaRa)检测纤连蛋白、E-cadherin、胶原I、波形蛋白和α-SMA 的mRNA 表达水平。扩增条件采用95℃持续30 s,然后进行40 个循环扩增(95℃持续5 s,60℃持续30 s)。18 s RNA 作为内参调整样品间的差异。使用2-△△Ct法计算相对浓度。引物通过Pubmed 在线工具设计,并由上海生工公司合成。引物序列见表1。

表1 实时定量聚合酶链反应的引物序列
1.3 Western 蛋白印迹分析 蛋白表达通过Western 蛋白质印迹检测。使用RIPA 裂解缓冲液(碧云天)提取蛋白,然后使用10%丙烯酰胺凝胶分离蛋白。将蛋白条带转移到PVDF 膜(Millipore)上后,用10%的脱脂牛奶将蛋白条带封闭1 小时。一抗采用GAPDH(1 ∶1500,CST)、E-Cadherin(1 ∶10000,Abcam)、α-SMA(1 ∶10000,Abcam)、I 型胶原(1 ∶5000,Abcam)、t-β-catenin(1 ∶1000,CST)和p-β-catenin(1 ∶1000,CST),辣根过氧化物酶偶联的山羊抗兔IgG(1 ∶1500,CST)作为二抗。通过增强的化学发光检测试剂(Millipore)检测条带,并通过X 射线胶片(Bio-Rad)实现可视化。蛋白质表达水平通过与GAPDH 的比例定量。
1.4 实验动物及处理 动物研究方案经杭州市中医院动物实验伦理委员会批准。雄性SD 大鼠(180~210 g)购自浙江省医学科学院。将大鼠以12 h~12 h 的明/暗周期圈养在笼子中,温度22℃,湿度40%~60%。DHA(纯度>99%,分子量284.35)购买自阿拉丁公司。将DHA 溶解在0.3%的羧甲基纤维素钠(CMC)中。建立UUO 模型[6]:大鼠通过腹腔注射麻醉3%戊巴比妥(1 mg/kg 体重)进行麻醉。消毒后,暴露腹腔,分离左输尿管,并在2 处用丝线结扎左侧输尿管。假手术组大鼠不结扎输尿管。将50 只SD 大鼠随机分为五组:假手术组(假手术并使用0.3%CMC 治疗)、UUO组(行UUO 手术并使用0.3%CMC 治疗);DHA-H组[行UUO 手术并使用DHA100 mg/(kg·d)治疗];DHA-M组[行UUO手术并使用DHA10 mg/(kg·d)治疗];DHA-L组[行UUO 手术并使用DHA 1 mg/(kg·d)]。DHA组大鼠通过胃内给予DHA,1 次/d。手术后UUO 和Sham组的大鼠给予等体积的0.3%羧甲基纤维素钠。在第14 天,通过腹膜内注射3%戊巴比妥(30 mg/kg)将所有大鼠麻醉后处死。从腹主动脉收集血液。使用自动生化分析仪测试血清肌酸(Scr)和尿素氮(Bun)。肾脏与体重比通过测量左肾重量计算。一部分肾脏组织通过固定和石蜡包埋用于进一步组织病理学检测。另一部分肾脏组织切成小块,用液氮冷冻,然后提取mRNA 和蛋白。
1.5 统计学方法 采用SPSS 18.0 统计软件。计量资料以()表示,多组间比较用Mann-Whitney U 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 DHA 减轻TGFβ-1 诱导的HK2 细胞纤维化 与normal组比较,TGFβ-1 刺激后,纤连蛋白和I 型胶原的mRNA 水平增加。DHA 减弱纤连蛋白和胶原蛋白I的升高(见图1A、B)。通过Western-blot 进一步评估胶原蛋白I 的蛋白表达水平。结果发现,通过TGFβ-1刺激,胶原I 的蛋白表达增加(图1C、D)。
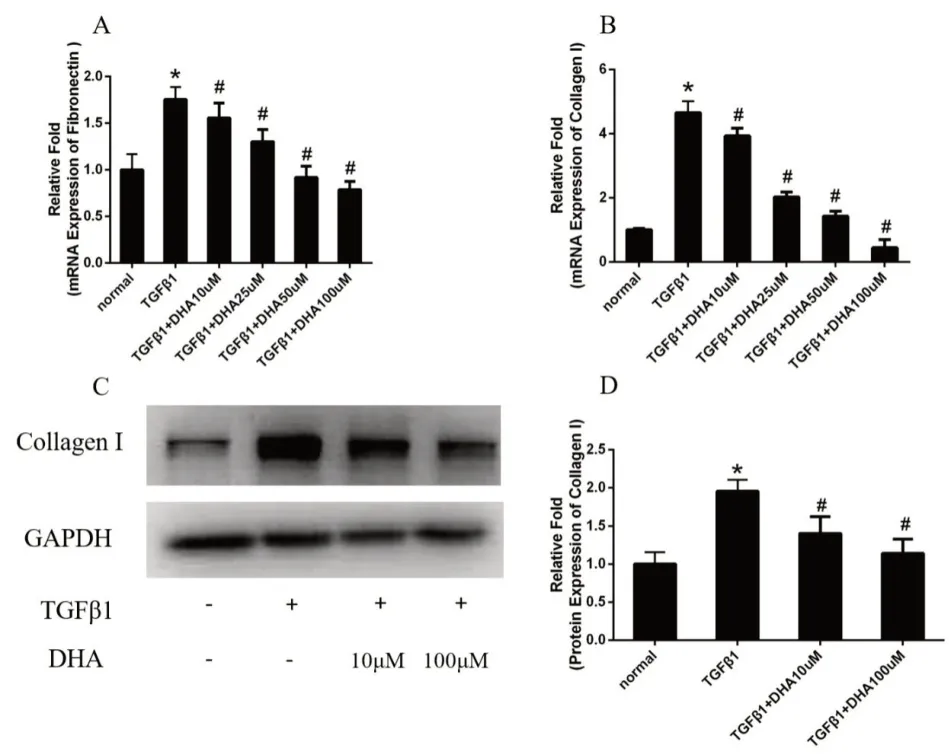
图1 DHA对TGFβ-1诱导HK2细胞纤维化的影响
2.2 DHA 通过Wnt/β-catenin 信号通路减轻TGFβ-1诱导的HK2 细胞EMT DHA 减轻TGFβ-1 诱导的间质标记物(vimentin 和α-SMA)表达,增加上皮标记物E-cadherin 表达(见图2 A-F)。TGFβ-1 使HK2 细胞中的p-β-catenin 活化,而DHA 减轻p-β-catenin蛋白水平的升高(图2 D-G)。
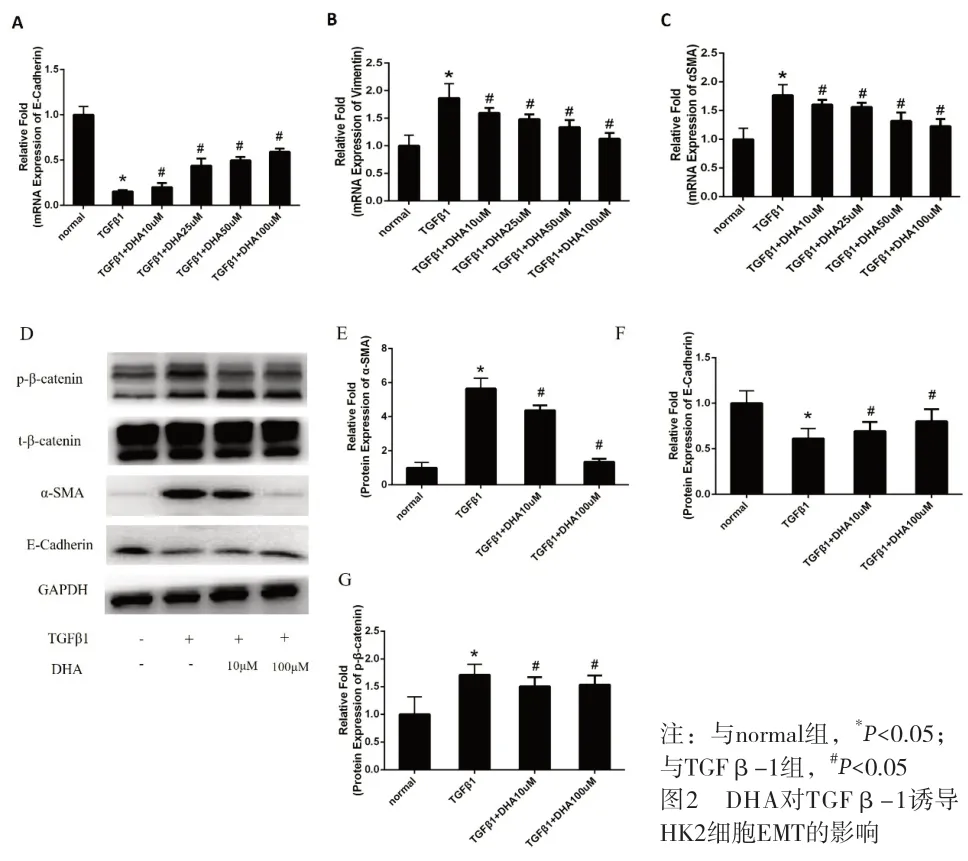
图2 DHA对TGFβ-1诱导HK2细胞EMT的影响
2.3 DHA 对UUO 大鼠肾重量指数和肾功能的影响 与假手术组比较,UUO组肾脏发生病理形态学改变。与UUO组比较,UUO+DHA10 mg/kg组及UUO+DHA100 mg/kg组降低肾脏重量指数(P<0.05)(图3A、B)。与UUO组比较,UUO+DHA10 mg/kg组及UUO+DHA100 mg/kg组Scr 和Bun 明显降低(P<0.05),UUO+DHA 1 mg/kg组Bun 降低(P<0.05)(见图3C、D)。
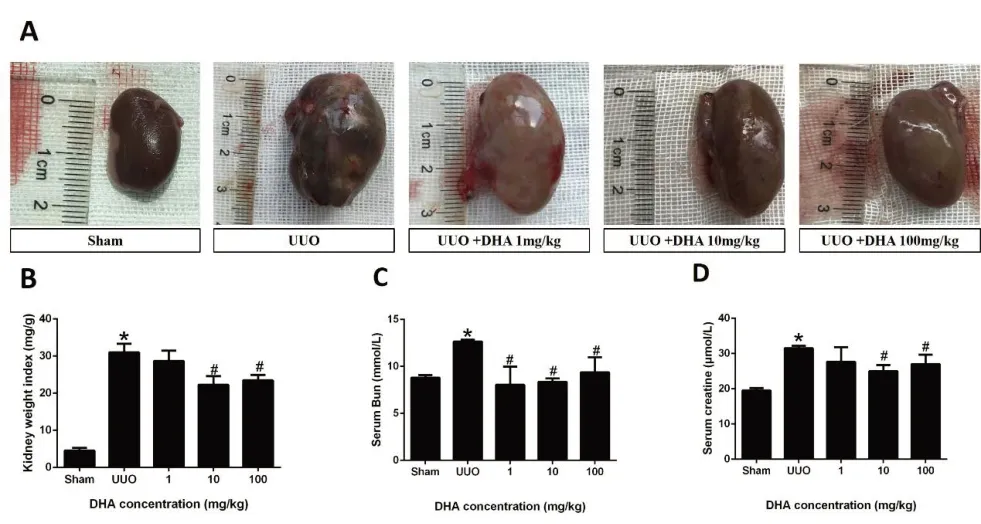
图3 DHA对UUO大鼠肾重量指数和肾功能的影响
2.4 DHA 对UUO 大鼠肾脏纤维化和肾小管EMT 的影响 HE 染色显示,UUO 引起上皮细胞坏死、炎性细胞浸润和肾小管扩张,DHA 治疗则显著逆转了这些变化。Masson 染色显示,UUO组存在大量胶原蛋白沉积,提示更严重的肾脏纤维化。DHA 处理可减少剂量依赖性的胶原沉积。见图4。

图4 HE(A-E)和Masson三色(F-J)染色的肾脏切片的组织学
2.5 DHA 对胶原蛋白I、fibronectin、E-Cadherin 和α-SMAmRNA 表达的影响 UUO 增加I 型胶原、纤连蛋白和α-SMA 的mRNA 表达,而DHA 可以降低其表达,并具有剂量依赖性。E-Cadherin 蛋白表达在UUO组中减少,在DHA 治疗后增加。见图5。
3 讨论
本研究结果显示,TGFβ-1 刺激HK2 细胞中纤维蛋白、胶原I、vimentin 和α-SMA 的表达并抑制Ecadherin 蛋白的表达。DHA 可以减轻这些影响。DHA显著改善UUO 大鼠的肾胶原I 的表达,降低Scr 和Bun的血清水平,并抑制ECM 的产生。因此,DHA 可以在体内外减轻肾脏纤维化。在肾损伤中,EMT 是肾脏纤维化的主要原因[3]。TGFβ-1 是慢性肾脏疾病发生肾脏纤维化的诱发剂[7],并影响肾小管EMT 的大多数关键事件[8]。EMT 导致α-SMA 的重新表达和ECM(如胶原蛋白I)的积累,引发肾脏纤维化[9]。
青蒿素是从青蒿植物中提取的倍半萜内酯过氧化物。DHA 是青蒿素的衍生物。除抗疟疾作用外,DHA还具有抗炎、抗纤维化、抗肿瘤和免疫抑制作用[10]。本研究显示,DHA 在肾脏纤维化中具有抗纤维化作用,有望成为治疗慢性肾脏疾病进展的药物。CKD 的进展以肾细胞丢失和细胞外基质(ECM)堆积为特征[11]。肾脏纤维化可能是由于ECM 合成增加和降解降低所致。本研究显示,由TGFβ-1 诱导的HK2 细胞和UUO 大鼠模型中,ECMs 生物标志物(包括纤连蛋白和I 型胶原)显著增加。但DHA 治疗后,这些ECMs 生物标志物显著下降。表明,DHA 的抗纤维化作用可能与DHA调节肾脏ECM 动态失衡作用有关。
肌成纤维细胞是过量ECM 的主要来源[12]。研究表明,成肌纤维细胞来源于病理和损伤条件下肾小管发生EMT 的肾小管细胞[13]。因此,肾小管EMT 对于肾脏纤维化的发展至关重要。EMT 的过程特征为间充质(如α-SMA 和vimentin)的表达增加。本研究结果显示,DHA 可以下调纤维化大鼠肾脏中α-SMA 和vimentin的表达,并上调E-cadherin 蛋白的表达,提示DHA 可以缓解病理条件下肾小管EMT。表明DHA 的肾脏保护作用可能与肌成纤维细胞减少和ECM 产生沉积有关。
在EMT 过程中,涉及较多信号通路,包括TGF-β超家族和Wnt/β-catenin 等[14]。较多研究发现Wnt/β-catenin 的独特靶基因,目前已经鉴定几种直接靶基因,如纤连蛋白、snail 和肾素-血管紧张素系统。肾脏中的snail 活化促进肾小管EMT 诱导肾脏纤维化[15]。snail 可以转录抑制E-cadherin 蛋白的表达并破坏上皮细胞间的粘附[4]。在受损的肾脏中,Wnt4 的表达代表增殖性髓质成纤维细胞的数量与Wnt/β-catenin 途径自发驱动间质周细胞和肌成纤维细胞[16]。这些研究表明Wnt/β-catenin 信号通路在启动肾小管EMT 中具有重要作用。本研究中,TGFβ-1 诱导的HK2 细胞表达较高水平的活化β-catenin 和相关分子,表明Wnt/β-catenin 通路在TGFβ-1 诱导的HK2 细胞中被激活。DHA 可有效抑制β-catenin 的活性并降低该信号通路的激活。
综上所述,DHA 通过抑制Wnt/β-catenin 信号传导途径抑制EMT,在体内外对肾脏纤维化均有保护作用。DHA 有望成为预防和治疗肾脏纤维化的候选药物。

