乳源蜡样芽胞杆菌耐药性、毒力因子检测及分子特征研究
郭佳, 王娉, 周继福,3, 赵晓美, 刘继锋, 陈颖*
(1.天津科技大学食品科学与工程学院,天津 300457; 2.中国检验检疫科学研究院,北京 100176;3.南京财经大学食品科学与工程学院,南京 210023)
蜡样芽胞杆菌(Bacilluscereus)是一种革兰氏阳性杆菌,广泛存在于自然界和动物肠道中,好氧、产芽胞,在8~55 ℃环境下均可生长,28~35 ℃是其最适生长温度[1],因此容易在食品生产、运输和销售等环节繁殖而污染食品[2-4]。近10年来,每年都有由于蜡样芽胞杆菌污染导致的食物中毒事件发生[5-7]。而乳制品中的污染情况也比较突出,对10年内我国吉、闽、陕三省乳品企业乳与乳制品中蜡样芽孢杆菌的污染情况进行调查与鉴定[8-11],结果显示,吉林省乳制品中蜡样芽孢杆菌的检出率为32.90%,其中长春市检出率高达73.33%;福建省部分地区婴幼儿奶粉检出率也达到52.78%;陕西省乳与乳制品中的检出率为20.00%。谢爱蓉等[12]对温州市市售乳粉中蜡样芽胞杆菌的污染情况及分离株的毒力基因进行研究,蜡样芽胞杆菌检出率为19.00%,主要的肠毒素毒力基因为nhe基因与entFM基因。Dosanjos等[13]对巴西75份乳饮品进行微生物学检测,羊奶、豆奶和羊奶饮料的蜡样芽胞杆菌检出率分别为16%、52%和44%。由此表明,乳品中蜡样芽胞杆菌污染具有普遍性。蜡样芽孢杆菌可引起食物中毒,症状主要有腹泻和呕吐。蜡样芽胞杆菌引起食物中毒的主要成分是其产生的两种肠毒素——呕吐毒素和腹泻毒素,这两种毒素能够引起呕吐型和腹泻型食物中毒,严重者可能导致败血症、创伤、肺部感染和心内膜炎等[14]。蜡样芽孢杆菌含有多种毒力基因可转录翻译成肠毒素,包括溶血素BL基因(hblA、hblC、hblD)、非溶血肠毒素基因(nheA、nheB、nheC)、细胞毒素K基因(cytK)[15]、肠毒素基因(bceT和entFM)和呕吐毒素基因(ces和EM1)。其中,毒力最强的是引起呕吐的毒素基因ces和EM1[16-17]。
目前,临床主要采用抗生素治疗蜡样芽孢杆菌引发的食物中毒,但随着药物的滥用和耐药元件的转移,蜡样芽孢杆菌对常见抗生素的耐药性不断增强。CLSI 标准M45-a2[18](苛养菌少见菌药敏判断标准)中推荐的蜡样芽孢杆菌药敏试验抗生素分为β-酰胺类和非β-酰胺类。由于蜡样芽孢杆菌可以产生β-酰胺酶,因此,对β-酰胺类抗生素表现出高度耐药[19]。本研究主要选择9种非β-酰胺类抗生素(包括治疗蜡样芽胞杆菌感染的推荐用药),对乳及乳制品来源的122株蜡样芽孢杆菌进行药物敏感性检测,分析其主要毒力基因;并使用脉冲场凝胶电泳(PFGE)对蜡样芽孢杆菌进行分型,以掌握原料乳及乳粉来源蜡样芽孢杆菌的流行病学特征,为蜡样芽孢杆菌引起的食源性疾病的预警、预防和治疗提供参考。
1 材料与方法
1.1 菌株来源
蜡样芽孢杆菌ATCC 11778、ATCC 29213及沙门氏菌H9812为本实验室保存。122株蜡样芽孢杆菌分离株均分离自原料乳及乳粉(来自于北京、河北及内蒙古),其中,49株为2019年原料乳分离株;25株为2016年乳粉分离株;37株为2017年乳粉分离株;11株为2018年乳粉分离株。均采用GB 4789.14—2014《食品安全国家标准 食品微生物学检验 蜡样芽胞杆菌检验》进行鉴定。
1.2 培养基和试剂
甘露醇卵黄多粘菌素(MYP)琼脂、多粘菌素B,胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB)培养基购于北京陆桥技术股份有限公司;水解酪蛋白琼脂(MHA)培养基购于英国OXOID公司;dNTPs、ExTaq酶、10×ExTaq缓冲液、溴化乙锭、DL2000 DNA 标记分子购于大连宝生物工程有限公司;琼脂糖(invitrogen)、哥伦比亚血琼脂平板、庆大霉素(gentamicin,10 μg)、四环素(tetracycline,30 μg)、红霉素(erythromycin,15 μg)、氯霉素(chloramphenicol,30 μg)、阿米卡星(amikacin,30 μg)、环丙沙星(ciprofloxacin,5 μg)、克林霉素(clindamycin,2 μg)、复方新诺明(trimethoprim-sulfamethoxazole,1.25/23.75 μg)、利福平(rifampin,5 μg)购于英国Oxiod公司;MicrobankTM菌种保存管购于加拿大PRO-LAB公司;氯化钠、DNA提取试剂盒来自于天根生化科技有限公司;限制性核酸内切酶XpaⅠ(15 U·μmol-1)、NotⅠ(15 U·μmol-1)、溶菌酶(15 U·μmol-1)来自于Takara公司;5×TBE、EDTA、Tris-HCl来自于索莱宝公司;Gel Red核酸染液来自于美国Biotium公司;引物由生工生物工程股份有限公司合成。
1.3 主要仪器和设备
PCR扩增仪(Veriti 96 Well Thermal Cycler),美国AB公司;离心机(5804R),德国Eppendorf公司;电泳仪(MODEL 200/2.0 POWER SUPPLY),分子凝胶成像仪(VersaDoc),PFGE凝胶电泳仪(CHEF MAPPER),美国BIO-RAD公司;数显拍击式均质机,法国Interscience公司;全自动微生物鉴定/药敏系统(BD PhoenixTM-100),美国BD公司;核酸蛋白分析仪(DU640),德国Beckman公司。
1.4 毒力基因的检测
使用DNA提取试剂盒提取蜡样芽孢杆菌的基因组DNA,并用核酸蛋白分析仪对提取的细菌DNA浓度进行测定后,将DNA稀释至20 μg·mL-1作为PCR扩增反应的DNA模板,在-20 ℃下保存备用。对蜡样芽孢杆菌的11个毒力相关基因(hblA、hblC、hblD、nheA、nheB、nheC、entFM、cytK、bceT、ces、EMl)进行PCR扩增。PCR反应体系(25 μL)为:模板2 μL,引物各1 μL(引物序列见表1),dNTPs 2 μL,10×ExTaqBuffer(Mg2+Plus)2.5 μL,ExTaq(5 U·μL-1)0.3 μL,ddH2O补齐至25 μL。扩增条件为:95 ℃,10 min;95 ℃,30 s,56 ℃,30 s,72 ℃,30 s,30个循环;72 ℃,10 min。PCR产物使用2%琼脂糖凝胶电泳检测。
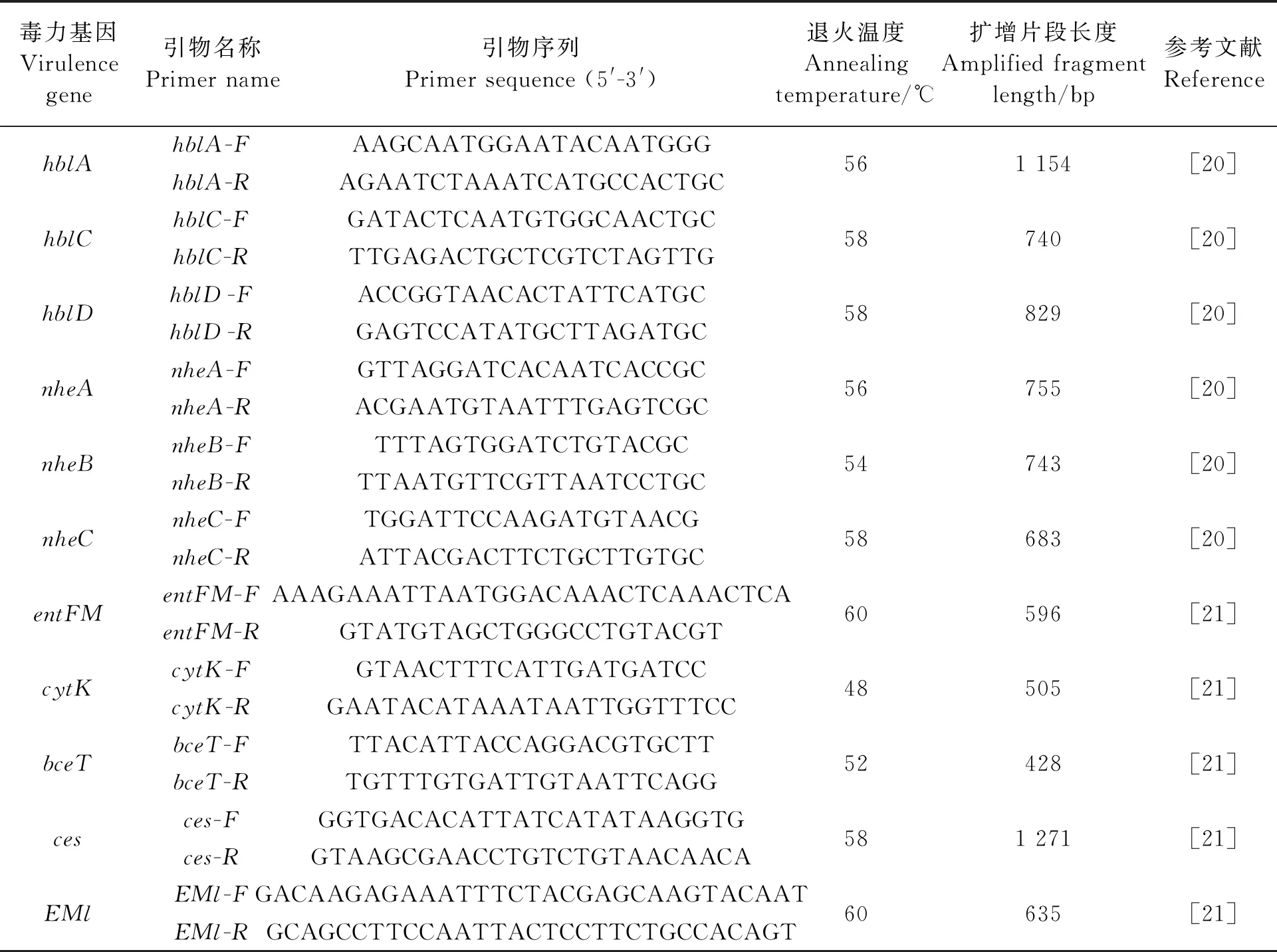
表1 蜡样芽孢杆菌11个毒力基因的引物序列
1.5 蜡样芽胞杆菌药物敏感性分析
蜡样芽孢杆菌的药物敏感性检测按照世界卫生组织(WHO)推荐的K-B法进行药物敏感实验,参照美国临床和实验室标准协会(CLSI)2020版[22]标准分为敏感(sensitivity,S)、耐药(resistance,R)和中介(intermediary,I)。
1.6 脉冲凝胶电泳(pulsed-field gel electropho-resis,PFGE)分型分析
根据蜡样芽孢杆菌PFGE规范[23]进行操作,将细菌包埋至胶块中,使用苯丁酸氮芥(chlorambucil,CLB)对细菌进行裂解。裂解后对胶块进行清洗、保存。然后对胶块内DNA进行酶切并加样、电泳。最后对电泳胶进行染色、脱色、拍照,使用BioNumerics 6.6软件对蜡样芽孢杆菌进行聚类分析。采用非加权平均法构建聚类图,条带位置差异容许度1.5%,使用Dice系数衡量图形之间的相似度。
1.7 数据分析
使用BioNumerics 6.6软件进行聚类分析,使用Origin.2018绘制图,使用Excel.365绘制表格。
2 结果分析
2.1 毒力基因携带情况
对122株乳品来源的蜡样芽孢杆菌携带的主要毒力因子进行分析,结果(表2)表明,122株蜡样芽孢杆菌都携带nheA、nheB和entFM基因; 99.90%的蜡样芽孢杆菌都携带4个及以上毒力因子。99.18%的蜡样芽孢杆菌携带nheC基因;37.70%的蜡样芽孢杆菌携带bceT基因;31.15%的蜡样芽孢杆菌携带cytK基因;29.51%的蜡样芽孢杆菌携带hblA基因;24.59%的蜡样芽孢杆菌携带hblC基因;8.20%的蜡样芽孢杆菌携带hblD基因;6.56%的蜡样芽孢杆菌携带ces基因;6.56%的蜡样芽孢杆菌携带EM1基因。

表2 蜡样芽孢杆菌携带的毒力因子
2.2 蜡样芽胞杆菌分离株的耐药性
122株蜡样芽胞杆菌对9种非β-酰胺类抗生素的药物耐受性进行检测,结果(图1)表明,122株蜡样芽胞杆菌均对氯霉素、庆大霉素、阿米卡星敏感;40株对利福平敏感;77株对利福平中介,中介率为63.11%;7株对红霉素中介,中介率为5.74%;6株对克林霉素中介,中介率为4.92%;3株对复方新诺明中介,中介率为2.46%;1株对环丙沙星中介;1株对四环素中介;12株对复方新诺明耐药,耐药率为9.84%;10株对四环素耐药,耐药率为8.20%;5株对利福平耐药,耐药率为4.10%。122株蜡样芽孢杆菌中耐药比例为16.40%,其中,13株为单重耐药株,7株为二重耐药株,无多重耐药株。耐药谱型共6种,分别为:四环素、复方新诺明、利福平、四环素-复方新诺明、四环素-利福平、复方新诺明-利福平。流行的耐药谱为复方新诺明和四环素-复方新诺明,分别占耐药株的30%和25%,四环素-利福平耐药株和复方新诺明-利福平耐药株的比例为2%。
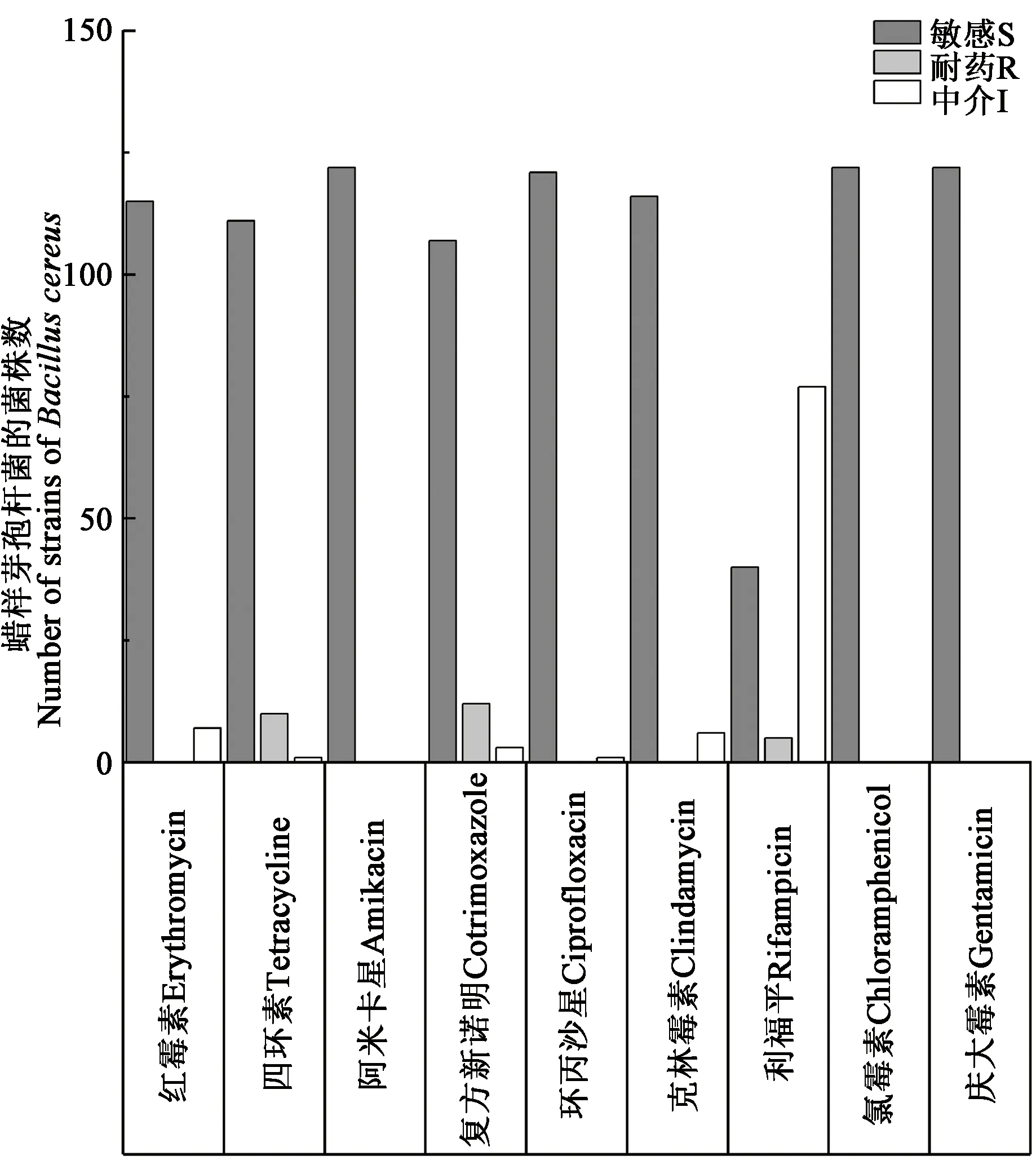
图1 蜡样芽孢杆菌对不同抗生素药物敏感情况
2.3 蜡样芽胞杆菌分离株的PFGE分子分型分析
使用NotⅠ对122株乳品来源的分离株进行酶切,PFGE分型后得到15个簇、106个带型,相似性在13.1%~100.0%,呈现出较高的基因多态性(图2)。每个带型包含1~3株菌,未发现绝对优势带型,说明乳品中蜡样芽胞杆菌的污染来源广泛,未发现分离基质、分离时间与带型之间的相关性。其中13个带型包含菌株多于1株,其余93个带型均只包含1株菌。相似性98%以上菌株大多为同一地区来源样品中分离得到,其中包括64402、64403,62702、62712,66012、66013,63101、63103、63113,65102、65103、65111,62801、62802,65301、65303,003311、003323,21769、21772,003222、003224等菌株。
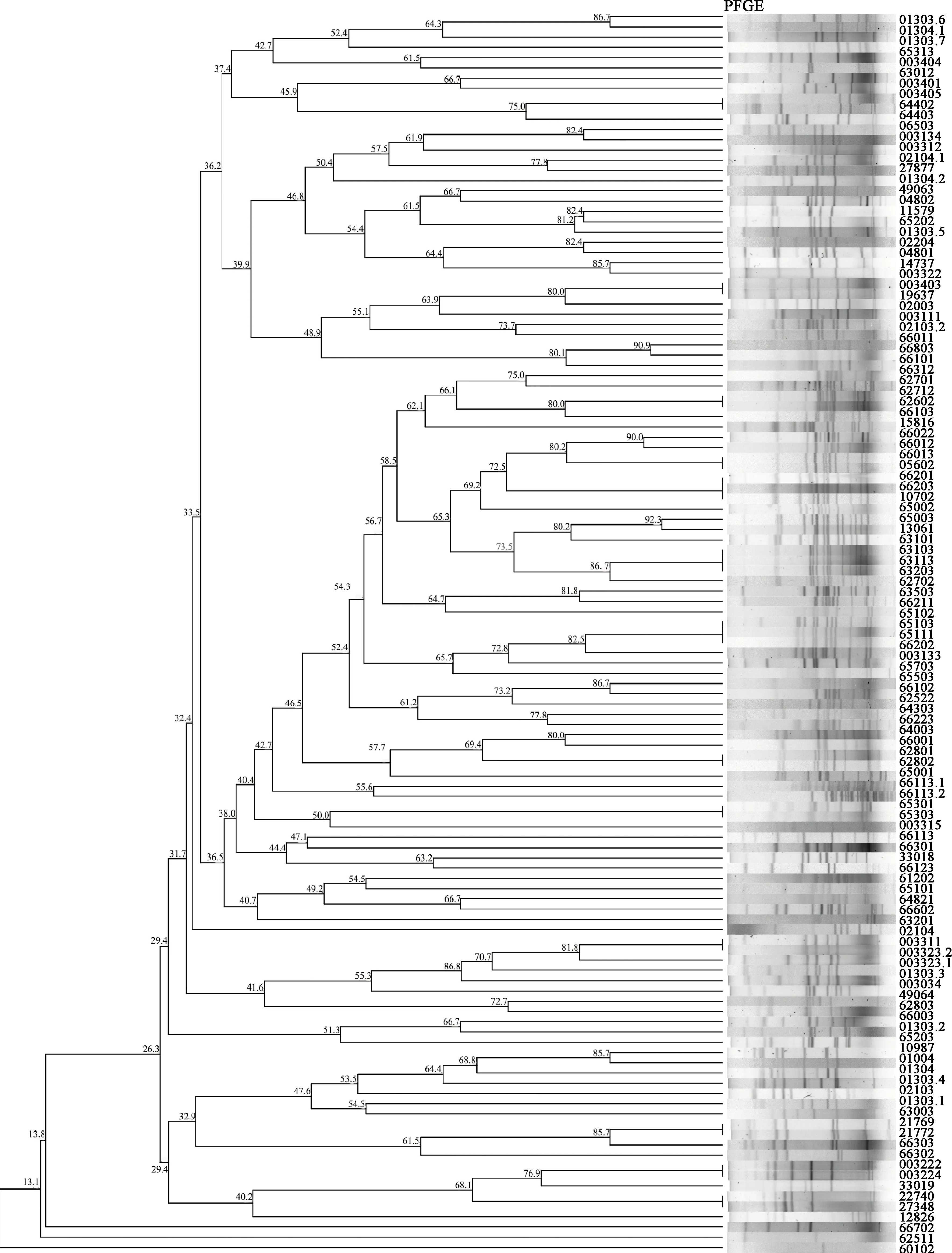
图2 122 株蜡样芽孢杆菌PFGE分子分型
3 讨论
自蜡样芽胞杆菌被报道可引起食物中毒以来,由其引起的感染事件呈逐年上升趋势。近年来,蜡样芽胞杆菌除可引起暴发性食物中毒外,还可引起胃肠外感染。蜡样芽孢杆菌的致病性与其携带的毒力基因直接相关。食物中毒者产生的腹泻症状主要由溶血型肠毒素基因hbl、非溶血型肠毒素基因nhe、细胞毒素基因cytK、肠毒素FM基因(entFM)和肠毒素T基因(bceT)所导致。溶血型肠毒素由亚基L1、L2及亚基B组成,分别由hblA、hblC、hblD三个基因控制合成;作用于细胞膜,并可与红细胞结合,形成复合体,从而导致细胞裂解。本研究中有67株蜡样芽孢杆菌不携带hbl基因;55株蜡样芽孢杆菌分别携带hblA、hblC、hblA-hblC、hblC-hblD或hblA-hblC-hblD。Hbl通过3个亚基依次与细胞膜进行结合后才能破坏细胞膜导致细胞裂解。因此,包含hblA、hblC、hblD三个毒力基因并表达的蜡样芽孢杆菌才能产生Hbl,本研究中有5株蜡样芽孢杆菌同时具有这三种毒力基因。非溶血性肠毒素Nhe的三个亚基蛋白由nheA、nheB和nheC编码;三个亚基蛋白中,NheB对Nhe的毒性起着关键性的作用,而NheC过量则会对Nhe的毒性起抑制作用,但三者同时存在并表达时毒性最大。本研究的122株蜡样芽孢杆菌均检测到nheB基因,99%的菌株同时携带nheA、nheB和nheC基因;且发现5株蜡样芽孢杆菌同时携带nhe三个毒力基因和hbl三个毒力基因。除nhe和hbl基因外,所有菌株均携带entFM基因。有40株菌株携带bceT基因;有31株携带cytK基因。由此表明,nhe、entFM、hbl、bceT和cytK基因的检出率偏高,是我国食源性蜡样芽孢杆菌的主要毒力因子,与前人研究结果基本一致[24-26]。
遗传、环境等因素会造成细菌变异,蜡样芽胞杆菌也不例外。养殖过程长期使用抗生素会逐渐降低蜡样芽胞杆菌对药物的敏感性,使菌株产生耐药性。因此,研究蜡样芽胞杆菌菌株的耐药性具有重要意义。细菌对抗生素的耐药性主要和靶基因突变及对外界的抗逆性有关,与产生毒素的毒力基因关系较小。目前,由于蜡样芽孢杆菌对大部分β-酰胺类药物均有耐性,因此对其感染的推荐用药多为非β-酰胺类。本研究表明,分离得到的122株蜡样芽胞杆菌对氯霉素、庆大霉素、阿米卡星的敏感性均达到100%;对红霉素未出现耐药菌株,但已有部分中介菌株。由此可见,氯霉素、庆大霉素、阿米卡星和红霉素仍然可作为临床治疗推荐用药,但应警惕红霉素耐药蜡样芽孢杆菌的出现。四环素类抗生素在乳制品中的最大残留量为100 μg·kg-1[27]。常见致病菌多对四环素类抗生素产生耐药性,因此,目前四环素类抗生素仅用于支原体、衣原体、立克次体及军团菌的感染。本研究中约9%的菌株对四环素和复方新诺明表现出一定程度的耐药性,与Fei等[28]研究结果相比,本研究分离的蜡样芽孢杆菌对四环素的耐药性显著提高。因此,在临床用药方面应减少四环素的使用,且针对蜡样芽孢杆菌感染的治疗还应尽量避免β-内酰胺类抗生素、利福平及四环素类抗生素,可选用氯霉素类、氨基糖苷类和喹诺酮类抗生素。

