螺形龟甲轮虫形态结构对环境变化的响应
刘 璐,梁迪文,杨宇峰,金 鼎,叶晓彤,王 庆*
螺形龟甲轮虫形态结构对环境变化的响应
刘 璐1,2,梁迪文1,杨宇峰1,2,金 鼎1,叶晓彤1,王 庆1,2*
(1.暨南大学水生生物研究所,广东 广州 510632;2.南方海洋科学与工程广东省实验室(珠海),广东 珠海 519000)
以螺形龟甲轮虫为研究对象,于2015年7月至2018年12月,选取广东南澳岛及湖南常德中营养至中度富营养水体共14个样点进行采样,对螺形龟甲轮虫进行了形态特征测量分析.结果表明,水温是螺形龟甲轮虫形态变化最主要影响因子,且与背甲长、背甲宽、棘刺长度均呈显著负相关(<0.01).不同纬度条件下螺形龟甲轮虫形态参数差异显著,常德地区螺形龟甲轮虫个体显著大于南澳地区(<0.05).螺形龟甲轮虫形态存在显著季节性变化,各形态参数随季节波动呈现夏秋、冬春分化模式.螺形龟甲轮虫后棘刺长随水体营养程度增加而减小(=159.4,<0.01),富营养条件下后棘刺长度占全长的比例减小(=167.5,<0.01).研究结果表明,螺形龟甲轮虫棘刺长度可作为水质生物监测指标,并为研究全球气候变暖提供重要参考.
轮虫;表型可塑性;周期变形;生态指示;环境响应
表型可塑性是生物应对环境变化做出的相应表型适应,以水生无脊椎动物轮虫尤为显著.轮虫是淡水浮游动物群落的重要类群[1-2],也是微食物环的重要组成部分,对水环境变化敏感[3-4].轮虫的形态结构和生理机能等对水环境具有适应性,这种适应与生物有机体的表型可塑性相关,主要表现为周期变形[5].轮虫的周期变形是指种群内出现的轮虫形态随时间推移而发生周期性变化,包括轮虫体态大小、后棘刺长度变化和有无后侧棘刺等[6].周期变形使轮虫具有多态性,可影响轮虫生活史、种群动态和生态相互作用,在生物学上具有重要意义[7].目前,国内外已有一些关于轮虫周期变形的研究,主要基于室内受控条件,或面向单一淡水水体,探讨单一因素对轮虫表型可塑性的影响[8-9].
螺形龟甲轮虫(Gosse, 1851)隶属于单巢目、臂尾轮科、龟甲轮属,广泛分布于世界各地的淡水湖泊和池塘等水体[10-11],对不同温度、盐度、水体营养状态都具有较强耐受性,且在寡营养型水体中易占据优势地位[12].螺形龟甲轮虫具有较强的表型可塑性, 易于鉴定和测量,这使其成为轮虫多态性进化及对环境变化响应研究的理想模型[13-14].研究表明,螺形龟甲轮虫年平均后棘刺长度与纬度之间存在弱线性关系,后棘刺平均长度随纬度的增加而增加,与温度呈显著相关[15].且螺形龟甲轮虫后棘刺长度易受到食物资源波动的影响,能够间接反映水体营养状态[6].
目前,自然水体中螺形龟甲轮虫的多态性研究尚缺乏调查资料.本研究通过分析广东南澳、湖南常德不同水体螺形龟甲轮虫形态学特征(背甲长、背甲宽、前棘刺长、后棘刺长)与环境指标间的相关关系,比较不同环境条件下、不同异质性水体螺形龟甲轮虫多态性差异,探讨不同水体螺形龟甲轮虫对环境变化的适应特征,以期为区域环境变化和水质评价提供可参考的形态指示指标.
1 材料与方法
1.1 研究区域
广东南澳与湖南常德均处于亚热带季风气候区.南澳县位于粤东、南海与台湾海峡交界海域,距离大陆6km,是广东唯一的海岛县,岛上属于亚热带海洋性季风气候,年际温度变化小,具有冬无严寒,夏无酷暑,雨量充足、温暖湿润的特点[16-17].常德市位于湖南省西北部,属于亚热带季风气候,四季分明,年际温度变化较大,具有河网密布、水资源充沛、降雨不均的特点.穿紫河位于常德江北城区,东接柳叶湖,西连沅江,特有的河湖湿地生态系统造就了高异质性的生境[18-19].
1.2 轮虫的采集

图1 采样点分布
柳叶湖,L1~L8穿紫河,C1~C3南澳岛水库,S1~S3
于2015年7月~2018年12月,选取广东南澳岛果老山水库(S1)、黄花山水库(S2)、云澳水库(S3)及湖南常德河湖连通水系(穿紫河C1-C3、柳叶湖L1-L8)共14个样点作为调查对象(图1),进行季度采样.轮虫定量样品采用20µm浮游生物网过滤浓缩2L水样,置于50mL聚乙烯瓶,加入甲醛溶液至最终浓度为4%固定保存.轮虫定性样品采用40µm浮游生物网进行垂直和水平方向拖取,加入甲醛溶液至最终浓度为4%固定保存.水温、DO和pH值使用YSI-Plus多参数水质分析仪现场测定.总氮(TN)、总磷(TP)按国家水质标准GB3838-2002测定,Chl-a含量用丙酮分光光度法测定,水体透明度使用塞氏盘测定.
1.3 轮虫形态指标的测量
将固定好的样品浓缩至10mL,混匀后随机取1mL于1mL计数框,光学显微镜下随机挑取成熟螺形龟甲轮虫个体进行显微观察及形态测定.形态测量指标包括背甲长(LL)、背甲宽(LW)、前棘刺长(ASL)、后棘刺长(PSL),全长(TL)=LL+ASL+PSL(图2),各样点形态指标至少测定30个轮虫个体.
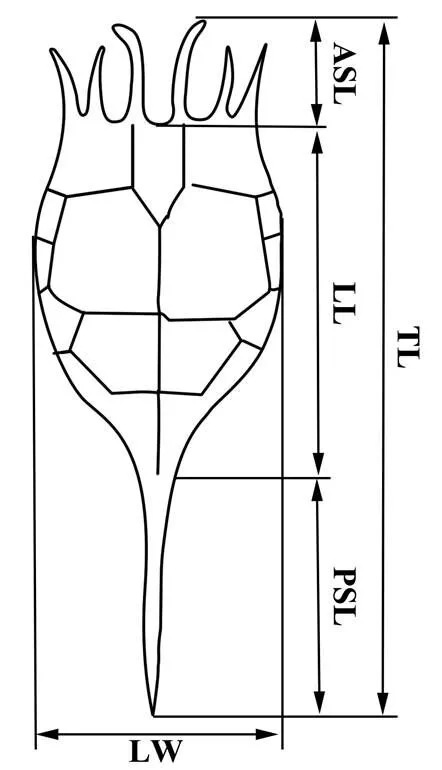
图2 螺形龟甲轮虫形态测量指标
ASL: 前棘刺长, LL: 背甲长, PSL: 后棘刺长, LW: 背甲宽, TL: 全长
1.4 数据分析与处理
用Excel软件对数据进行整理和归类.通过Graphpad Prism 7.0对符合正态分布的数据采用非配对检验(Unpairedtest)或单因素方差分析(One Way ANOVA),比较不同地区、不同季节、不同营养状态下体态参数的显著性差异,不满足方差齐性的数据进行校正(Welch's correction),对不符合正态分布的数据进行Kruskal-Wallis test分析.螺形龟甲轮虫形态指标与环境因子关系使用SPSS Statistics 22进行Pearson相关性分析.
采用修正的营养状态指数(TSIM)评价水体营养状态[20].分别选取Chl-a、SD、TP作为评价水体富营养化的基准参数,计算公式如下:

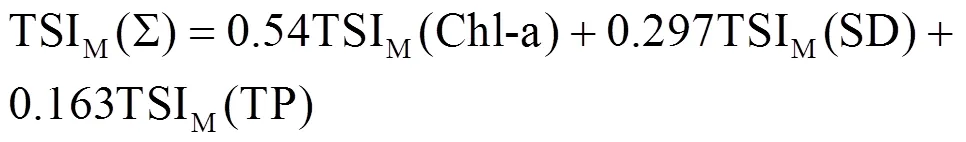
参照营养状态分级标准进行营养程度划分[21]. TSI(Σ)<30,为贫营养; 30£TSI(Σ)£50为中营养; 50< TSI(Σ)£60为轻度富营养60
2 结果与分析
2.1 水体理化环境特征
湖南常德和广东南澳地区采样水体各理化因子随季度呈现较大变化(表1).不同采样点水温为8.4~33.13℃,常德地区夏季水温高于冬季南澳地区秋季水温最高,其次是夏季,春季最低两地区冬季水温相差大.透明度最高值均出现在冬季,常德为(86.26±38.40)cm,南澳为(166.67±49.22)cm,各季节南澳水库站点平均透明度均大于常德水系.TN、TP最高值分别出现在秋季(9.88±1.78)mg/L和春季(0.27±0.09)mg/L的常德水系.pH值在7.66~8.22之间,各类型水体偏碱性,但未见有明显季节变化.常德地区水温、TN、DO呈夏秋-冬春分化,南澳地区水温、透明度、TN、Chl-a、TSI呈冬春夏-秋分化.

表1 常德及南澳水体环境因子参数平均值
注:*表示南澳DO值未进行测量,以NA表示无数据.
2.2 螺形龟甲轮虫体态参数的时空变化
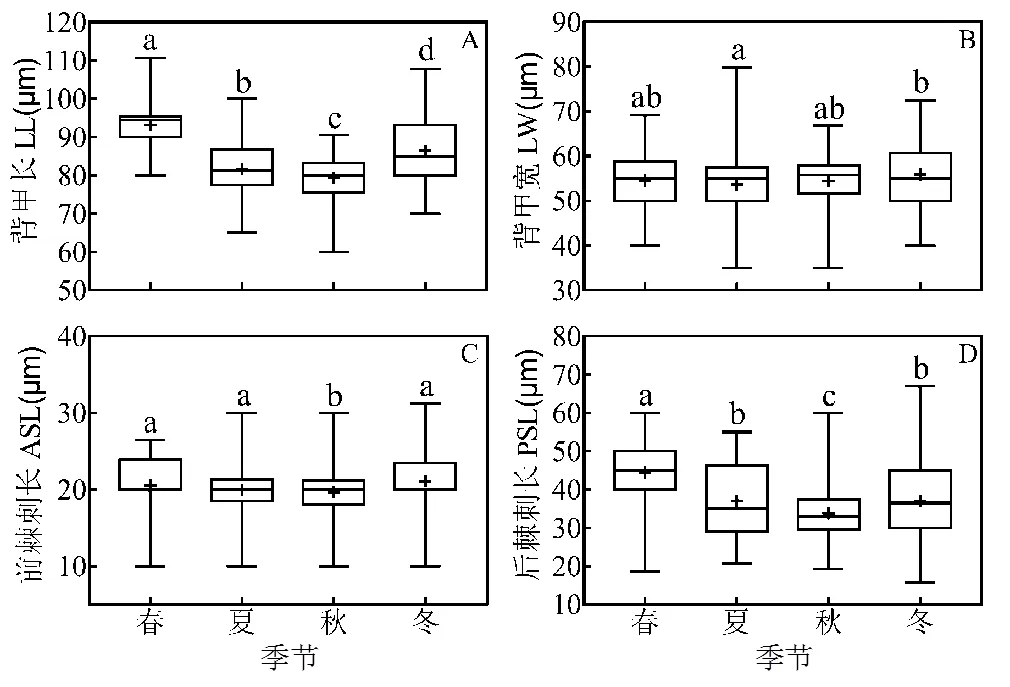
图3 螺形龟甲轮虫背甲长(A)、背甲宽(B)、前棘刺长(C)、后棘刺长(D)季节变化(Kruskal-Wallis test)
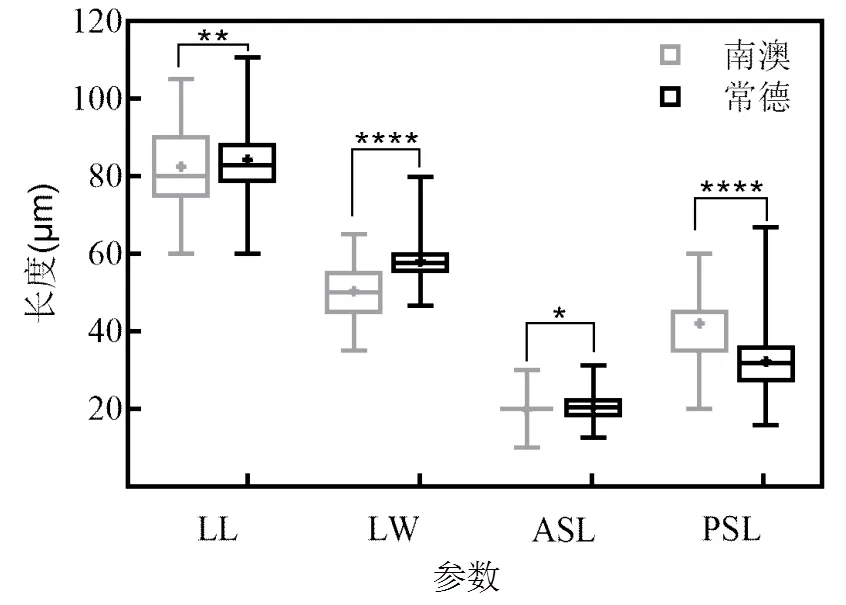
图4 常德和南澳螺形龟甲轮虫平均背甲长LL、背甲宽LW、前棘刺长ASL、后棘刺长PSL的比较(Mann-Whitney test)
共收集螺形龟甲轮虫828个,其中常德地区466个,南澳地区362个.调查显示,螺形龟甲轮虫各体态参数随季节波动呈现夏秋、冬春分化模式(图3).秋季背甲长(79.33±5.08)μm、前棘刺长(19.63± 3.14)μm、后棘刺长(33.77±6.08)μm显著低于其他季节(<0.05).背甲长、后棘刺长呈现秋季<夏季<冬季<春季的趋势.
南澳地区螺形龟甲轮虫平均背甲长(82.51± 5.84)μm、背甲宽(50.30±5.09)μm和前棘刺长(19.79±3.99)μm均显著小于常德地区轮虫(<0.05,图4),而后棘刺长(42.03±7.52)μm显著大于常德地区(32.29 ±7.41)μm轮虫(<0.05).

图5 常德和南澳螺形龟甲轮虫不同季节背甲长、背甲宽、前棘刺长、后棘刺长大小频度分布
常德螺形龟甲轮虫体态参数频度分布显示,相对于水温较低的冬春季节,夏秋季螺形龟甲轮虫背甲长、背甲宽及后棘刺长较小,前棘刺长分布主要集中于20μm冬春季出现背甲长度超过100μm、后棘刺长超过50μm的个体,即冬春季节螺形龟甲轮虫的体型更大,棘刺更长(图5a).南澳螺形龟甲轮虫体态参数频度分布显示,相较于秋冬季,春夏季节螺形龟甲轮虫背甲长、背甲宽及后棘刺较长,在频度图中呈右偏分布,春季各体态参数较其他季节分布集中且高于其它季节(图5b).
2.3 螺形龟甲轮虫体态参数对环境因子的响应
相关分析显示,水温与背甲长、背甲宽、前棘刺长和后棘刺长均呈极显著负相关(<0.01).随着水温升高,轮虫个体体型变小、棘刺变短(表2).透明度与背甲宽呈显著负相关(=-0.377,<0.01),与后棘刺呈显著正相关(=0.581,<0.01).背甲宽与Chl-a及TN、TP均呈极显著正相关,而后棘刺随Chl-a及TN、TP的升高而减小(<0.01).DO与各体态参数均呈极显著正相关(<0.01).pH值与背甲长、背甲宽和前棘刺长呈极显著负相关(<0.01),TSI与背甲宽呈极显著正相关,与棘刺长度呈不同程度负相关(<0.05),在营养条件越丰富、温度越高的水体中,螺形龟甲轮虫的后棘刺长越短.结果表明,环境因子的变化对后棘刺长具有显著影响.

表2 螺形龟甲轮虫背甲长、背甲宽、前棘刺长、后棘刺长与环境因子的Pearson相关性分析
注:* 表示< 0.05**表示< 0.01
2.4 螺形龟甲轮虫体态参数与水体营养状态的关系
螺形龟甲轮虫后棘刺长在中营养水体中显著高于富营养水体(图6).中营养状态水体螺形龟甲轮虫平均后棘刺长为(39.49±8.72)μm,显著高于轻度富营养(33.63±7.10)μm、中度富营养(31.53±9.46)μm和重度富营养(32.63±7.46)μm状态水体轮虫(<0.01).轻度富营养状态水体螺形龟甲轮虫个体平均体长(79.21±5.88)μm、体宽(52.55±5.80)μm显著低于其他营养水平水体(<0.01,图6).
后棘刺长与水体营养状态相关性分析表明,螺形龟甲轮虫后棘刺长随水体营养状态增加而降低(=159.4,<0.01),同时背甲长度无明显变化(=67.5,<0.01图7),形态特征表现为营养程度越高后棘刺越短.
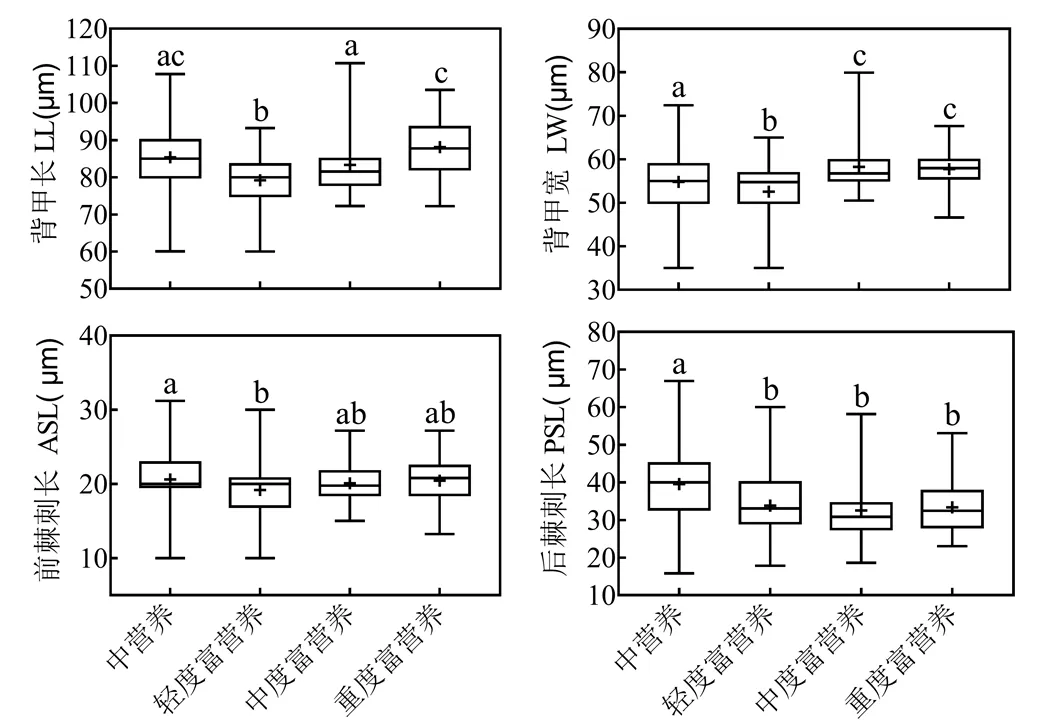
图6 不同水体营养状态条件下螺形龟甲轮虫背甲长、背甲宽、前棘刺长、后棘刺长均值的比较(Kruskal-Wallis test)
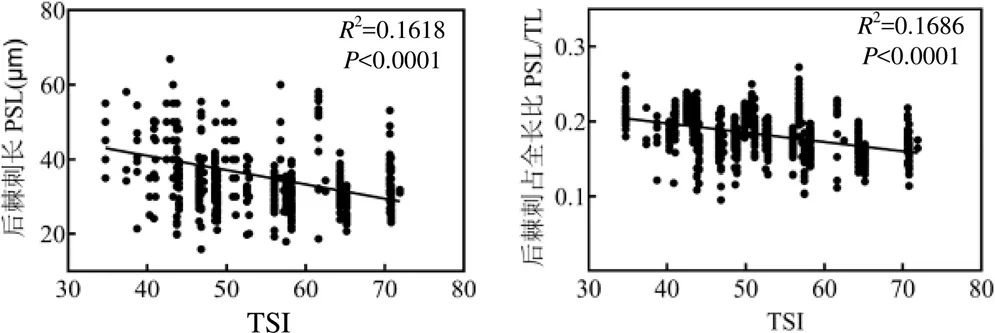
图7 螺形龟甲轮虫后棘刺长PSL、PSL/TL与水体营养状态线性回归分析
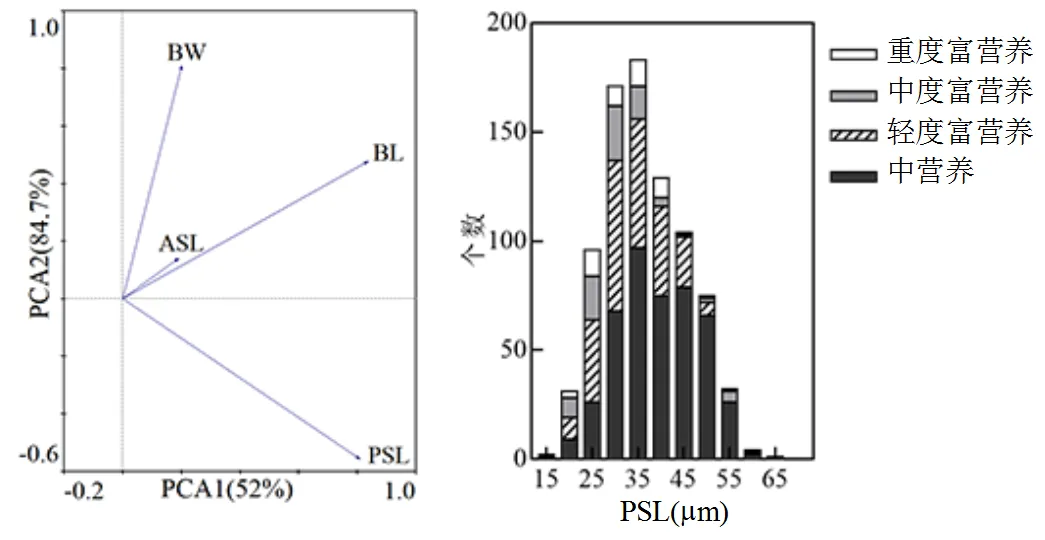
图8 螺形龟甲轮虫背甲长LL、背甲宽LW、前棘刺长ASL、后棘刺长PSL及环境因子的PCA主成分分析图(a);不同营养状态螺形龟甲轮虫后棘刺长PSL频率分布直方图 (b)
PCA结果显示,后棘刺长度不受背甲长度的影响(图8).轻度富营养条件下,螺形龟甲轮虫后棘刺长度主要分布于20~50μm区间,中度富营养及重度富营养状态下,后棘刺超过40μm的螺形龟甲轮虫个体几乎未出现.后棘刺长度为60μm以上个体仅在中营养水体中出现(图8).
3 讨论
研究表明,影响轮虫周期变形的非生物因素主要有水温、氮磷含量、Chl-a、透明度、pH值等[22-23],生物因素如食物浓度、个体竞争[6]、种间捕食关系[24-25]、捕食者组成[26]等因素决定的上、下行效应也显著影响轮虫的形态结构.Chl-a在一定程度上能够反映食物资源丰度,食物浓度是影响螺形龟甲轮虫体长变化的重要因素[12,24].在低温和低食物浓度条件下,轮虫将能量主要用于体态和棘刺的生长,以提高竞争能力、捕食防御能力和生存机会[27].
3.1 水温显著影响亚热带湖库中螺形龟甲轮虫的周期变形
水温是影响轮虫形态变化的关键环境因子之一.螺形龟甲轮虫后棘刺平均长度及其变化幅度(SD)随纬度增加而增加,温度显著影响后棘刺长度变化,且随纬度增加轮虫热耐受性增加[15].常德和南澳水温变化显著影响螺形龟甲轮虫的背甲长、背甲宽、前棘刺长、后棘刺长的季节变化,这种季节性变化可能受到热耐受性和表型可塑性大小的驱动.基于单一水体的调查表明,螺形龟甲轮虫的体态大小主要受水温影响[8,28].室内实验表明,个体大小及棘刺长度随水温的升高而减小,且在低温条件下,螺形龟甲轮虫将更多的能量用于生长发育[23].水温是影响轮虫寿命的关键环境因素,在较低水温条件下,轮虫生长速度慢,使得同一时期存在较多大型个体[6,29]低温显著提高轮虫存活率,且当低温暴露发生在生命周期的早期时,低温所致寿命延长效应最大,更长的生存生长时间会产生更大的轮虫个体[5,30].敲除轮虫特定基因可以完全消除低温寿命延长效应,可能原因是由温度变化引起的遗传调节在温度介导的寿命延长过程中比被动热力学效应作用更大[30].水温升高加速轮虫的生长,产生具有较短棘刺的小型个体[27].
目前大多学者认可温度-大小规则(temperature-size rule).该规则指物种体态大小对温度的表型可塑性适应,体态大小会随环境温度升高而减小[31-33].常德和南澳地区螺形龟甲轮虫体态参数存在显著性差异(<0.05,图4图5),水温是螺形龟甲轮虫形态变化最主要的影响因子.南澳、常德位于不同纬度地区,纬度条件影响水温的季节变化,常德水温波动范围大,低温区间明显,导致螺形龟甲轮虫个体体型显著大于南澳个体.
3.2 水体营养状态对螺形龟甲轮虫周期变形的影响
调查发现,水体由中营养型过渡到超富营养型,浮游动物个体趋小[34].龟甲轮属轮虫是浮游动物分布最广的类群之一,以滤食形式摄食水体中悬浮颗粒物及浮游植物,具有较高的生态耐受性,在贫营养、富营养型水体中均可生存[35-36],其形态指标随水体营养状态改变表现出较大差异[28].水体营养状态反映浮游植物生存条件的优劣,浮游植物等食物资源对螺形龟甲轮虫个体大小影响密切.轮虫体态的变化反映食物清除率的增加或减少,是对食物资源波动的响应,往往较大个体具有更高的清除率,且在食物密度较高、捕食者密度较小的条件下,轮虫倾向于将能量用于繁殖后代的生活史对策,体态增长的同时将较少的能量用于棘刺生长[6,25].因此,当Chl-a含量升高时,常德、南澳水体螺形龟甲轮虫背甲宽增加而后棘刺长度减小,一定范围内,随水体营养状态增加后棘刺长及其占全长的比例减小(图6图7),后棘刺长度在60μm以上个体仅在中营养水体中出现(图7).
3.3 螺形龟甲轮虫形态参数的潜在生态指示功能
浮游动物的生态指示作用已被广泛应用于水质评价[37-38].研究表明,浮游甲壳动物的个体大小可作为湖泊生态状况的良好指标.枝角类僧帽溞在贫营养状态下生长良好,体长、体宽随营养状态的增加而减小[39].桡足类体长随温度升高而减小,同时种群热耐受性(thermal tolerance)增强,相比于具有更大形态变异度的高纬度地区种群,低纬度地区种群热耐受性较低,易于受到气候变暖的影响[40].热耐受性与表型可塑性强度的负相关关系可维持短寿命生物多态性平衡[41].
由于生命周期短,对环境条件变化反应迅速,轮虫的生态指示功能受到广泛关注.轮虫种类组成[42]、总丰度[43]等被广泛应用于水环境评估,但传统指示指标都存在局限性.轮虫营养状态综合指数(TSIROT)可作为温带湖泊营养状态的评估指标,但在高浓度铵的水体中指示结果可信度低,且该指数不适用于半咸水水体水质评价[44-45].相对于物种组成,轮虫丰度能够更客观地反映亚热带浅水湖泊营养状态[43].龟甲轮虫指数(KIN)仅作为河口营养状态的有效指示指标[46].
轮虫临界食物浓度随体态增加而增大,体态小的轮虫在贫营养型水体占优势[47-48].在受煤灰污染的水体中,体态小的轮虫占据竞争优势,且卵大于正常生境[49].螺形龟甲轮虫的生境偏好性导致其产生较大形态学差异,近年来受到研究者的广泛关注.有研究将螺形龟甲轮虫定为富营养指示种[50],对广东省水库的调查发现,螺形龟甲轮虫是寡营养型水库中浮游轮虫群落组成的绝对优势种[12].研究表明,螺形龟甲轮虫后棘刺长可反映温度及食物浓度的变化[28].高温下,短棘刺或无棘刺型螺形龟甲轮虫占主导[27].后棘刺长的螺形龟甲轮虫个体仅出现在低温环境[8].螺形龟甲轮虫后棘刺的生长主要受食物资源的控制,中营养流域种群中后棘刺较长[28].
4 结论
4.1 水温是螺形龟甲轮虫形态变化最主要影响因子,随水温升高螺形龟甲轮虫体形趋小.不同纬度条件下螺形龟甲轮虫形态参数差异显著,常德地区螺形龟甲轮虫个体显著大于南澳地区.螺形龟甲轮虫形态存在显著季节性变化,各体态参数随季节波动呈现夏秋、冬春分化模式.
4.2 本研究的湖库水体均为中、富营养状态,螺形龟甲轮虫后棘刺长与水体营养状态呈负相关关系,富营养条件下后棘刺长度占全长的比例减小.
4.3 螺形龟甲轮虫在不同营养条件下的广泛分布和其较高的表型可塑性使其具有成为生态指示物种的潜力,形态变化及棘刺长度可反映湖库水体营养状态,对水温的敏感性适应可作为全球变暖区域响应的指示指标.深入研究轮虫形态受环境影响的变化规律,可为环境保护和治理提供科学依据.
[1] Liang D, Wei N, Wang Q, et al. Influence of hydrological heterogeneity on rotifer community structure in three different water bodies in Shantou Area, Guangdong (China) [J]. Zoological Studies, 2019,58:23.
[2] Segers H, De Smet W H. Diversity and endemism in Rotifera: A review, andBory de St Vincent [J]. Biodiversity and Conservation, 2008,17(2):69-82.
[3] May L, Spears B M, Dudley B J, et al. The response of the rotifer community in Loch Leven, UK, to changes associated with a 60% reduction in phosphorus inputs from the catchment [J]. International Review of Hydrobiology, 2014,99(1/2):65-71.
[4] Duggan I, Green J, Shiel R. Distribution of rotifers in North Island, New Zealand, and their potential use as bioindicators of lake trophic state [J]. Hydrobiologia, 2001,446:155-164.
[5] 葛雅丽,席贻龙,马 杰,等.温度对矩形龟甲轮虫生命表统计学参数和形态特征的影响 [J]. 应用生态学报, 2011,22(5):1287-1294.
Ge Y L,Xi YL, Ma J, et al. Effects of temperature onlife table demography and morphometric characteristics [J]. Chinese Journal of Applied Ecology, 2011,22(5):1287-1294.
[6] Diéguez M, Modenutti B, Queimaliños C. Influence of abiotic and biotic factors on morphological variation of(Gosse) in a small Andean lake [J]. Hydrobiologia, 1998:387-388.
[7] Gilbert J J. No-genetic polymorphisms in rotifers: environmental and endogenous controls, development, and features for predictable or unpredictable environments [J]. Biological Reviews, 2017,92(2):964- 992.
[8] Green J. Morphological variation of(Gosse) in a backwater of the River Thames [J]. Hydrobiologia, 2005,546(1):189- 196.
[9] Gilbert J J. Predator-specific inducible defenses in the rotifer[J]. Freshwater Biology, 2009,54(9):1933-1946.
[10] Green J.(Gosse) in Africa [J]. Hydrobiologia, 1987,147:3-8.
[11] Segers H. Annotated checklist of the rotifers (Phylum Rotifera), with notes on nomenclature, taxonomy and distribution [J]. Zootaxa, 2007, 1564(1):1-104.
[12] 林秋奇,赵帅营,韩博平.广东省水库轮虫分布特征 [J]. 生态学报, 2005,25(5):1123-1131.
Lin Q Q, Zhao S Y, Han B P. Rotifer distribution in tropical reservoirs, Guangdong Province, China [J].Acta Ecologica Sinica, 2005,25(5): 1123-1131.
[13] Cieplinski A, Weisse T, Obertegger U. High diversity in(Rotifera, Monogononta): morphological and genetic evidence [J]. Hydrobiologia, 2017,796(1):145-159.
[14] Ramos-Rodríguez E, Moreno E, Conde-Porcuna J M. Intraspecific variation in sensitivity to food availability and temperature-induced phenotypic plasticity in the rotifer[J]. Journal of Experimental Biology, 2020,223(7).
[15] Zhang H, Brönmark C, Hansson L A. Predator ontogeny affects expression of inducible defense morphology in rotifers [J]. Ecology, 2017,98(10):2499-2505.
[16] 乔永民,顾继光,杨 扬,等.南澳岛海域表层沉积物重金属分布、富集与污染评价 [J]. 热带海洋学报, 2010,29(1):77-84.
Qiao Y M, Gu J G, Yang Y, et al. The distribution, enrichment and pollution assessment of heavy metals in surface sediments of sea areas around the Nanao Island [J]. Journal of Tropical Oceanography, 2010, 29(1):77-84.
[17] 任玉正,柯志新,谭烨辉,等.广东省南澳岛东部海域浮游动物群落结构及其影响因素 [J]. 热带海洋学报, 2020,39(2):65-76.
Ren Y Z, Ke Z X, Tan Y H, et al. Community structure of zooplankton and its influencing factors in the eastern waters of Nan’ao Island, Guangdong [J]. Journal of Tropical Oceanography, 2020,39(2):65-76.
[18] 袁 皓.常德市穿紫河水环境质量监测与评价 [J]. 资源节约与环保, 2013,(12):161-161.
Yuan H. Environmental quality monitoring and evaluation of Chuanzi River in Changde city [J]. Resource Conservation and Environmental Protection, 2013,(12):161.
[19] 叶晓彤,梁迪文,王 庆,等.洞庭湖流域常德柳叶湖及其邻近水体轮虫群落结构变化及其对环境因子的响应 [J]. 湖泊科学, 2020, 32(4):1126-1139.
Ye X T, Liang D W, Wang Q, et al. Variation of the rotifer community structure and its responses to environmental factors in Lake Liuye and its adjacent waters in Changde City, Lake Dongting Basin [J]. Journal of Lake Sciences, 2020,32(4):1126-1139.
[20] 杨梅玲,胡忠军,刘其根,等.利用综合营养状态指数和修正的营养状态指数评价千岛湖水质变化(2007年-2011年) [J]. 上海海洋大学学报, 2013,22(2):240-245.
Yang M L, Hu Z J, Liu Q G, et al. Evaluation of water quality by two trophic state indices in Lake Qiandaohu during 2007~2011 [J]. Journal of Shanghai Ocean University, 2013,22(2):240-245.
[21] 郑丙辉,张 远,富 国,等.三峡水库营养状态评价标准研究 [J]. 环境科学学报, 2006,26(6):1022-1030.
Zheng B H, Zhang Y, Fu G, et al. On the assessment standards for nutrition status in the Three Gorge Reservoir [J]. Acta Scientiae Circumstantiae, 2006,26(6):1022-1030.
[22] West-Eberhard M J. Developmental plasticity and evolution [M]. Oxford: Oxford University Press, 2003.
[23] Ge Y, Xi Y, Ma J, et al. Factors influencing morphological characteristics ofin Lake Tingtang [J]. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, 2018,88(1):421-428.
[24] Stemberger R S, Gilbert J J. Spine development in the rotifer: induction by cyclopoid copepods and[J]. Freshwater Biology, 1984,14(6):639-647.
[25] 殷旭旺,赵 文,毕进红,等.卜氏晶囊轮虫对4种臂尾轮虫形态可塑性的影响 [J]. 大连水产学院学报, 2009,24(6):494-496.
Yin X W, Zhao W, Bi J H, et al. Rotiferinduced morphological plasticity in fourrotifer species [J]. Journal of Dalian Fisheries University. 2009,24(6):494-496.
[26] Green J. Morphological variation of(Gosse) in Myanmar (Burma) in relation to zooplankton community structure [J]., 2007,593(1):5-12.
[27] Bielañska-Grajner I. Influence of temperature on morphological variation in populations of(Gosse) in Rybnik Reservoir [J]., 1995,313-314(1).
[28] Hillbricht-Ilkowska A. Morphological variation of(Gosse) in Lake Biwa, Japan [J]., 1983, 104(1).
[29] Ruttner-Kolisko A. The vertical distribution of plankton rotifers in a small alpine lake with a sharp oxygen depletion () With 7 figures in the text [J]. Internationale Vereinigung für Theoretische und Angewandte Limnologie: Verhandlungen, 1975, 19(2):1286-1294.
[30] Johnston R K, Snell T W. Moderately lower temperatures greatly extend the lifespan of(Rotifera): Thermodynamics or gene regulation? [J]. Experimental gerontology, 2016,78:12-22.
[31] Tabi A, Garnier A, Pennekamp F. Testing multiple drivers of the temperature-size rule with nonlinear temperature increase [J]. Functional Ecology, 2020,34(12):2503-2512.
[32] Forster J, Hirst A G. The temperature-size rule emerges from ontogenetic differences between growth and development rates [J]. Functional Ecology, 2012,26(2):483-492.
[33] 张 锐,朱艺峰,赵圣男,等.电厂增温对中小型浮游动物群落结构的影响[J]. 中国环境科学, 2020,40(2):839-850.
Zhang R, Zhu Y F, Zhao S N, et al. Effects of temperature increase on meso-and micro-zooplankton community in thermal discharge seawaters near Guohua Power Plant [J]. China Environmental Science, 2020,40(2):839-850.
[34] 黄祥飞,陈雪梅,伍焯田,等.武汉东湖浮游动物数量和生物量变动的研究 [J]. 水生生物学集刊, 1984,(3):345-358.
Huang X F, Chen X M, Wu Z T, et al. Studies on the changes in abundance and biomass of zooplankton in lake Donghu, Wuhan [J]. Acta Hydrobiologica Sinica, 1984,(3):345-358.
[35] 李共国,虞左明.千岛湖轮虫群落结构及水质生态学评价 [J]. 湖泊科学, 2003,(2):169-176.
Li G G, Yu Z M. Community structure of Rotifera and ecological assessment of water quality in Qiandao Lake [J]. Journal of Lake Sciences, 2003,(2):169-176.
[36] 郭 凯,赵 文,殷守仁,等.北京官厅水库轮虫群落结构与水体富营养化状况 [J]. 湖泊科学, 2010,22(2):256-264.
Guo K, Zhao W, Yin S R, et al. Relationship between eutrophication status of the water body and rotifer community structure in Guanting Reservoir, Beijing [J]. Journal of Lake Sciences, 2010,22(2):256-264.
[37] 李 玲,刘 玉,于 菲,等.广州市谷河轮虫群落结构及水体黑臭水平 [J]. 中山大学学报(自然科学版), 2020,59(3):73-81.
Li L, Liu Y, Yu F, et al. Community structure of rotifera and black- odor level analysis in Gu River of Guangzhou city [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2020,59(3):73-81.
[38] 许木启.从浮游动物群落结构与功能的变化看府河-白洋淀水体的自净效果 [J]. 水生生物学报, 1996,(3):212-220.
Xu M Q. Evaluation of self-purification efficiency of Fuhe stream- Baiyangdian Lake through zooplankton [J]. Acta Hydrobiologica Sinica. 1996,(3):212-220.
[39] Karpowicz M, Sługocki Ł, Kozłowska J, et al. Body size ofas an indicator of the ecological status of temperate lakes [J]. Ecological Indicators, 2020,117:106585.
[40] Sasaki M, Hedberg S, Richardson K, et al. Complex interactions between local adaptation, phenotypic plasticity and sex affect vulnerability to warming in a widespread marine copepod [J]. Royal Society open science, 2019,6(3).
[41] Sasaki M C, Dam H G. Genetic differentiation underlies seasonal variation in thermal tolerance, body size, and plasticity in a short‐lived copepod [J]. Ecology and evolution, 2020,10(21):12200-12210.
[42] May L, O’Hare M. Changes in rotifer species composition and abundance along a trophic gradient in Loch Lomond, Scotland, UK [J]., 2005,546(1).
[43] Wen X L, Xi Y L, Qian F P, et al. Comparative analysis of rotifer community structure in five subtropical shallow lakes in East China: role of physical and chemical conditions [J]., 2011, 661(1):303-316.
[44] Jurczak T, Wojtal-Frankiewicz A, Frankiewicz P, et al. Comprehensive approach to restoring urban recreational reservoirs. Part 2-Use of zooplankton as indicators for the ecological quality assessment [J]. Science of the Total Environment, 2019,653:1623-1640.
[45] Gutkowska A, Paturej E, Kowalska E. Rotifer trophic state indices as ecosystem indicators in brackish coastal waters [J]. Oceanologia, 2013,55(4):887-899.
[46] Gopko M, Telesh I V. Estuarine trophic state assessment: new plankton index based on morphology ofrotifers [J]. Estuarine, Coastal and Shelf Science, 2013,130:222-230.
[47] Stemberger R S, Gilbert J J. Body size, food concentration, and population growth in planktonic rotifers [J]. Ecology, 1985,66(4): 1151-1159.
[48] 赵帅营,韩博平.大型深水贫营养水库——新丰江水库浮游动物群落分析 [J]. 湖泊科学, 2007,(3):305-314.
Zhao S Y, Han B P. Structural analysis of zooplankton community in a large deep oligotrophic reservoir- Xinfengjiang Reservoir, South China [J]. Journal of Lake Sciences,2007,(3):305-314.
[49] Ying H X, Xiao X Y, Gen Z, et al. Morphological differentiation ofcaused by predation and coal ash pollution [J]. Scientific Reports, 2017,7(1).
[50] Mäemets A. Rotifers as indicators of lake types in Estonia [J]., 1983,104(1):357-361.
The responses of morphological variation ofto environmental changes.
LIU Lu1,2, LIANG Di-wen1, YANG Yu-feng1,2, JIN Ding1, YE Xiao-tong1, WANG Qing1,2*
(1.Institute of Hydrobiology, Jinan University, Guangzhou 510632, China;2.Southern Marine Science and Engineering Guangdong Laboratory, Zhuhai 519000, China)., 2021,41(11):5326~5333
In this study, to measure and analyze the morphometric parameters of., 14sites were selected in Nan’ao Island, Guangdong Province and Changde city, Hunan Province with different water trophic statuses from mesotrophic to moderate-eutrophic. Samples were collected quarterly from July 2015 to December 2018. The results showed that the water temperature was the most important factor affecting the morphological changes of.and had a significant negative correlation with lorica length, lorica width and spine length (<0.01). There were significant differences in morphometric parameters of.in different latitudes, with individuals from Changde area being significantly larger than those in Nan'ao (<0.05). There were also significant seasonal changes in the morphology of., and the morphological parameters of this species showed different pattern between summer-autumn and winter-spring. The length of the posterior spines of.decreased with the increased of nutrient loading (=159.4,<0.01), and the ratio of the length of the posterior spines to the total length of rotifer decreased under eutrophic condition (=167.5,<0.01). The results showed that the spine length of.can be used as a biological monitoring index of water quality, and provided an important reference for the study of global warming.
rotifer;phenotypic plasticity;cyclomorphosis;ecological indicator;environmental response
X17
A
1000-6923(2021)11-5326-08
刘 璐(1998-),女,湖南省长沙人,暨南大学硕士研究生,主要从事轮虫生态学研究.
2021-03-04
国家自然科学基金资助项目(41673080);南方海洋科学与工程广东省实验室(珠海)课题(311021006);广东省自然科学基金资助项目(2021A1515010814)
* 责任作者, 副研究员, wq2010@jnu.edu.cn
———在龟甲、兽骨上刻字的朝代

