低磷胁迫对柱花草生长及抗氧化系统的影响
王金鹏,廖丽,刘国道,罗丽娟,刘攀道,王志勇
摘 要:以基因型TF291柱花草为供试材料,分析低磷处理(5 μmol/L)对柱花草生长、抗氧化物质及抗氧化保护酶的影响,探索柱花草抗氧化系统在低磷胁迫下的响应机制。结果表明:(1)与对照磷处理(250 μmol/L)相比,低磷处理抑制了柱花草生长,其叶绿素浓度、最大光化学效率、地上部和根部生物量均显著降低(P<0.05)。(2)随着低磷处理时间的增加,15 d时叶片CAT、POD、SOD、ASP、PAL活性和类黄酮含量显著提升(P<0.05);30 d时叶片CAT、SOD、ASP、PPO活性和MDA、H2O2含量显著提高(P<0.05)。本研究结果可为进一步探索低磷胁迫下柱花草抗氧化系统的分子响应机制提供重要依据。
关键词:柱花草;活性氧;低磷胁迫;抗氧化系统
中图分类号:S541 文献标识码:A
Effects of Low Phosphorus Stress on the Growth and Antioxidant System of Stylosanthes
WANG Jinpeng1, LIAO Li1, LIU Guodao2, LUO Lijuan1, LIU Pandao2*, WAMG Zhiyong3*
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Tropical Crop Genetic Resources Institute, Chinese Academy of Tropical Agriculture Sciences / Key Laboratory of Crop Gene Resources and Germplasm Enhancement in Southern China, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101, China; 3. Key Laboratory of Genetics and Germplasm Innovation of Tropical Special Forest Trees and Ornamental Plants, Ministry of Education / College of Forestry, Hainan University, Haikou, Hainan 570228, China.
Abstract: Using genotype TF291 as the test material, the effects of low phosphorus treatment (5 μmol/L) on the growth, antioxidant and antioxidant enzymes of Stylosanthes were analyzed to explore the response mechanism of the antioxidant system of Stylosanthes under low phosphorus stress. Compared with the control p treatment (250 μmol/L), the low p treatment inhibited the growth of stylox, and the chlorophyll concentration, maximum photochemical efficiency, abovementium and root biomass were significantly reduced (P<0.05). With the increase of the treatment time of low phosphorus, the activity of CAT, POD, SOD, ASP, PAL and the content of flavonoids in leaves were significantly increased at 15 d (P<0.05). The activity of CAT, SOD, ASP, PPO and content of MDA and H2O2 in leaves were significantly increased at 30 d (P<0.05). The study would provide an important basis for further exploring the molecular response mechanism of the antioxidant system of Stylosanthes cylindrica under low phosphorus stress.
Keywords: Stylosanthes; reactive oxygen species; low phosphorus stress; antioxidant system
DOI: 10.3969/j.issn.1000-2561.2021.10.017
全球范圍内,酸性土壤分布广泛,在农业生产中占有重要地位,其中只有12%的土地可用于种植农作物[1]。酸性土壤在我国南方分布广泛,易引起磷、钾、镁等元素的缺乏,不利于植物生长[2]。磷是植物生长所必需的大量营养元素之一,与植物的代谢过程密切相关[3]。同时它是核酸等生物大分子的组成成分,在参与酶活性调节、光合作用等过程中发挥着重要作用[4]。在酸性土壤中,铁、铝等元素活性较高,易与磷素形成难溶性的化合物,使施入土壤中的肥料磷和土壤中的可溶性无机磷固定形成难溶性沉淀物,致使酸性土壤缺乏植物吸收利用的有效磷[5]。植物缺磷影响细胞分裂,减少植株分蘖,致使植株矮小、叶片暗绿、根系发育受阻。由于有效磷吸收的减少,植物体内光合色素减少、蛋白质合成受阻和酶活性发生改变,诱导光抑制并改变代谢途径,对植物的生存造成严重威胁,影响植物进行正常的生命活动。此外,低磷环境下增加了植物体内活性氧(ROS)的积累,即O2、O2-、H2O2和OH–,这些过量的活性氧影响植物正常的代谢活动[6]。
柱花草(Stylosanthes spp.)是世界上广泛种植的豆科牧草,主要分布在我国南方地区,在我国海南、云南、广东、广西、贵州、福建等地区广泛种植,具有耐酸瘠土壤、适口性好、抗旱性强、产量高等特点,主要用于饲喂牲畜、水土保持、果草间作,具有较高的经济效益及在生态工程建设中起着重要作用[7]。相对苜蓿、绿豆、豌豆等豆科植物,柱花草对酸性低磷土壤具有较强的适应性[8-9],是探索植物响应低磷胁迫机理的良好研究材料。目前,已有学者在柱花草耐低磷基因型筛选、磷利用效率评价、根系构型变化、酸性磷酸酶活性及耐低磷差异基因的表达等方面均有研究。但关于柱花草在低磷环境对抗氧化系统变化的影响研究较少,其适应低磷胁迫的潜在机制仍不明确。水稻、玉米、大豆、苜蓿等植物在逆境胁迫下抗氧化系统的响应及作用机制已较为清楚[10]。过量的活性氧积累是生物分子氧化的原因之一,对植物生长发育造成不利的影响[11]。因此,本试验以前期研究所筛选出的耐低磷柱花草品种为受试材料,研究了低磷胁迫下柱花草生长情况、抗氧化物质含量和抗氧化保护酶的变化,进而探究柱花草抗氧化系统的应激变化和作用机制,以期为培育耐低磷新品种提供理论指导和参考依据。
1 材料与方法
1.1 材料
材料为较耐低磷品种,编号为TF291号柱花草。
1.2 方法
1.2.1 试验设计 参照陈志坚等[12]的方法,挑选籽粒饱满的柱花草种子置于黑暗处萌发2~3 d,将长势一致的幼苗种植于打好孔的黑色泡沫板上,缝隙用海绵填充,然后将泡沫板放在15 L盆上进行营养液培养,盆的外部用黑色塑料布包裹。柱花草幼苗正常培养7 d后,进行2个磷浓度处理,磷浓度分别为5 μmol/L(LP)和250 μmol/L(HP)KH2PO4,营养液为1/2 Hoagland溶液,培养期间每5 d换1次营养液,每3 d调节pH至5.8~6.0。在处理的第15、30天分别收取地上部及根部样品,用于各项生理指标的测定。
1.2.2 叶绿素含量测定 称取新鲜叶片0.1 g,用去离子水洗净擦干,剪碎后加入80%丙酮研磨,将叶片研磨变白并静置10 min,用干滤纸过滤至25 mL容量瓶中,用80%丙酮定容避光保存,用分光光度计分别测定叶绿素溶液在663、645 nm处吸光度并计算叶绿素含量。
1.2.3 全磷含量的测定 在105 ℃下分别将柱花草地上部和根部样品杀青30 min,85 ℃烘干并称取样品干重,分别称取地上部和根部样品0.1 g于25 mL消煮管中,加入80%浓硫酸3 mL溶解样品并静置2 h,将消煮管置于电炉上加热2 h,将消煮完全的消煮液定容并静置。将消煮液用于连续流动分析仪(法国Alliance)测定全磷浓度,计算全磷含量。
1.2.4 抗氧化物质含量和抗氧化酶活性的测定 抗氧化物质(丙二醛、过氧化氢、总酚、类黄酮)含量和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(ASP)、苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)活性均采用试剂盒(南京建成生物技术有限公司)并按照试剂盒说明书测定。以上每个指标测定设置4个重复。
1.3 数据处理
采用Origin9.1作图,用SPSS 24.0(SPSS Institute,美国)软件进行方差分析。
2 结果与分析
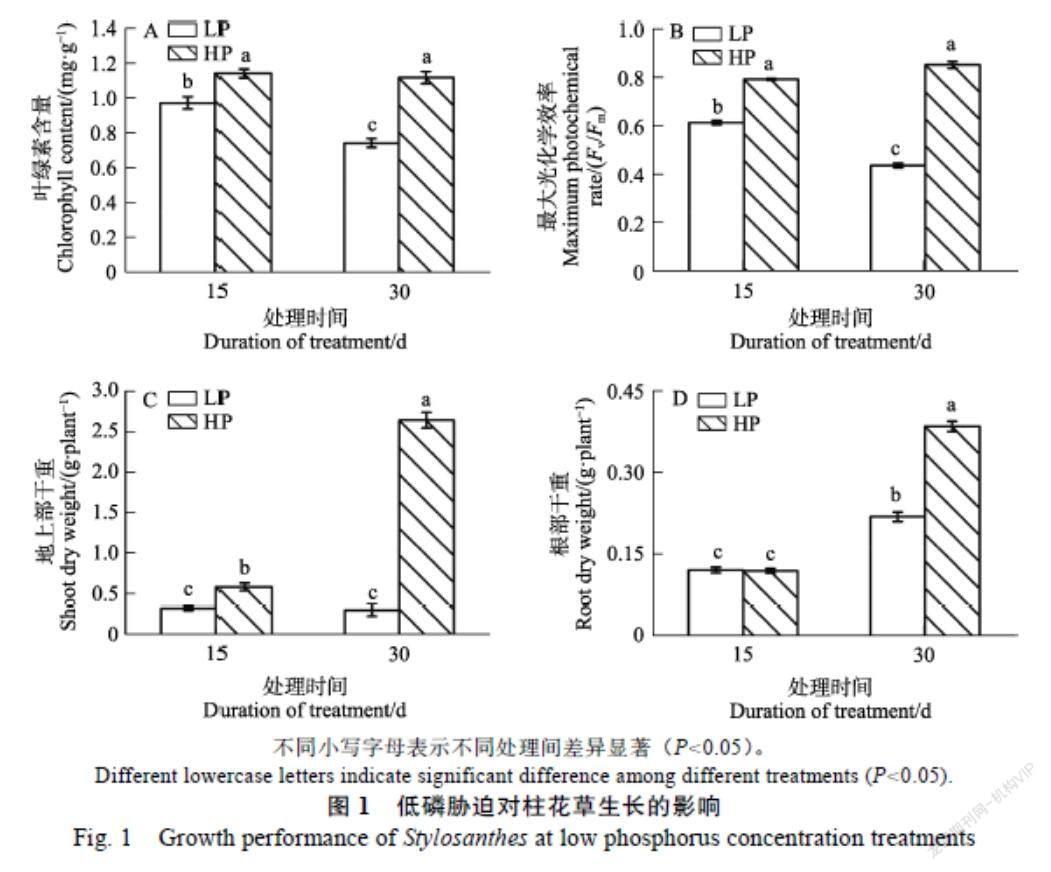
2.1 低磷胁迫对柱花草生长的影响
从图1可见,低磷处理(LP)下柱花草叶片失绿、最大光化学效率下降、生物量降低,显著抑制柱花草的生长。与对照磷处理(HP)相比,柱花草在低磷处理下15 d时叶片叶绿素含量和最大光化学效率分别降低14.7%和22.5%;30 d时分别降低33.4%和48.6%,差异显著(P<0.05)。随着处理时间的增加,低磷处理下叶片的叶绿素含量和最大光化学效率降低,分别降低了18.3%和17.6%,而对照组叶片的叶绿素含量和最大光化学效率无显著变化(图1A,图1B)。
同样的,低磷处理显著降低柱花草地上部干重,根部干重在15 d时无显著变化,在30 d时显著降低(P<0.05)。低磷处理下地上部分15~30 d几乎没有生长,而高磷处理下30 d时的生物量远远大于15 d时的生物量。与对照(HP)相比,低磷处理15 d时地上部干重下降45.2%;30 d时地上部干重和根部干重分别下降88.4%和42.8%,差异显著(图1C,图1D)。
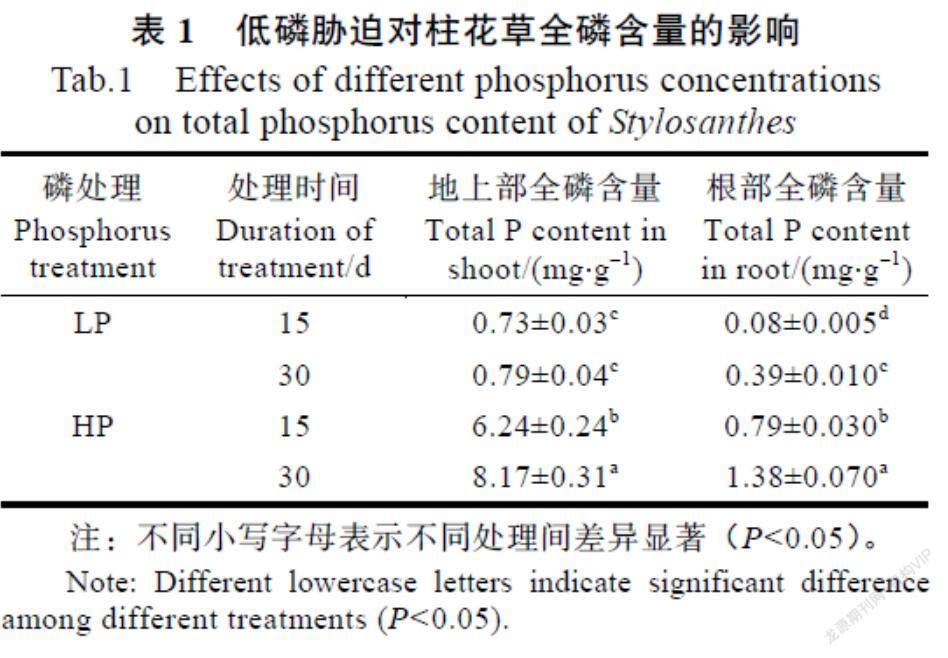
2.2 低磷脅迫对柱花草全磷含量的影响
从表1可见,低磷处理显著降低了柱花草地上部和根部的全磷含量。低磷处理15 d时,柱花草地上部全磷含量和根部全磷含量分别为0.73、0.08 mg/g;处理30 d时分别为0.79、0.39 mg/g。高磷处理15 d时,柱花草地上部全磷含量和根部全磷含量分别为6.24、0.79 mg/g;处理30 d时分别为8.17、1.38 mg/g。与对照(HP)相比,低磷处理的柱花草在15 d时地上部和根部全磷含量分别降低了88.3%和89.9%;30 d时分别降低了90.3%和71.7%。此外,低磷处理下地上部全磷含量在处理15 d和30 d时未发生明显变化,而根部全磷含量在处理30 d时比15 d时提高了4.9倍。
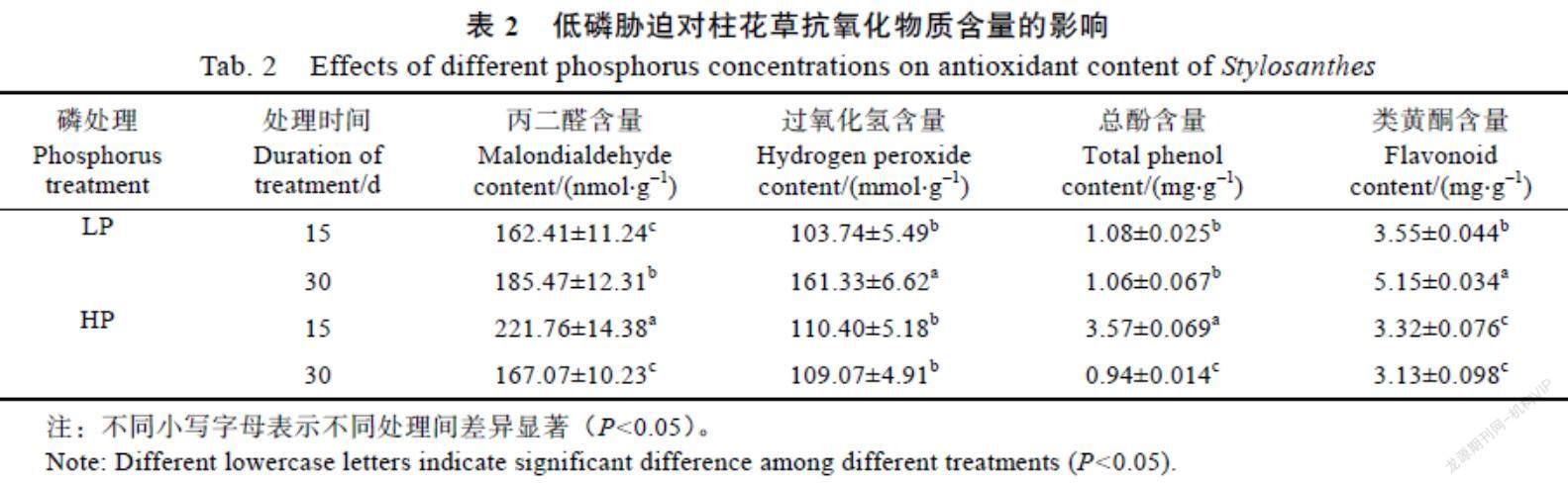
2.3 低磷胁迫对柱花草抗氧化物质含量的影响
由表2可知,低磷胁迫提升了柱花草植株内抗氧化物质的含量。丙二醛、过氧化氢和类黄酮的含量随着处理时间的增加明显提高,分别提高了14.3%、35.7%、31.1%,差异显著(P<0.05)。与对照(HP)相比,15 d时丙二醛和总酚含量分别减少了26.7%、69.7%,类黄酮含量增加了6.5%,过氧化氢含量无明显变化;30 d时,丙二醛、过氧化氢、总酚和类黄酮含量均显著提高,分别提高了11.1%、47.9%、12.8%、64.5%,差异显著(表2)。其中,类黄酮含量与对照相比在15 d和30 d时均提高。
2.4 低磷胁迫对柱花草抗氧化酶活性的影响
植物在低磷环境下,自身的抗氧化酶活性会发生改变。从图2可以看出,低磷处理下柱花草抗氧化酶活性显著提高。其中,15 d时CAT、POD、SOD和ASP活性显著上升,与对照(HP)相比,分别上升了4.8、1.4、1.6和1.2倍(图2);30 d时CAT、POD和ASP活性显著上升,与对照(HP)相比,分别上升了6.4、1.5和1.1倍(图2A,图2B,图2D),而SOD活性无显著变化(图2C)。随着低磷处理时间的增加,CAT和SOD活性分别提高了1.3和1.5倍(图2A,图2C),而POD活性无明显变化(图2B)。
2.5 低磷胁迫对柱花草苯丙氨酸解氨酶和多酚氧化酶活性的影响
由图3可知,低磷处理对柱花草叶片PAL和PPO活性的影响不同,在低磷处理15 d时柱花草叶片PAL活性显著提高,与对照(HP)相比提高了2.3倍,而30 d时PPO活性显著提高,与对照相比提高了2.2倍。
3 讨论
磷参与植物体内各种代谢过程,是植物生长所必需的营养元素之一。研究表明,在较低的磷浓度处理下,其可导致大豆、菜豆、大麦叶片失绿并造成植株矮小[13]。本研究中,低磷处理显著降低了柱花草叶绿素浓度、Fv/Fm、地上部和根部干重(图1),这与已有研究结果类似。在低磷处理15 d时,与对照相比柱花草地上部生长受到抑制,而根部生长并未受到抑制,但随着处理时间的增加,在30 d时地上部生长继续受到抑制,但根部干重与15 d时相比显著增加(图1D)。柱花草根部干重在15 d时与对照相比无明显变化,而30 d时则显著降低,但和地上部分相比受抑制的程度较低,说明当柱花草应对低磷胁迫时根系起到主导作用。表明柱花草在低磷胁迫下根部却进一步生长变化,这可能是植物本身为适应低磷胁迫环境所产生的变化,是植物面对不同环境压力通常采取的生态对策,通过根部的发育,从而形成有利于自身生存的结构特征[14]。在低磷处理下,虽然柱花草地上部的全磷含量显著高于根部全磷含量,但在30 d时,低磷处理下根部的全磷含量比15 d时显著提高(表1)。进一步表明柱花草具有较强的耐低磷能力。活性氧(ROS)是从植物正常生理过程中释放出来的,通过调节离子通道的活性在调节信号转导途径中起着重要作用,适当浓度的ROS是植物生理生化过程所必需的,但在逆境胁迫下,植物体内会产生过量的ROS,进而影响正常的生命活动[15]。本研究中低磷处理15 d时柱花草地上部与根部生物量受到明显抑制,在低磷胁迫下活性氧的增加影响了柱花草正常的生命活动,而30 d时根部生物量增加说明柱花草通过根部的发育来消除过多的ROS所带来的影响。为了有效消除胁迫诱导的有毒活性氧中间产物的积累,植物通常采用抗氧化防御系统应对逆境胁迫,该系统由低分子量抗氧化物质和抗氧化保护酶组成[16]。当水稻、大豆等植物受到低磷胁迫时,会利用自身的抗氧化系统来清除过量的活性氧,以保护植物细胞不受氧化损伤[17]。另外,黄瓜、菜豆中抗氧化物质作为抗氧化系统的一部分,参与调节渗透平衡,通过增加根系长度、运输系统活性、提高矿质利用效率和增加多种矿质养分,保护膜脂,刺激基因表达等途径对抗氧化应激反应[18]。玉米幼苗通过调节抗氧化酶在各种逆境胁迫条件下的活性并改变抗氧化物质的量,以消除过量的ROS所带来的危害,保护植物并提高自身的抗逆性[19]。本研究中,柱花草在低磷胁迫下其自身的抗氧化物质的含量和相關保护酶的活性发生变化,15 d时CAT、POD、SOD、ASP、PAL活性和类黄酮含量提高,30 d时叶片CAT、SOD、ASP、PPO活性和MDA、H2O2含量提高。抗氧化系统在植物适应逆境环境能力方面起着至关重要的作用。为了减轻逆境胁迫,植物利用抗氧化酶和抗氧化物质来清除过量的活性氧[20]。研究发现,低磷胁迫会影响植物的抗氧化系统,改变抗氧化物质的含量和抗氧化酶的活性。如在低磷胁迫下,大豆叶片丙二醛和类黄酮的含量以及水稻叶片CAT和SOD活性均有所增加,进而响应低磷胁迫[21]。此外,低磷处理也提高了黄瓜幼苗ASP和POD的活性[22],这与本研究的结果一致。有效的抗氧化系统对于高等植物在逆境胁迫下的生存至关重要[19]。低磷胁迫下,15 d时柱花草抗氧化系统通过提高CAT、POD、SOD、ASP、PAL的活性抵御胁迫,30 d时通过提高CAT、SOD、ASP、PPO的活性应对胁迫所带来的危害,表明柱花草在不同处理时期受不同保护酶的影响不同,在低磷胁迫下由多种抗氧化保护酶共同调节。综上所述,低磷胁迫抑制柱花草的生长,并影响其自身的抗氧化系统。抗氧化物质与抗氧化保护酶共同参与调节柱花草生命活动以应对低磷胁迫所带来的伤害,其中以提高抗氧化酶的活性为主导。在处理初期和后期柱花草通过提高不同抗氧化保护酶的活性应对胁迫,以清除逆境所产生的过量ROS,从而抑制ROS过度积累。本研究结果为探索柱花草响应低磷胁迫下抗氧化系统变化的机理提供了重要的理论依据。
参考文献
[1] Sewelam N, Kazan K, Schenk P M. Global plant stress signaling:reactive oxygen species at the cross-road[J]. Frontiers in Plant Science, 2016, 7: 187.
[2] Zhang C Z, Wang X, Zhang F, et al. Phenylalanine ammonia-lyase2.1 contributes to the soybean response towards Phytophthora sojae infection[J]. Scientific Reports, 2017, 7(6): 323-329.
[3] Sivankalyani V, Feygenberg O, Diskin S, et al. Increased anthocyanin and flavonoids in mango fruit peel are associated with cold and pathogen resistance[J]. Postharvest Biology and Technology, 2016, 111: 132-139.
[4] Gong Q, Yang Z, Chen E, et al. A phi-class glutathione S-transferase gene for Verticillium wilt resistance in Gossypium arboreum identified in a genome-wide association study[J]. Plant Cell Physiol, 2018, 59(2): 275-289.
[5] 黄亚成, 秦云霞. 植物中活性氧的研究进展[J]. 中国农学通报, 2012, 28 (36): 219-226.
[6] 张梦如, 杨玉梅, 成蕴秀, 等. 植物活性氧的产生及其作用和危害[J]. 西北植物学报, 2014, 34(9): 1916-1926.
[7] Lee M W, Huffakre A, Crippen D, et al. Plant elicitor peptides promote plant defences against nematodes in soybean[J]. Molecular Plant Pathology, 2018, 19(4): 858-869.
[8] 谢晓红. 植物抗氧化酶系统研究进展[J]. 化工管理, 2015(32): 99-100.
[9] 薛 瑞, 周广奇, 胡新文, 等. 柱花草种质抗旱性综合评价[J]. 中国农学通报, 2009, 25(11): 224-233.
[10] 刘一明, 冯 宇, 丁西朋, 等. 67份柱花草耐盐性综合评价[J]. 热带作物学报, 2017, 38(11): 2040-2049.
[11] 沈 宏, 施卫明, 王校常, 等. 不同作物对低磷胁迫的适应机理研究[J]. 植物营养与肥料学报, 2001(2): 172-177, 210.
[12] 陈志坚, 罗佳佳, 彭玺如, 等. 不同柱花草种质的抗旱性分析[J]. 热带作物学报, 2017, 38(10): 1790-1795.
[13] 刘建中, 李振声, 李继云. 利用植物自身潜力提高土壤中磷的生物有效性[J]. 生态农业研究, 1994, 2(1): 16-23.
[14] 杜育梅, 白昌军, 田 江, 等. 柱花草适应酸性缺磷土壤的基因型差异及可能的生理机制[J]. 华南农业大学学报, 2008(4): 6-11.
[15] Noctor G, Mhamdi A, Foyer C H. The roles of reactive oxygen metabolism in drought: not so cut and dried[J]. Plant Physiology, 2014, 164(4): 1636-1648.
[16] Xia X J, ZhouY H, Shi K, et al. Interplay between reactive oxygen species and hormones in the control of plant develop ment and stress tolerance[J]. Journal of Experimental Botany, 2015, 66(10): 2839-2856.
[17] Qi J, Song C P, Wang B, et al. ROS signaling and tomatal movement in plant responses to drought stress and pathogen attack[J]. Journal of Integrative Plant Biology, 2018, 60(9): 805- 826.
[18] 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 2007, 23(1): 105-110.
[19] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930.
[20] MittlerR. ROS are good[J]. Trends in Plant Science, 2017, 22(1): 11-19.
[21] Waszczak C, Carmody M, Kangasjrvi J. Reactive oxygen species in plant signaling[J]. Annual Review of Plant Biology, 2018, 69: 209-236.
[22] 薛 鑫, 張 芊, 吴金霞. 植物体内活性氧的研究及其在植物抗逆方面的应用[J]. 生物技术通报, 2013(10): 6-11.
责任编辑:沈德发

