肝细胞癌患者癌旁肝组织中COX-2 高表达与术后复发相关*
周炜林,顾春燕,肖静文,肖 锋*
(江苏省南通市第三人民医院,南通大学附属南通第三医院病理科,南通 226006)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的实体瘤之一,在全世界癌症相关死亡中居第3位。在东亚、东南亚和非洲,HCC 的发病率尤其高[1]。环氧合酶(cyclooxygenase,COX)是花生四烯酸合成前列腺素的限速酶,由COX-1 和COX-2 两种亚型组成,COX-1 在组织中广泛表达,而COX-2 在组织中选择性表达。COX-2 在结直肠癌、胃癌、卵巢癌中有高水平表达,其表达与癌细胞的侵袭性、患者预后和生存率密切相关。COX-2 代谢物前列腺素E2(prostaglandin E2,PGE2)的增加可以促进上皮癌细胞的生长、存活和侵袭[2]。本研究发现,COX-2 在HCC癌旁肝组织中有表达,并与癌组织中表达水平不一致。COX-2 在癌旁肝组织中的表达是否具有临床意义,目前还缺乏相关研究。
1 资料与方法
1.1 临床资料 收集2008 年1 月—2017 年12 月期间南通市第三人民医院病理科存档的HCC 患者石蜡样本344例,所有患者术前均未接受抗肿瘤治疗。所有标本均按标准程序采集和处理:组织样本用10%甲醛溶液固定,石蜡包埋,切片4 μm。收集患者的一般资料(性别、年龄等),及其他临床特征包括肿瘤大小、乙肝表面抗原(hepatitis B surface antigen,HBsAg)情况、有无肝硬化、组织学分级、微血管侵犯等。术后随访时间为8~114 个月。本研究经患者知情同意并通过南通市第三人民医院医学伦理委员会批准。
1.2 制备组织芯片 首先对所有HCC 病例的HE切片重新阅片,挑选代表性癌组织及癌旁2 cm 以内肝组织的位置,并在对应蜡块上作标记。随后用仪器打孔制成模块,用吸针从样本蜡块吸取组织,按照设定的排列顺序装载在新制作模块蜡块中。
1.3 免疫组织化学检测 石蜡样本组织切片,厚度4 μm;二甲苯脱蜡3 次,5 min/次;梯度乙醇复水;然后切片在去离子水中浸泡5 min。高温高压法进行抗原修复。待切片自然冷却后,室温下用3%H2O2处理10 min,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤;用含3%牛血清白蛋白的PBS 封闭1 h。之后,滴加一抗COX-2(Santa Cruz 公司,1∶200),4 ℃孵育过夜,随后在37 ℃下与辣根过氧化物酶耦联的二抗(Leica 公司)孵育1 h;然后用显色剂3,3′-二氨基联苯胺处理切片,并用苏木精复染;最后,切片用去离子水洗涤,梯度乙醇脱水,二甲苯透明,中性树胶封片。实验设置阴性对照和阳性对照。
1.4 结果判定 在肿瘤细胞和癌旁肝细胞的细胞质中观察到清晰的棕色时,判定为COX-2 阳性。由两位受过专业培训的病理医师在双盲情况下进行评定。首先在低倍镜下整体评估切片,选取阳性染色热点区(染色最强区域)进行细胞计数。同时计数阳性细胞所占百分比及评价染色强度,至少计数2 000 个细胞。阳性细胞所占的百分比分级标准:<5%为0 分;5%~<25%为1 分;25%~<50%为2 分;50%~<75%为3 分;≥75%为4 分。染色强度分级标准:未见染色为0 分;弱棕色为1 分;棕色为2 分;棕褐色为3 分。两项评分相乘、再相加,取平均值即为最后的评分,分为4 个等级:0~1 分,阴性(-);2~4 分,弱阳性(+);5~8分,中度阳性(++);9~12 分,强阳性(+++)。
1.5 统计学方法 应用SPSS 19.0 统计软件进行数据分析,率的比较采用χ2检验,COX-2 表达与临床病理参数相关性分析采用Spearman 等级相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 COX-2蛋白在HCC 癌旁肝组织及癌组织中的表达情况 COX-2 蛋白表达定位于HCC 癌旁肝组织及癌组织的细胞质中,呈均匀细颗粒状(图1)。COX-2 蛋白在HCC 癌旁肝组织中的表达率高于癌组织(χ2=4.896,P=0.027)(表1)。
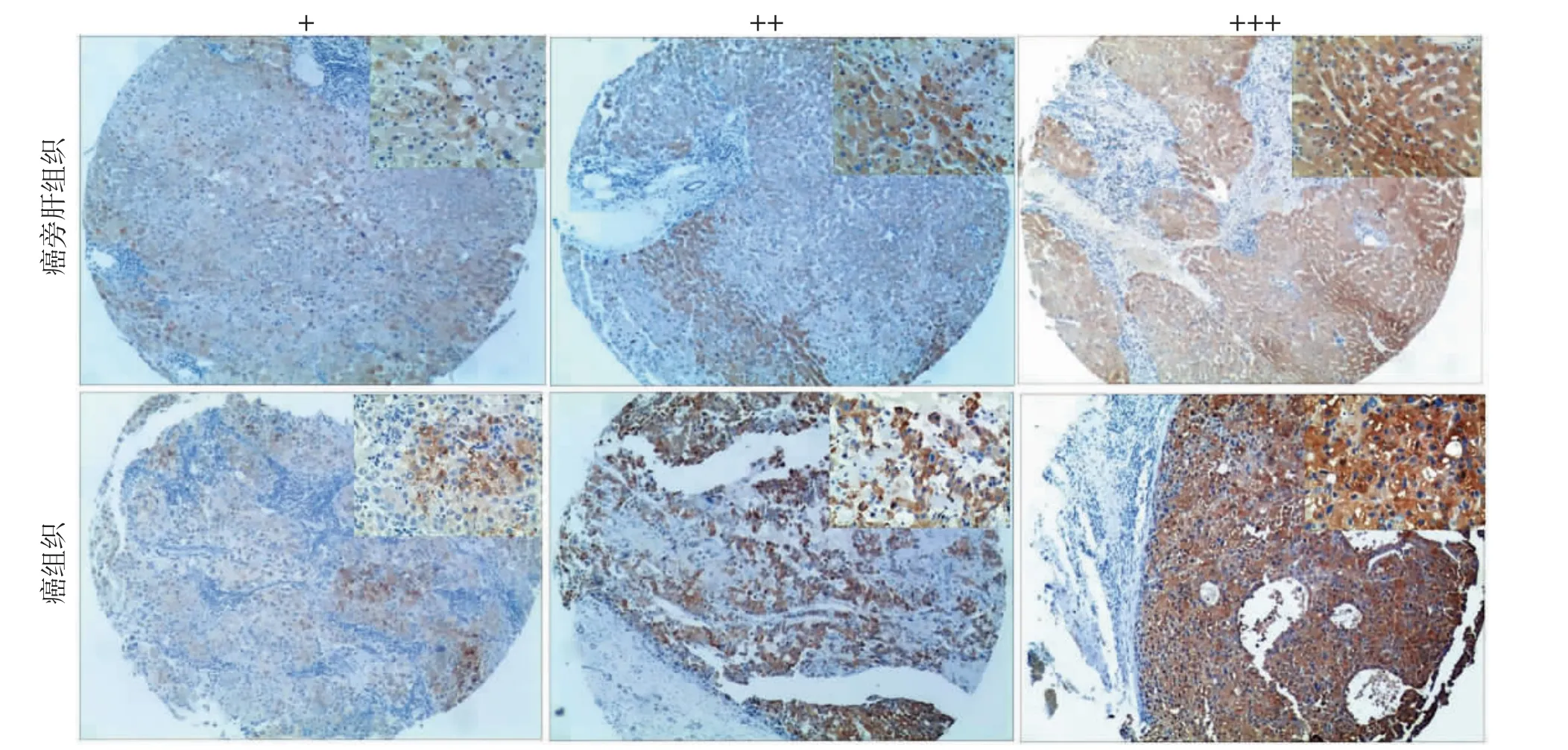
图1 免疫组织化学法检测COX-2 在HCC 癌及癌旁肝组织中的表达情况
2.2 COX-2 在HCC 癌旁肝组织中的表达与临床病理参数的关系 结果显示,COX-2 在HCC 癌组织中的表达与组织学分级、微血管侵犯及术后复发相关(均P<0.05)。COX-2 在癌旁肝组织中表达与患者HBsAg 阳性、有肝硬化、微血管侵犯及术后复发相关(均P<0.05)(表2)。
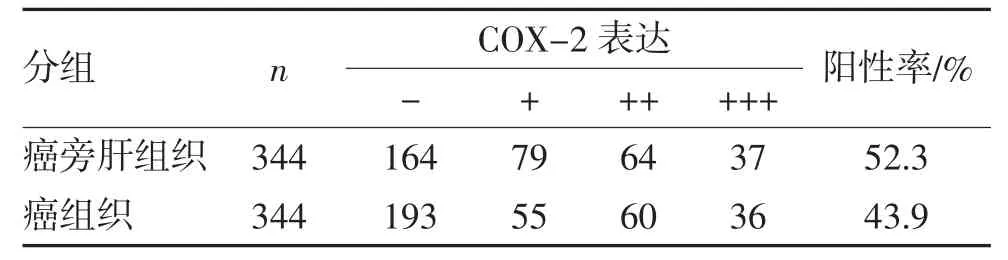
表1 COX-2 蛋白在肝细胞癌及对应的癌旁肝组织中的表达
3 讨论
HCC 在南通地区发病率高。目前的数据[3]显示:近80%的HCC 患者都有慢性肝炎、肝硬化的基础病变。尽管通过手术完整切除肿瘤,但HCC 复发率居高不下。越来越多的研究[4]表明肿瘤周围的肝细胞分子生物学功能及所处的微环境已经发生了某些分子及功能的改变,这些变化进一步导致单中心或多中心性的肝细胞癌变,进而导致肿瘤复发。故研究癌旁肝组织的生理生化状态对于评估HCC 患者复发风险具有十分重要的意义。
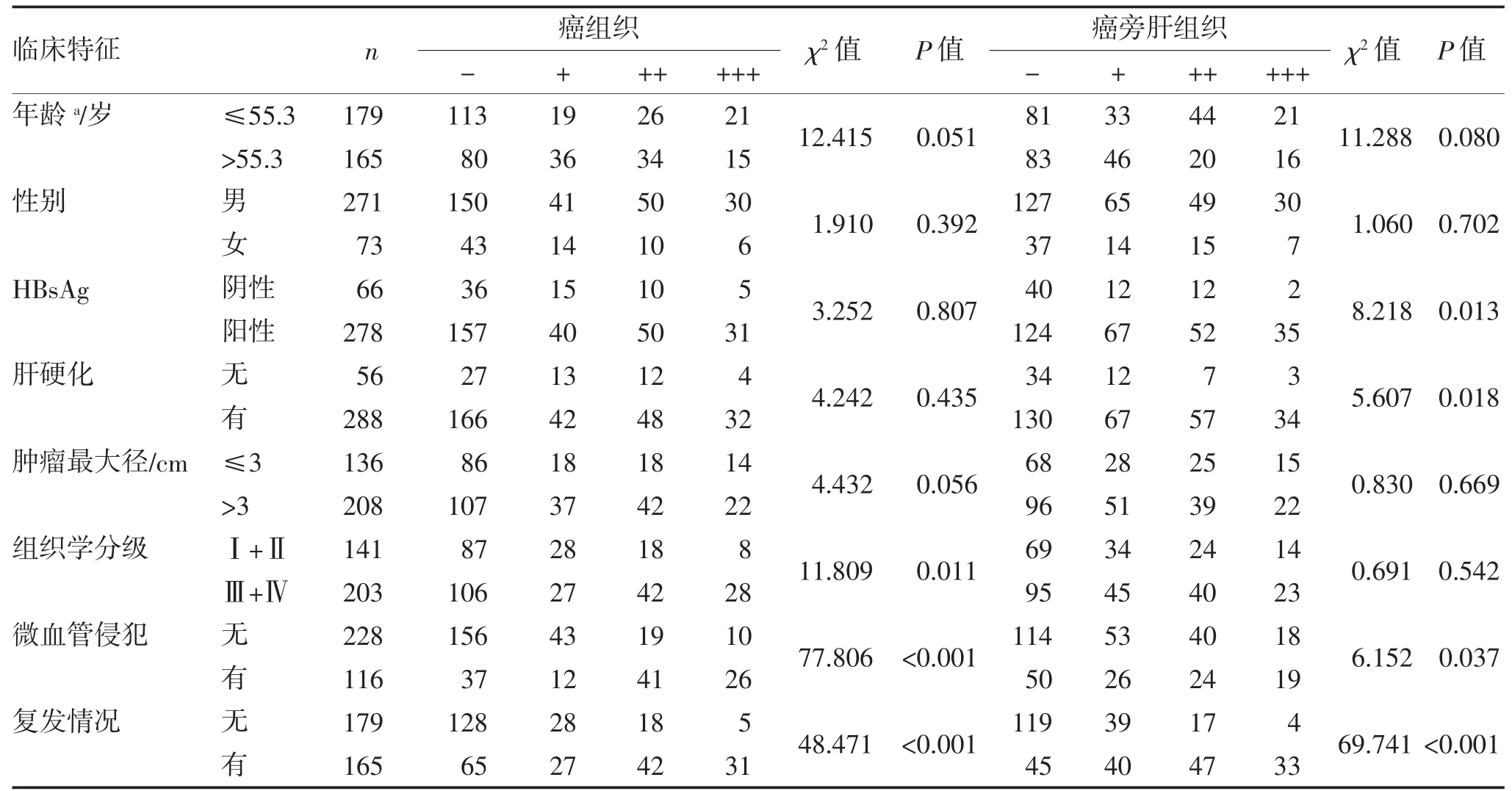
表2 HCC 癌组织及癌旁肝组织中COX-2 的表达与临床病理因素之间的相关性
COX-2 参与调控多种恶性肿瘤的发生和发展过程,如调控肿瘤细胞的增殖和凋亡、增强肿瘤细胞的侵袭能力以及促进肿瘤新生血管的生成等[5]。本研究结果显示COX-2 在癌旁肝组织中的表达率高于癌组织,提示癌旁肝组织的分子生物学性能、细胞微环境等可能发生了改变。
统计分析结果显示COX-2 在HCC 癌组织中的表达与组织学分级、微血管侵犯及术后复发相关,这与之前的报道[6]相一致,进一步验证了COX-2 在HCC发生发展过程中的重要作用。COX-2 在癌旁肝组织中表达与患者HBsAg 感染、肝硬化情况呈正相关,提示COX-2 可能参与肝炎、肝纤维化的病理生理过程[7]。值得注意的是,COX-2 在癌旁肝组织中表达与微血管侵犯及术后复发相关,这一结果提示COX-2在癌旁肝组织中高表达可能是肝细胞癌变过程中的重要分子事件,基于COX-2 的重要分子生物学功能,笔者推测:COX-2 过表达可能通过相关分子信号途径诱导肝细胞发生克隆性转化,最终导致肿瘤的复发。
首先,有研究[8]显示COX-2 的过度表达能改变细胞某些增殖和凋亡相关基因的表达。COX-2 能催化花生四烯酸生成前列腺素,其中PGE2 可诱导B细胞淋巴瘤2 基因(B-cell lymphoma-2,Bcl-2)表达,Bcl-2 是凋亡抑制分子,其过表达可抑制细胞凋亡,进而导致细胞恶性转化。其次,COX-2 具有一定程度的免疫抑制功能。COX-2 催化产物PGE2 可抑制肿瘤微环境中T 淋巴细胞的募集,同时还能抑制自然杀伤细胞的细胞毒反应[9];另外可以诱导有免疫抑制功能的白细胞介素-10 的产生,进而使癌细胞能够逃避免疫监视和免疫攻击。第三,COX-2 可促进新生血管和淋巴管的形成。有关COX-2 在肿瘤组织中表达促进血管或淋巴管生成的研究早有报道[10],文献[7]结果显示:COX-2 在肿瘤周围肝组织,尤其是肝硬化组织中的表达上调,可通过旁分泌的方式促进肿瘤血管生成,进而导致HCC 侵袭门静脉或肝静脉,导致肿瘤复发;另外,COX-2 还可以通过上调多种细胞因子的表达,促进淋巴管形成,导致肿瘤通过淋巴管转移。
综上,COX-2 可能参与HCC 复发过程,为一步探讨复发性HCC 的分子机制提供新的思路,也为临床拟定提前干预措施提供新的依据。

