猪脾转移因子提高LaSota株鸡新城疫弱毒疫苗的免疫保护率
徐 磊,钟佳莲,余勋信,刘毅发,黄 瑜,刘小龙,赖隆永,闫丽萍,许秀梅,宋素泉*,张渊魁*
(1.福建农业职业技术学院,福州 350119;2.福建省禽病防治重点实验室,福州 350013;3.福建省农业科学院畜牧兽医研究所,福州 350013;4.派生特(福州)生物科技有限公司,福州 350500;5.南京农业大学动物医学院,南京 210095;6.兆丰华生物科技(南京)有限公司,南京 211102)
养鸡业在我国国民经济中占据重要地位,但禽病始终制约着我国养鸡业发展。其中,新城疫(Newcastle disease,ND)就是危害养鸡业健康发展最为重要的烈性传染病之一[1-2]。我国主要采用不同毒力的新城疫病毒(Newcastle disease virus,NDV)弱毒疫苗和油乳剂灭活疫苗防控ND,在一定程度上控制了ND的大规模流行,但是环境应激、疫苗保护力限制、免疫抑制等多种因素导致ND仍然于免疫鸡群时有发生,给我国养鸡业造成重大经济损失[3-4]。因此,ND新型疫苗及其免疫佐剂的研发是将来工作方向[5-6]。
转移因子(transfer factor,TF)是一种由T淋巴细胞释放的能够转移致敏信息的细胞因子,可以提高鸡免疫功能和缓解鸡免疫抑制[7-9]。包括本课题组在内的多项研究显示,TF可增强NDV疫苗的免疫效果[10-12]。为了进一步明确TF提高NDV疫苗攻毒保护率的作用及机理,本试验对NDV LaSota弱毒疫苗株与TF联合免疫后NDV F48E9强毒株攻毒的免疫应答进行研究,应用蛋白质芯片技术与ELISA方法研究NDV感染后鸡外周血细胞因子浓度的动态变化规律,以期为NDV疫苗免疫机理的研究、疫苗免疫佐剂的研发和更有效预防NDV提供依据。
1 材料与方法
1.1 疫苗与病毒株
NDV LaSota株弱毒疫苗由兆丰华生物科技(南京)有限公司提供,NDV F48E9株强毒[13]由福建省农业科学院畜牧兽医研究所提供。NDV LaSota株弱毒疫苗病毒含量为107.17EID50·羽份-1,NDV F48E9株病毒含量为105.0ELD50·mL-1。
1.2 主要试剂及仪器
Chicken IL-4 ELISA Kit购自Lifespan Biosciences公司;Chicken Cytokine Array Kit购自Ray Biotech公司;Innoscan 300动态激光共聚焦扫描仪购自Innopsys公司;全自动酶标仪购自Bio Rad公司;动物饲养隔离器购自苏州市冯氏实验动物设备有限公司。
1.3 TF制备
按照本实验室已授权的国家发明专利制备猪脾TF[14-15]:以健康猪脾为原料,经匀浆、细胞破碎、分离、灭活、微滤、超滤后精制而成。经检验,所制备猪脾TF的pH为7.0,多肽含量为3.5 mg·mL-1,核糖含量为72.0 μg·mL-1,脱E受体法效力检验活力为15%,细菌内毒素含量小于10 EU·mL-1,在252 nm波长处有最大吸收,OD260 nm/OD280 nm的比值为2.23,蛋白质定性检验、无菌检验、支原体检验、外源病毒检验、热原检验、异常毒性检查、过敏反应检查和安全检验均合格。
1.4 实验动物
SPF鸡购自济南斯帕法斯家禽有限公司,攻毒前在正压动物饲养隔离器中饲养,30日龄免疫接种,44日龄转至负压动物饲养隔离器中攻毒饲养。
1.5 TF对LaSota株弱毒疫苗攻毒保护率的影响
选取200羽SPF鸡随机分为10组,每组各20羽,分别为:单独免疫组1与联合免疫组1(均点眼免疫10-2羽份LaSota株弱毒疫苗)、单独免疫组2与联合免疫组2(均点眼免疫10-3羽份LaSota株弱毒疫苗)、单独免疫组3与联合免疫组3(均点眼免疫10-4羽份LaSota株弱毒疫苗)、单独免疫组4与联合免疫组4(均点眼免疫10-5羽份LaSota株弱毒疫苗)、对照组1与空白组1(均不免疫),同时,4个联合免疫组均肌内注射0.2 mL TF。免疫后第14天,4个单独免疫组、4个联合免疫组与对照组1均肌内注射0.5 mL NDV F48E9株强毒,设立空白组1为非免疫非攻毒组,见表1。每日观察临床症状至攻毒后第14天,剖检病死鸡和试验结束时存活鸡。

表1 试验设计Table 1 Experimental design
攻毒后SPF鸡出现扭颈、翅膀麻痹、瘫痪等ND典型临床症状,或全身黏膜和浆膜出血、盲肠扁桃体肿大、出血、坏死等ND典型剖检病变,或病死,则判为SPF鸡发病[16]。SPF鸡发病即判为不保护,相反,SPF鸡临床健康即判为保护,统计各剂量组SPF鸡的发病率和死亡率,按Reed-Muench法计算半数保护量(median protective dose,PD50)[17]。
1.6 血清中IL-4、IFN-γ、IL-12 P40含量测定
选取240羽SPF鸡随机分为4组,每组各60羽,分别为单独免疫组、联合免疫组、对照组与空白组,其免疫及攻毒试验设计分别与单独免疫组2、联合免疫组2、对照组1、空白组1一致,并分别于免疫前3天、免疫后第7、14天以及攻毒后第1、3、7、14天依次抽取各组不重复的5羽SPF鸡(攻毒后优先抽取临床健康鸡)血样,经前翅静脉采集、分离血清测定IL-4、IFN-γ、IL-12 P40 3种细胞因子浓度。
IL-4含量测定按照Chicken IL-4 ELISA Kit操作步骤进行,IFN-γ和IL-12 P40含量测定按照Chicken Cytokine Array Kit操作步骤进行,分别采用酶标仪和动态激光共聚焦扫描仪读取吸光度值和荧光信号,制作标准曲线,计算样品浓度。若细胞因子浓度低于相应Kit阴性对照标准品的吸光度值或荧光信号而不可检出时,本研究以0 pg·mL-1表示。所得数据用单因素方差分析和最小显著性差法(LSD)分析,P<0.05为差异显著。
2 结 果
2.1 临床症状及攻毒保护率
免疫后,各组鸡精神、采食、饮水、粪便均正常,TF注射部位无肿胀、无坏死、无炎症等异常变化,未见局部和全身不良反应。攻毒后,单独免疫组1和联合免疫组1均无发病、无死亡,保护率100%。单独免疫组2共有9羽鸡于攻毒后第2天开始表现ND典型临床症状,并于攻毒后第3、4和5天分别死亡2、3、3羽,死亡率40%;余下1羽鸡于攻毒10天后恢复正常,保护率55%。联合免疫组2共有5羽鸡于攻毒后第3天开始表现ND典型临床症状,并于攻毒后第4和5天分别死亡3、1羽,死亡率20%;余下1羽鸡于攻毒9 d后恢复正常,保护率75%。此外,单独免疫组3、联合免疫组3、单独免疫组4和联合免疫组4的鸡均于攻毒后第2天,而对照组1的鸡于攻毒后第1天,开始表现ND典型临床症状,各组鸡死亡高峰依次集中在:攻毒后第3~5天、第3~6天、第3~4天、第3~5天、第2~4天,死亡率100%,保护率0%。空白组1无发病、无死亡(表2)。
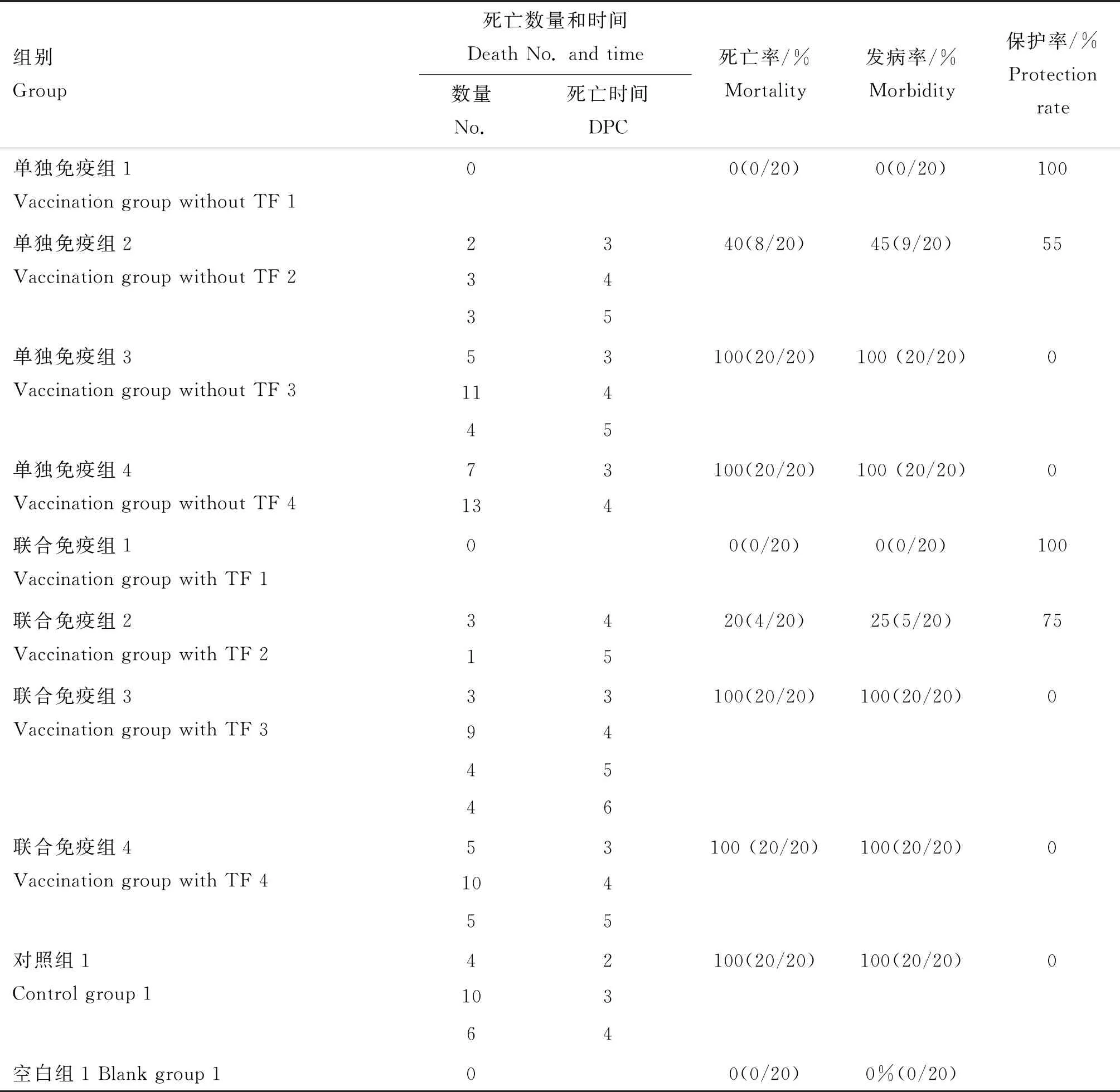
表2 各组的保护效率Table 2 Protection of the chickens in each vaccinated group against challenging with virulent NDV
2.2 剖检变化及PD50
攻毒后,各组病死鸡出现ND典型剖检病变。此外,单独免疫组2与联合免疫组2中各有1羽病愈鸡,剖检病变不典型,仅在腺胃乳头和十二指肠出现少量出血点,以及在脾表面出现少量白色坏死点。而剖检空白组1鸡和其他各组免疫保护鸡,则未发现病变。
统计不同剂量NDV疫苗的攻毒试验结果并按Reed-Muench法计算PD50(表3与表4),结果显示,单独免疫组中疫苗的一个PD50为0.000 8羽份,即:该NDV疫苗单独接种0.000 8羽份可以使50%的鸡获得保护。联合免疫组中疫苗的一个PD50为0.000 5羽份,即:该NDV疫苗与TF联合免疫仅需接种0.000 5羽份可以使50%的鸡获得保护,比单独免疫组中疫苗PD50减少了37.5%。

表3 单独免疫组接种不同剂量NDV疫苗的攻毒试验结果Table 3 Challenge test in vaccination group without TF immunized with different doses of NDV vaccine

表4 联合免疫组接种不同剂量NDV疫苗的攻毒试验结果Table 4 Challenge test in vaccination group with TF immunized with different doses of NDV vaccine
2.3 血清中IL-4、IFN-γ、IL-12 P40含量测定
统计攻毒后各组的死亡率、发病率和保护率(图1),其中,单独免疫组分别为45%、45%和55%,联合免疫组分别为25%、25%和75%,对照组分别为100%、100%和0%,而空白组无发病、无死亡。

图1 攻毒后各组试验鸡的存活情况Fig.1 The survival chickens of each group after challenge
2.3.1 IL-4含量的变化 免疫前IL-4含量,各组均不可检出。免疫后,联合免疫组明显增加,由0 pg·mL-1(免疫前第3天)显著增加至19.62 pg·mL-1(免疫后第7天)和37.14 pg·mL-1(免疫后第14天),而其余组均不可检出。攻毒后,联合免疫组于第1天迅速下降至22.33 pg·mL-1,随后明显增加并于第14天达到48.46 pg·mL-1,而单独免疫组明显增加并于第14天达到31.48 pg·mL-1,对照组与空白组变化不显著。免疫及攻毒后各时间点联合免疫组均高于其他组,并于免疫后第7、14天和攻毒后第1、14天差异极显著(P<0.01)。攻毒后各时间点单独免疫组均极显著高于对照组与空白组(P<0.01),对照组与空白组IL-4含量接近且差异不显著,见图2A。
2.3.2 IFN-γ含量的变化 免疫前IFN-γ含量,各组接近且差异不显著。免疫后尤其是攻毒后,联合免疫组与单独免疫组明显增加,其中,各时间点联合免疫组均高于其他组,于免疫后第7、14天和攻毒后第1、3天差异极显著(P<0.01),并于攻毒后第1天达到高峰值(296.15 pg·mL-1);各时间点单独免疫组均高于对照组与空白组,于免疫后第14天极显著高于对照组与空白组(P<0.01),于攻毒后第3天极显著高于空白组(P<0.01),并于攻毒后第3天达到高峰值(109.51 pg·mL-1);各时间点对照组高于空白组,但差异不显著,见图2B。
2.3.3 IL-12 P40含量的变化 免疫前及免疫后各时间点IL-12 P40含量,各组接近且差异不显著。攻毒后,联合免疫组于第1天即达到高峰值(18.98 pg·mL-1),且各时间点均高于其他组,并于攻毒后第1天差异极显著(P<0.01);单独免疫组于第3天达到高峰值(8.04 pg·mL-1),此时低于联合免疫组而高于对照组(差异不显著),但空白组显著低于其他组(P<0.05),见图2C。
3 讨 论
NDV只有1个血清型,但具有多种基因型,我国主要流行的NDV基因型具有多样性且在不断进化中,个别地区还出现了新基因型[18]。许多学者采用不同NDV基因型毒株分别对LaSota株(基因Ⅱ型)弱毒疫苗免疫鸡开展了攻毒保护试验,因免疫剂量、日龄和攻毒毒株、途径等的不同,攻毒保护率结果不同[19-20]。在本研究中,点眼免疫10-2、10-3、10-4、10-5羽份LaSota株弱毒疫苗(107.17EID50·羽份-1)对NDV F48E9株强毒(基因Ⅸ型)的攻毒保护率分别为100%、55%、0%和0%,单独免疫组中疫苗的一个PD50为0.000 8羽份。
已有多种免疫佐剂用于增强NDV疫苗免疫效果的研究,其中,TF显示了较好的免疫增效作用,并在TF提高ND抗体效价、淋巴细胞转化水平、巨噬细胞吞噬能力等免疫学指标方面开展了深入研究[8-12],但是在TF提高NDV疫苗攻毒保护率及其作用机制方面鲜有报道。在本研究中,TF联合10-2、10-3、10-4、10-5羽份LaSota株弱毒疫苗点眼免疫对NDV F48E9株强毒的攻毒保护率分别为100%、75%、0%和0%。其中,在免疫10-3羽份LaSota株弱毒疫苗时相比单独免疫组2的攻毒保护率(55%),联合免疫组2的攻毒保护率(75%)显著提高,提高了20%。此外,联合免疫组中疫苗的一个PD50为0.000 5羽份,比单独免疫组中疫苗PD50(0.000 8羽份)减少了37.5%,即:相比单独免疫方式,LaSota株弱毒疫苗与TF联合免疫仅需单独免疫时62.5%的NDV病毒用量即可获得相同的攻毒保护率。结果表明,TF可增强LaSota株弱毒疫苗的攻毒保护率。
猪脾TF的原料资源丰富,猪脾多作为屠宰废弃物,有利于产业向规模化、集约化方向发展,研究显示[10,21],鸡脾TF和猪脾TF均可增强家禽免疫功能和疫苗免疫效果,但鸡脾TF效果会优于猪脾TF。与此研究结果类似,本课题组另有试验显示(另文报道),鸡法氏囊素与LaSota株弱毒疫苗联合免疫的攻毒保护率明显高于猪脾TF,而PD50明显低于猪脾TF,即:对LaSota株弱毒疫苗的免疫增效作用会显著高于猪脾TF,这与免疫佐剂的来源动物种间差异是否有关仍需作进一步研究,为不同疫苗佐剂的研发提供了参考依据。
TF分子量小于10 ku,具有分子质量小、无抗原性、无毒副作用和不引起过敏反应等优点[7-12,14-15]。本试验结果也验证了TF使用安全,TF肌注后各组鸡均健康,未见局部和全身不良反应。攻毒后,各组免疫保护鸡临床表现和剖检变化均正常;各组病死鸡均表现ND典型的临床症状和剖检病变;此外,单独免疫组2与联合免疫组2中各有1羽病愈鸡,临床症状表现典型,剖检病变不典型,联合免疫组2病愈鸡相比单独免疫组2病愈鸡提前1 d恢复正常。其中,对照组1开始出现临床症状和病死鸡的日龄最早,分别为攻毒后第1、2天;而单独免疫组2开始出现临床症状和病死鸡的日龄相比联合免疫组2提前1 d,联合免疫组3和联合免疫组4最后病死鸡日龄相比单独免疫组3和单独免疫组4分别延迟1 d。临床症状和剖检变化结果表明,TF联合LaSota株弱毒疫苗联合免疫优于单独免疫。
在免疫应答过程中细胞因子发挥着重要作用,IL-4与IFN-γ分别是Th2和Th1细胞免疫应答的信号细胞因子,可分别介导体液免疫与细胞免疫[22-23]。IL-12是由IL-12 p40和IL-12 p35两个亚基组成的异源二聚体,是一种重要的调节性细胞因子,可诱导Th0向Th1分化和大量IFN-γ产生,促进机体细胞免疫[24]。在本研究中,IFN-γ和IL-12 P40含量测定采用了蛋白质芯片技术,该技术结合了ELISA检测灵敏度高、特异性强、阵列高通量的优点[25]。结果显示,免疫后各时间点,联合免疫组IL-4和IFN-γ含量均高于其他组,并于第7、14天差异极显著(P<0.01);单独免疫组IFN-γ含量高于对照组与空白组,并于第14天差异极显著(P<0.01);而各组IL-12 P40含量接近,差异不显著。表明免疫NDV弱毒疫苗LaSota株可显著提高鸡IFN-γ水平,与其他学者研究结果一致[26],而TF可显著提高NDV弱毒疫苗LaSota株免疫鸡IL-4和IFN-γ水平。

A.IL-4;B.IFN-γ;C.IL-12 P40。“*”表示联合免疫组极显著高于其他组(P<0.01)A.IL-4;B.IFN-γ;C.IL-12 P40.“*”showed that the vaccination group with TF was significantly higher than other groups (P<0.01)图2 免疫或攻毒后各组试验鸡外周血IL-4、IFN-γ和IL-12 P40的变化Fig.2 Levels of IL-4,IFN-γ and IL-12 P40 in PBMC after vaccination or challenge
本研究攻毒后1 d,联合免疫组IL-4和IFN-γ表达呈负相关,前者含量明显下降(下降了14.80 pg·mL-1),后者含量明显提高(提高了238.72 pg·mL-1),推测与IL-12的调节作用有关,此时IL-12 P40明显增加并达到高峰值(18.98 pg·mL-1)。联合免疫组IFN-γ和IL-12 P40含量高峰值出现时间(攻毒后第1天)均比单独免疫组(攻毒后第3天)提前了2 d。攻毒后各时间点,联合免疫组IL-4、IFN-γ和IL-12 P40含量均高于其他组,其中,IL-4于第1、14天,IFN-γ于第1、3天,IL-12 P40于第1天差异极显著(P<0.01);单独免疫组IL-4、IFN-γ含量高于对照组与空白组,其中,IL-4于攻毒后各时间点,IFN-γ于攻毒后第3天差异极显著(P<0.01)。结果表明,TF与NDV弱毒疫苗LaSota株联合免疫可增强IFN-γ、IL-12介导的细胞免疫和IL-4介导的体液免疫。
4 结 论
对TF提高NDV弱毒疫苗LaSota株攻毒保护率的效果及机制进行了研究,结果表明,TF可增强IFN-γ、IL-12介导的细胞免疫和IL-4介导的体液免疫,提高LaSota株弱毒疫苗的免疫保护率,降低疫苗PD50;在抵抗NDV F48E9强毒攻击时,联合免疫组的免疫保护率明显高于单独免疫组。

