干扰Hsa_circ_0023642调控miR-653对甲状腺癌细胞生物行为的影响
李文强 刘慧颖 任卫东
1河北北方学院研究生学院(河北张家口 075000);2河北北方学院附属第一医院内分泌科(河北张家口 075000)
甲状腺癌是内分泌系统常见的恶性肿瘤,其发病率逐年上升,总体上治疗效果良好,但仍有一部分难治性甲状腺癌缺乏有效的治疗手段,提高其诊断及治疗效率是关键。靶向治疗是一种新型的治疗技术,研究甲状腺癌的发病机制,利用相关分子作为靶点,进而研发靶向药物进行治疗,能够为甲状腺癌患者带来新的希望[1-3]。研究发现越来越多的非编码RNA(ncRNA)在人类甲状腺癌中显示出异常表达,miRNA、circRNA等不同RNA分子参与调节甲状腺癌的发生与进展过程,有望作为靶向治疗的分子靶点[4-6]。circ_0023642是来源于紫外线抵抗相关基因(ultraviolet resistanceassociated gene,UVRAG)的 circRNA,位于染色体chr11:75727858-75728024,研究报道雌激素受体α(estrogen receptor α,ERα)可通过降低circ_0023642抑制膀胱癌细胞的侵袭[7]。hsa_circ_0023642在胃癌中被上调,且与胃癌的恶性程度呈高度正相关;沉默circ_0023642显著降低了胃癌细胞的增殖、侵袭和迁移[8]。circ_0023642可通过调控miR-508-3p促进胃癌GMC-803细胞增殖和转移的恶性生物学行为[9]。然而circ_0023642对甲状腺癌细胞生物学行为的影响及机制尚不清楚。生物学软件预测发现circ_0023642与miR-653有结合位点。研究报道miR-653-5p过表达可抑制黑色素瘤细胞生长[10]。hsa_circ_0004771的沉默可通过激活miR-653来抑制乳腺癌的增殖并诱导其凋亡[11]。而miR-653对甲状腺癌细胞生物学行为的影响及circ_0023642是否调控miR-653也尚不清楚。本实验旨在研究circ_0023642是否通过调控miR-653影响甲状腺癌的细胞生物学行为,为甲状腺癌靶向治疗提供理论指导及可能的分子靶点。
1 材料与方法
1.1 样本来源 选取本院25例甲状腺癌患者的癌组织及相应的癌旁组织,男16例,女9例;年龄29~78岁,平均年龄(64.6±4.4)岁,其中乳头状癌14例,滤泡癌3例,髓样癌3例,未分化癌5例。所有患者经病理检测确诊为甲状腺癌,具有完整临床病理资料,所有患者均知情且同意。本研究经本院伦理委员会批准。
1.2 细胞与主要试剂 甲状腺癌细胞SW579购自上海雅吉生物科技有限公司;RPMI-1640培养基产自美国(由Gibco公司生产);荧光定量试剂盒购自国内(由上海科敏生物科技有限公司制造);四甲基偶氮唑盐比色法(methyl thiazolyl tetrazolium assay,MTT)试剂盒购自美国GeneCopoeia公司;凋亡检测试剂盒购自上海经科化学科技有限公司;吉姆萨染色液、蛋白提取试剂盒统一采购于国内,均由北京百奥莱博科技有限公司生产;试验使用的Transwell小室和Matrigel均购自美国,由BD公司生产;双荧光素酶报告基因检测试剂盒由南京诺唯赞生物科技股份有限公司提供。
1.3 方法
1.3.1 细胞处理与分组 取对数生长期甲状腺癌细胞 SW579,将 si-NC、si-Hsa_circ_0023642、miRNC、miR-653转染至SW579细胞中,记为si-NC组、si-Hsa_circ_0023642组、miR-NC组、miR-653组;将si-Hsa_circ_0023642分别与anti-miR-NC、anti-miR-653共转染至SW579细胞中,记为si-Hsa_circ_0023642+anti-miR-NC组、si-Hsa_circ_0023642+anti-miR-653组。
1.3.2 实时荧光定量PCR(RT-qPCR)检测Hsa_circ_0023642和miR-653的表达水平 将组织和细胞的总RNA分离出来,用以合成cDNA,根据荧光定量试剂盒的要求进行PCR操作,其循环的条件为95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,总共进行40个循环;使用2-△△Ct法计算相对表达量。GAPDH和U6分别用作Hsa_circ_0023642和miR-653的内参,Hsa_circ_0023642上游引物序列:5′-ATGACAAACTGACGGAAAAGGAG-3′,下游引物序列:5′-AACCAAGGGCAACAGCAATG-3′;GAPDH上游引物序列:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物序列:5′-GAAGATGGTGATGGGATTTC-3′;miR-653上游引物序列:5′-ACCAGCTTCAAACAAGTTCACTG-3′,下游引物序列:5′-GCTTCCATCTTATCATTCTTGCA-3′;U6 上游引物序列:5′-CTCGCTTCGGCAGCACATATACTA-3′,下游引物序列:5′-ACGAATTTGCGTGTCATCCTTGCG-3′;该引物购自国内上海生工生物工程公司。
1.3.3 MTT检测细胞增殖 培养48 h后,在各孔中注入20 μL MTT溶液并孵育4 h,然后添加二甲基亚砜并进行震荡反应,用量为150 μL,震荡时间为10 min,需使用酶标仪在波长490 nm处测量吸光度(OD)值。
1.3.4 克隆形成实验检测集落形成数 使用SW579细胞制作细胞悬液,浓度为1×104个/mL,然后在六孔板中接种,进行为期2周的培养,当出现肉眼可见克隆时停止培养,使用PBS清洗,共2次,使用甲醇固定,持续15 min,使用吉姆萨法染色,持续30 min,最后采用低倍光学显微镜对计数>50个细胞的集落进行计数。
1.3.5 流式细胞术检测细胞凋亡 对细胞进行为期48 h的培养,PBS漂洗,添加500 μL结合缓冲液,随后分别置入Annexin V-FITC和PI溶液中混合,Annexin V-FITC和PI溶液的用量分别为10 μL和5 μL,孵育10 min,孵育期间避免阳光照射。统计细胞凋亡率,统计设备为流式细胞检测仪。
1.3.6 蛋白质印迹(Western blot)法检测蛋白表达 提取细胞总蛋白(参考蛋白提取试剂盒说明书执行),将其中50 μL的蛋白样品进行SDS-PAGE,然后转移至PVDF膜上,使用5%牛血清蛋白对其进行封闭处理,时长为60 min;然后添加一抗在4℃条件下放置一夜,添加二抗在室温条件下放置1 h,加入化学发光试剂使其显影,研究分析其成像的蛋白条带灰度值,依据的公式为蛋白表达水平=目的条带/GAPDH条带。
1.3.7 细胞划痕实验检测划痕愈合率 各组细胞消化后在培养皿中培养,在盘底用记号笔划线做标记,细胞铺满后用枪头垂直横线划痕,用PBS冲洗划下的细胞,换液继续培养,在培养0 h和24 h后观察,用Image-Pro Plus6.0软件计算划痕愈合率。
1.3.8 Transwell检测细胞侵袭数 将100 μL稀释后的Matrigel添加到Transwell上室中,并充分混合,凝固后加入100 μL细胞悬液,下室加500 μL含血清培养液,培育24 h,结晶紫染色30 min,使用光学显微镜随机抓取5个视野观察观察细胞计数,倍数为200倍。
1.3.9 双荧光素酶报告实验 构建Hsa_circ_0023642的野生型和突变型荧光素酶载体wt-Hsa_circ_0023642和mut-Hsa_circ_0023642,然后和miR-NC、miR-653共同转染至SW579细胞,荧光素酶的活性依照说明书的要求进行。
1.4 统计学方法 使用SPSS 20.0软件处理实验数据,满足正态分布的计量资料,采用均数±标准差表示,采用t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 Hsa_circ_0023642和miR-653在甲状腺癌细胞中的表达 甲状腺癌组织中Hsa_circ_0023642的表达水平具有上升趋势,明显高于健康组织,而miR-653的表达水平则呈现出下降趋势(P<0.05),见图1。
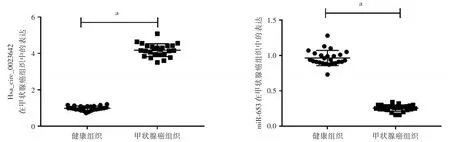
图1 Hsa_circ_0023642和miR-653的表达Fig.1 Expression of Hsa_circ_0023642 and miR-653
2.2 干扰Hsa_circ_0023642对甲状腺癌细胞增殖凋亡的影响 si-Hsa_circ_0023642组的Hsa_circ_0023642水平明显低于si-NC组,但miR-653、细胞凋亡率和Bax表达情况均呈上升趋势,细胞活性、集落形成数以及Bcl-2表达水平呈下降趋势(P<0.05),见图2、表1。
表1 干扰Hsa_circ_0023642对甲状腺癌细胞增殖凋亡的影响Tab.1 The effect of interference with Hsa_circ_0023642 on the proliferation and apoptosis of thyroid cancer cells ±s

表1 干扰Hsa_circ_0023642对甲状腺癌细胞增殖凋亡的影响Tab.1 The effect of interference with Hsa_circ_0023642 on the proliferation and apoptosis of thyroid cancer cells ±s
注:与si-NC组相比,aP<0.05
分组si-NC si-Hsa_circ_0023642 t值P值Hsa_circ_0023642 1.00±0.00 0.21±0.02a 18.187<0.001 miR-653 1.00±0.00 3.70±0.14a 33.404<0.001 OD值1.27±0.09 0.58±0.05a 11.608<0.001集落形成数(个)101.67±3.30 54.00±1.63a 22.433<0.001凋亡率(%)8.22±0.53 21.97±1.15a 18.808<0.001 Bax 0.13±0.01 0.63±0.05a 16.984<0.001 Bcl-2 0.81±0.06 0.25±0.02a 15.336<0.001

图2 干扰Hsa_circ_0023642对甲状腺癌细胞凋亡及Bax、Bcl-2蛋白表达的影响Fig.2 The effect of interference with Hsa_circ_0023642 on apoptosis and the expression of Bax and Bcl-2 proteins in thyroid cancer cells
2.3 干扰Hsa_circ_0023642对甲状腺癌细胞迁移侵袭的影响 与si-NC组相比,si-Hsa_circ_0023642组细胞划痕愈合率降低,侵袭细胞数减少(P<0.05),见表2。
表2 干扰Hsa_circ_0023642对甲状腺癌细胞迁移侵袭的影响Tab.2 The influence of interference with Hsa_circ_0023642 on the migration and invasion of thyroid cancer cells ±s
表2 干扰Hsa_circ_0023642对甲状腺癌细胞迁移侵袭的影响Tab.2 The influence of interference with Hsa_circ_0023642 on the migration and invasion of thyroid cancer cells ±s
注:与si-NC组相比,aP<0.05
分组si-NC si-Hsa_circ_0023642 t值P值划痕愈合率(%)55.70±2.34 34.18±1.60a 13.155<0.001侵袭细胞数(个)149.00±5.35 79.00±2.94a 19.861<0.001
2.4 Hsa_circ_0023642和miR-653靶向关系 Hsa_circ_0023642与miR-653有互补序列(图3);wt-Hsa_circ_0023642与miR-653转染的细胞荧光素酶活性降低(P<0.05),而mut-Hsa_circ_0023642与miR-653转染的细胞荧光素酶活性无明显变化(表3)。
表3 双荧光素酶报告实验Tab.3 Double luciferase report experiment ±s

表3 双荧光素酶报告实验Tab.3 Double luciferase report experiment ±s
注:与miR-NC组相比,bP<0.05
分组miR-NC miR-653 t值P值wt-Hsa_circ_0023642 0.96±0.08 0.18±0.02b 16.383<0.001 mut-Hsa_circ_0023642 1.00±0.08 0.96±0.06 0.693 0.527

图3 Hsa_circ_0023642和miR-653互补序列Fig.3 Complementary sequences of Hsa_circ_0023642 and miR-653
2.5 miR-653对甲状腺癌细胞增殖凋亡迁移侵袭的影响 miR-653组的miR-653水平明显高于miRNC组,细胞活性、集落形成数、细胞划痕愈合率、侵袭细胞数和Bcl-2表达水平呈下降趋势,细胞凋亡率和Bax表达水平呈上升趋势(P<0.05),见图4、表4。
表4 miR-653对甲状腺癌细胞增殖凋亡迁移侵袭的影响Tab.4 The effect of miR-653 on the proliferation,apoptosis,migration and invasion of thyroid cancer cells ±s
表4 miR-653对甲状腺癌细胞增殖凋亡迁移侵袭的影响Tab.4 The effect of miR-653 on the proliferation,apoptosis,migration and invasion of thyroid cancer cells ±s
注:与miR-NC组相比,bP<0.05
分组miR-NC miR-653 t值P值miR-653 1.00±0.00 5.09±0.16b 44.276<0.001 OD值1.29±0.12 0.52±0.03b 10.782<0.001集落形成数(个)101.67±4.50 46.33±1.25b 20.523<0.001凋亡率(%)8.23±0.54 23.99±1.20b 20.744<0.001划痕愈合率(%)56.33±2.31 31.53±1.73b 14.884<0.001侵袭细胞数(个)150.00±6.38 65.67±2.62b 21.178<0.001 Bax 0.13±0.01 0.83±0.06b 19.932<0.001 Bcl-2 0.82±0.08 0.17±0.02b 13.653<0.001
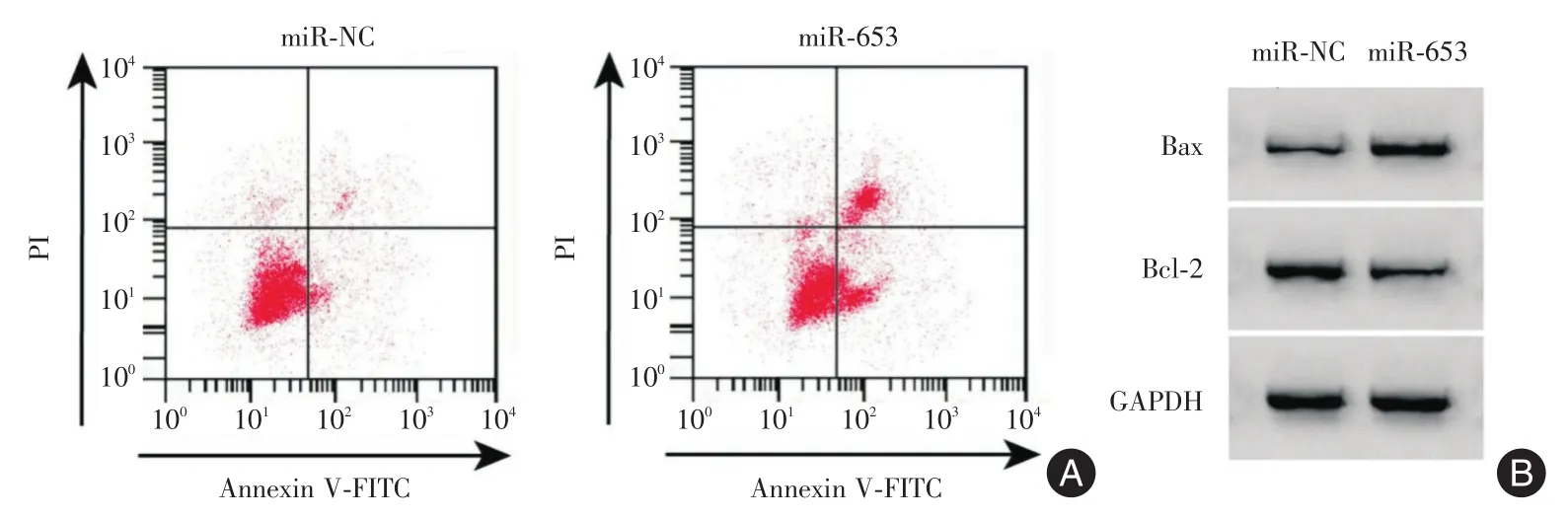
图4 miR-653对甲状腺癌细胞凋亡及Bax、Bcl-2蛋白表达的影响Fig.4 The effect of miR-653 on the apoptosis of thyroid cancer cells and the expression of Bax and Bcl-2 proteins
2.6 抑制miR-653可逆转干扰Hsa_circ_0023642对甲状腺癌细胞增殖凋亡迁移侵袭的影响 si-Hsa_circ_0023642+anti-miR-653组的miR-653水平明显低于si-Hsa_circ_0023642+anti-miR-NC组,同时细胞活性、集落形成数、细胞划痕愈合率、侵袭细胞数和Bcl-2均呈上升趋势,细胞凋亡率和Bax表达情况呈下降趋势(P<0.05),见图5、表5。
表5 抑制miR-653可逆转干扰Hsa_circ_0023642对甲状腺癌细胞增殖凋亡迁移侵袭的影响Tab.5 Inhibition of miR-653 can reverse the effect of interference Hsa_circ_0023642 on the proliferation,apoptosis,migration and invasion of thyroid cancer cells ±s

表5 抑制miR-653可逆转干扰Hsa_circ_0023642对甲状腺癌细胞增殖凋亡迁移侵袭的影响Tab.5 Inhibition of miR-653 can reverse the effect of interference Hsa_circ_0023642 on the proliferation,apoptosis,migration and invasion of thyroid cancer cells ±s
注:与si-Hsa_circ_0023642+anti-miR-NC组相比,cP<0.05
分组si-Hsa_circ_0023642+anti-miR-NC si-Hsa_circ_0023642+anti-miR-653 t值P值miR-653 3.71±0.13 1.50±0.06c 26.735<0.001 OD值0.57±0.05 1.16±0.08c 10.832<0.001集落形成数(个)55.33±1.25 89.00±3.27c 16.659<0.001凋亡率(%)21.92±1.16 13.11±0.69c 24.139<0.001划痕愈合率(%)34.13±1.80 51.43±2.49c 9.753 0.001侵袭细胞数(个)77.67±2.49 129.33±4.19c 18.358<0.001 Bax 0.64±0.05 0.26±0.02c 12.222<0.001 Bcl-2 0.24±0.02 0.69±0.05c 14.474<0.001
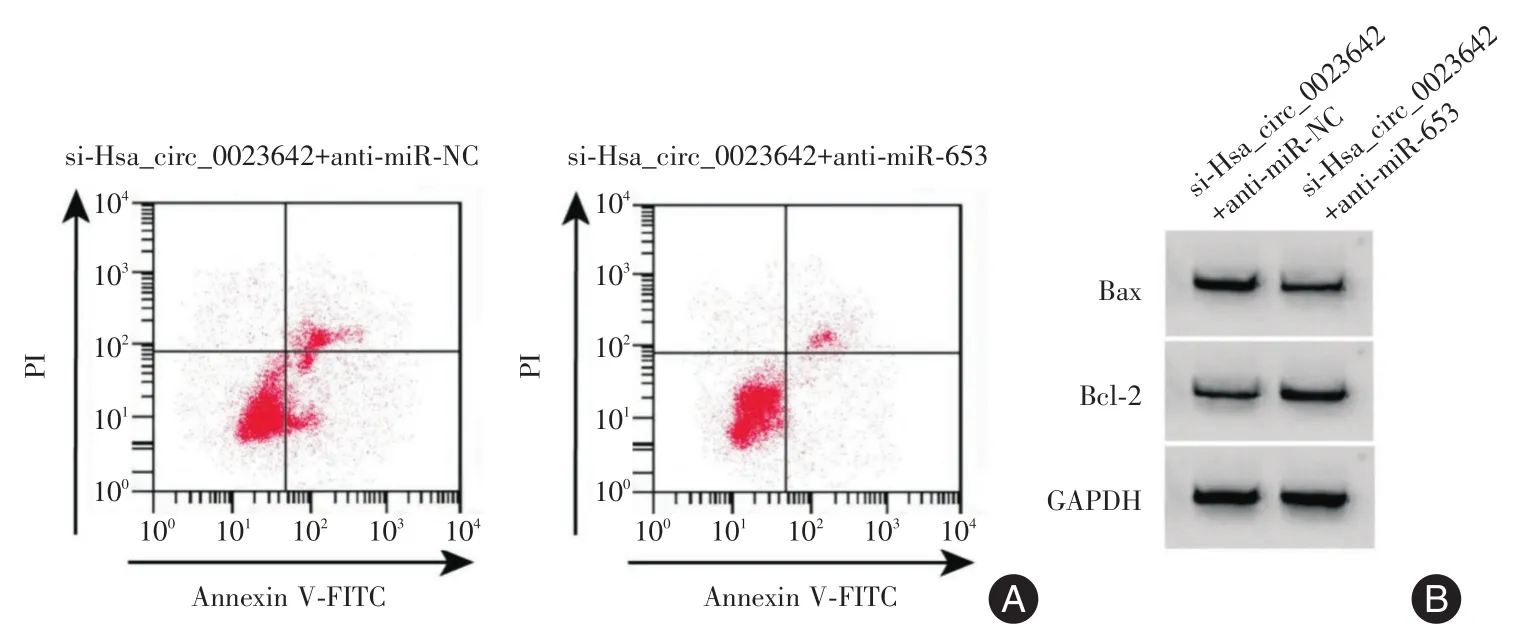
图5 抑制miR-653可逆转干扰Hsa_circ_0023642对甲状腺癌细胞凋亡及Bax、Bcl-2蛋白表达的影响Fig.5 Inhibition of miR-653 can reverse the effect of interference Hsa_circ_0023642 on the apoptosis of thyroid cancer cells and the expression of Bax and Bcl-2 proteins
3 讨论
随着对肿瘤生物学和癌症遗传学的认识,新型靶向疗法已用于甲状腺癌的治疗;了解甲状腺癌的分子机制,开发用于治疗甲状腺癌的靶向药物具有重要意义[12-14]。已有研究表明多种circRNA参与甲状腺癌的恶性生物学行为,如circ_0058124、circ_102171、circ-ABCB10可影响甲状腺癌细胞的增殖及侵袭[15-17]。有研究报道circ_0023642可促使胃癌细胞进行移动与侵袭[18]。而circ_0023642对甲状腺癌细胞的影响尚不清楚。本实验先检测了甲状腺癌组织中circ_0023642的表达水平,结果显示,甲状腺癌组织中circ_0023642的表达水平高于癌旁组织,表明circ_0023642可能在甲状腺癌中起促癌作用,这是circ_0023642在甲状腺癌中首次研究报道。为进一步研究circ_0023642对甲状腺癌细胞的恶性生物学行为的影响,本研究干扰circ_0023642,结果显示,细胞活性及划痕愈合率呈下降趋势,集落形成数及侵袭细胞数减少,而细胞凋亡率呈上升趋势;表明干扰circ_0023642抑制了甲状腺癌细胞的增殖、迁移和侵袭,并促进了细胞凋亡。提示circ_0023642或可作为甲状腺癌靶向治疗的分子靶点。
研究表明,circRNA可通过microRNA调节基因翻译和转录,进而影响一系列生物学过程[19]。因此,本实验通过生物学软件预测circ_0023642可能作用的下游miRNA,结果显示circ_0023642与miR-653有结合位点。研究报道miR-653可抑制非小细胞肺癌细胞的恶性生物学行为[20]。lncRNA PLK1S1通过调节miR-653促进了肾细胞癌细胞的增殖、侵袭和索拉非尼耐药[21]。ciRs-6以通过使miR-653海绵化抑制膀胱癌的生长[22]。说明miR-653可参与调控多种肿瘤的进展,且受circRNA的调控。本实验结果显示,甲状腺癌组织中miR-653表达水平降低;表明miR-653可能参与甲状腺癌的发生发展,且可能起抑癌基因作用。过表达miR-653后,细胞活性、集落形成数、细胞划痕愈合率以及侵袭细胞数均呈下降趋势,而细胞凋亡率呈上升趋势;说明过表达miR-653可抑制甲状腺癌细胞的增殖、集落形成及迁移侵袭,并促进细胞凋亡。本研究结果也表明circ_0023642可对miR-653进行靶向调控;并且抑制miR-653可逆转干扰circ_0023642对甲状腺癌细胞增殖、凋亡、迁移侵袭的影响,表明circ_0023642可能通过调控miR-653影响甲状腺癌的进展。miR-653也可作为甲状腺癌靶向治疗的分子靶点。
综上所述,干扰Hsa_circ_0023642可通过调控miR-653抑制甲状腺癌细胞的增殖、迁移侵袭,促进细胞凋亡。circ_0023642及miR-653均影响甲状腺癌进展,均可作为甲状腺癌可能的分子标志物及分子治疗的靶点。本实验的新颖之处在于发现了circ_0023642和miR-653在甲状腺癌中的可能作用。但本实验主要是在体外细胞中进行,尚未在体内进行验证,下一步会继续在体内进行验证。

