缺血性脑卒中与线粒体病理机制的相关研究进展
穆婷婷 汪宁 吴倩
1安徽中医药大学中西医结合学院 安徽合肥 230012;2安徽中医药大学中药复方安徽省重点实验室
脑卒中(cerebral stroke)又称“中风”,是因脑部血管突然破裂或血管阻塞导致血液不能流入大脑而引起脑组织损伤的一组急性脑血管疾病,为中医学“风、痨、臌、膈”四大疑难病之首[1-2]。其中缺血性卒中占卒中的67.3%~80.5%,是现代社会危害人类健康的头号杀手之一,也是卒中死亡的首要原因[3]。目前临床上多采用组织型纤溶酶原激活剂(tissue plasminogen activator,tPA)溶栓治疗,但由于受到时间窗限制,以及复灌造成的二次损伤而使其应用具有一定的局限性[1]。因此,深入研究缺血性脑卒中的发病机制对于其预防和治疗意义深远。线粒体作为细胞能量供应的主要场所,被称为细胞的“动力工厂”,对缺血缺氧极其敏感。缺血性脑卒中血液供应不足使能量耗竭,进而引起自由基的产生,线粒体膜电位降低,细胞内钙离子超载等,使线粒体首先受到损伤,而受损线粒体又会成为扩大缺血再灌注损伤的继发性关键因素,进一步加重缺血性损伤。因此,本文就线粒体在缺血性脑卒中的多方面变化作一综述(见图 1),旨在进一步了解缺血性脑卒中的发病机制并为其治疗提供理论依据。
1 缺血性脑卒中与线粒体功能变化
线粒体为脑组织最重要的供能单位之一,生理状态下为大脑提供大量且持续的能量,以维持脑组织的能量供应和正常功能。但当脑组织缺血缺氧时,电子传递链被破坏,不能释放足够的能量驱动ADP磷酸化生成ATP,导致能量生成障碍,也使得活性氧(Reactive Oxygen Species, ROS)激增。脑组织启动糖酵解途径进行能量代偿,代谢出的乳酸会使细胞内pH值下降,发生酸中毒,线粒体膜电位降低。而能量代谢障碍使得ATP酶所依赖的离子泵失活和谷氨酸受体启动增加,协同促进Ca2+相关通道开放[1],引起细胞内钙超载,加重脑水肿同时激活蛋白酶致细胞死亡。钙超载协同ROS激增共同促使线粒体通透性转运孔(mitochondrial permeability transition pore,mPTP)开放,大量小分子物质通过线粒体内膜,线粒体膜去极化,线粒体膜电位进一步下降,激活相关信号通路,启动线粒体凋亡途径,加重脑组织损伤。过剩ROS攻击细胞膜致线粒体嵴排列紊乱[4],空洞增大,线粒体结构被破坏,引发线粒体动力学失衡、线粒体自噬、线粒体免疫炎症等一系列病理生理过程,神经元也因缺少线粒体的供能造成损伤进一步加重,从而进入线粒体功能紊乱与脑组织损伤的恶性循环。
大量实验研究发现[5],脑缺血损伤后大鼠海马线粒体数量减少,基质透明化,膜磷脂层破坏,水肿、崩解,嵴断裂溶解、消失、间隙增大。各种检测结果表明海马线粒体内ATP含量显著降低,游离Ca2+水平显著升高。荧光显微镜下可以观察到缺血后大鼠海马线粒体mPTP开放度荧光强度显著升高、膜电位荧光强度显著降低。综上所述,脑缺血后,线粒体出现了一定程度上的结构损伤和功能紊乱。因此,线粒体功能的恢复对于缺血性脑卒中的治疗具有重要意义。
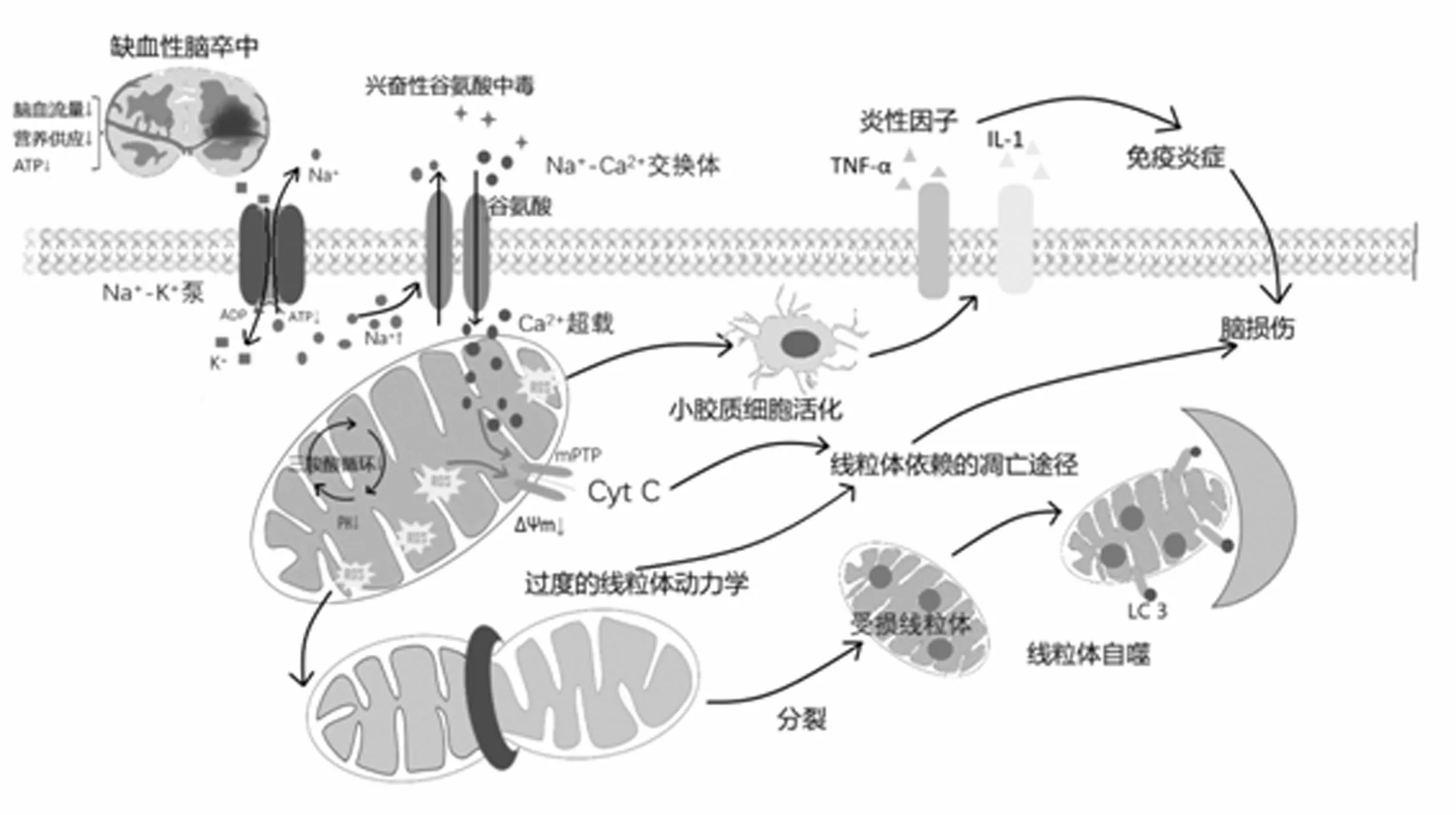
图1 缺血性脑卒中与线粒体级联反应示意图
2 缺血性脑卒中与线粒体代谢
线粒体是细胞代谢发生的主要细胞器。在线粒体内膜发生的三羧酸循环是三大营养物质供能的共同途径。脑组织所需要的能量主要来源于糖代谢,其余由脂类代谢供给,并尽量减少蛋白质代谢。脑组织不能直接利用糖、脂肪、蛋白质而以ATP的形式供能。
2.1能量代谢 当脑缺血发生时,能量代谢首先受到干扰,三羧酸循环障碍,过剩丙酮酸被还原成乳酸,造成乳酸大量堆积而发生乳酸性酸中毒,损伤脑组织,同时此途径的产能也较有氧呼吸大大减少。
研究发现大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型大鼠脑组织中乳酸含量升高,乳酸脱氢酶含量下降,提示脑缺血后发生无氧呼吸[6]。香丹注射液可以通过降低乳酸含量、升高乳酸脱氢酶水平发挥缺血后的脑保护作用。曹东敏等[7]发现MCAO大鼠脑组织乳酸含量上升,而作为三羧酸循环主要原料的柠檬酸含量降低,也说明了脑缺血后糖代谢水平下降,无氧呼吸代偿性增强。
2.2脂代谢 缺血性脑卒中发生时,能量供需失衡是造成脂代谢紊乱的主要原因。脂肪酸通过脂代谢生成酮体,在脑组织线粒体中经过一系列催化作用生成乙酰辅酶A进入三羧酸循环进行能量代偿。但此过程会造成能量失衡进而引发脂代谢紊乱,损伤脑组织。同时由于缺血性脑卒中后自由基的大量积聚,多种不饱和脂肪酸衍生的脂质过氧化物易被分解成丙二醛进一步加重脑损伤。
马翠翠等[6]观察到MCAO模型大鼠脑组织中丙二醛含量升高,过氧化氢酶和超氧化物歧化酶含量均出现下降,提示脑缺血后发生脂质过氧化和神经元受损病理过程。生理状态下,α-亚麻酸会代谢成二十碳五烯酸和二十二碳六烯酸,亚油酸代谢为 γ-亚麻酸和花生四烯酸并维持一定含量的稳态[8]。而缺血性脑卒中引发的能量失衡则会打破这一稳态,加重脑组织损伤。对脑缺血模型大鼠尿样和血样中的代谢物分析发现,给予香丹注射液后,与脂肪酸代谢有关的二十二碳六烯酸、亚油酸、花生四烯酸等发生显著逆转[6],提示香丹注射液抗脑缺血作用可能与干预大鼠体内的脂肪酸代谢途径有关。
2.3氨基酸代谢 随着氨基酸代谢水平的代偿升高,脑损伤程度也在进一步加重。氨基酸通过脱氨基作用被转变为氨和α-酮酸。后者可以通过糖异生进入糖代谢或合成酮体进入脂代谢供能。但值得注意的是,脑组织对氨基酸代谢产物氨极为敏感,大量氨进入脑组织,与三羧酸循环原料α-酮戊二酸结合生成大量谷氨酸,降低三羧酸循环速率的同时,也使得谷氨酸-谷氨酰胺代谢失衡,最终导致线粒体功能紊乱和神经组织损伤。
张天舒等[9]研究结果表明,MCAO模型大鼠左脑皮层和纹状体中谷氨酸含量下降,而皮层和海马中谷氨酰胺含量上升,这说明缺血引起了脑组织内谷氨酸-谷氨酰胺代谢紊乱。马翠翠研究团队[6]发现给予香丹注射液后,与氨基酸代谢有关的谷氨酸发生显著逆转。通过血清分析可以观察到MCAO模型大鼠谷氨酸含量显著上升[7],而给予人参总皂苷后,谷氨酸水平大大降低,也提示脑缺血后谷氨酸-谷氨酰胺代谢失衡,而人参总皂苷能抑制这一现象的发生。
综上所述,脑卒中后会发生一系列代谢异常,诸如能量代谢、脂代谢以及蛋白质代谢异常,通过改善缺血性脑卒中后的代谢对于神经保护具有重要意义。
3 缺血性脑卒中与线粒体依赖的凋亡途径
凋亡(Apoptosis)为程序性死亡的一种,是指生物体内细胞在特定的内源和外源信号诱导下,其死亡途径被激活,并在相关基因的调控下发生的程序性死亡过程。通过抑制脑缺血后的细胞凋亡有助于受损神经元的恢复[10-11]。在脑缺血中,线粒体过表达ROS和钙超载等事件发生,激活相关信号通路,从而引发由线粒体依赖的凋亡途径。目前,公认的比较经典的线粒体依赖的凋亡途径为:脑缺血后ROS激增和钙超载事件诱导mPTP开放,从而释放细胞色素C(Cytochrome C,Cyt C)及细胞凋亡诱导因子(apoptosis inducing factor,AIF)与半胱氨酸天冬氨酸蛋白酶-9(Caspase 9)的蛋白前体形成凋亡小体引发Caspase级联凋亡反应[12],最终释放促凋亡蛋白,损伤脑组织[13-14]。近年来大量研究表明,可以通过干预凋亡从而发挥脑保护作用。我国学者对缺血后凋亡展开了大量研究,发现中药复方及相关活性成分可以通过抑制凋亡发挥神经细胞保护作用[15-17]。
因此,抑制缺血性脑卒中时神经细胞的凋亡有助于挽回缺血造成的脑损伤。
4 缺血性脑卒中与线粒体动力学
线粒体是一种处于高度动态变化的细胞器[18],通过频繁的融合分裂形成网状结构来维持其正常功能与形态,参与细胞的能量代谢、自噬与凋亡等即线粒体动力学(mitochondrial dynamics),也称线粒体分裂融合。生理状态下,神经元末梢的长距离运输和能量均匀分布需要以线粒体融合分裂的动态平衡作为基本保证。而脑缺血发生时线粒体功能紊乱所引发普遍的线粒体动力学异常,产生大量片段化线粒体是致使细胞死亡的关键过程。通过抑制线粒体动力学异常,则可能在脑缺血损伤早期保护神经元。
荧光显微镜可观察到氧糖剥离/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)细胞模型损伤后,细胞线粒体分裂蛋白(dynamin-related protein 1,Drp1)荧光强度较正常组升高、线粒体融合蛋白(Optic atrophy 1,Opa1)荧光强度降低,而这两种线粒体融合分裂蛋白表达失衡标志着线粒体生理结构被破坏,表明线粒体融合分裂异常[19-20]。予以西红花苷可以有效下调Drp1表达、上调Opa1表达,同时改善线粒体功能[19],提示西红花苷可能通过干预线粒体分裂融合发挥神经保护作用。综上所述,脑缺血后线粒体功能紊乱造成的线粒体动力学失衡会损伤脑组织,因此尽快恢复线粒体动力学的正常功能对于改善脑神经功能具有重要意义。
5 缺血性脑卒中与线粒体自噬
线粒体自噬(Mitophagy)一词由 Lemasters在2005年首次提出。它是一种线粒体选择性自噬的过程[21],脑缺血后对受损线粒体的选择性清除[22]对于维持细胞稳态、改善神经功能具有重要意义。
袁扬[23]在透射电镜下观察到小鼠缺血复灌模型中存在损伤线粒体被双层膜自噬泡包裹的现象,证明了线粒体自噬的发生。沈哲[24]利用荧光共定位技术观察到神经元OGD损伤后线粒体与自噬泡标记物LC3的共定位情况,同样也表明了脑缺血后线粒体自噬的发生。进一步研究发现,当给予线粒体自噬抑制剂(Mitochondrial division inhibitor1,mdivi-1)后,线粒体自噬被抑制,并且加重了MCAO复灌后的脑梗死体积,上述结果表明了线粒体自噬在缺血复灌时的保护作用。因此,促进脑缺血后线粒体自噬,对于维持细胞内环境的稳态和修复神经组织损伤等都具有重要意义。
6 缺血性脑卒中与线粒体免疫应答
线粒体是自由基产生的主要部位[25]。缺血性脑卒中时,线粒体ROS的过表达可以使核因子-κB(Nuclear Factor-κB,NF-κB)[26]、趋化因子、干扰素调节因子-1(IRFs-1)等表达上调,进而导致多种促炎细胞因子,如白细胞介素-1(Interleukin-1,IL-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等[27]共同激发炎症反应,加重脑组织损伤,这种病理变化即缺血性脑卒中的免疫炎症反应[28-29]。目前的研究大部分都是通过抑制线粒体ROS的过表达从而降低炎性因子水平,发挥脑保护作用。
有文献报道,线粒体ROS抑制剂R(+)-普拉克索[R(+)-PPX]可以通过阻止mPTP的开放,保护线粒体膜完整性,进而抑制ROS的产生[30]。Chae U等[31]通过研究证明线粒体ROS可直接调节炎性因子的表达。丁锚等[32]猜想R(+)-PPX可以通过抑制ROS从而降低TNF-α等炎性因子的水平,发挥神经保护的作用。他们通过荧光染色技术发现,MCAO组大鼠再灌注6h缺血半暗带区ROS与TNF-α存在共定位的情况。并且MCAO组大鼠再灌注6 h缺血半暗带区TNF-α阳性细胞数明显增加,而予以R(+)-PPX组大鼠再灌注6 h缺血半暗带区TNF-α阳性细胞数明显减少。表明了R(+)-PPX可以通过降低TNF-α等炎性因子的水平,发挥神经保护的作用。
综上所述,脑缺血后线粒体内ROS上调炎性因子的表达致脑损伤加重,而抑制线粒体ROS的过表达可在脑缺血的早期损伤起到重要的神经保护作用。
线粒体是细胞能量供应最为重要的场所,对于缺血缺氧极其敏感,缺血性脑卒中发生后,会以线粒体为中心,引起一系列病理生理变化,诸如线粒体功能、线粒体能量代谢、线粒体依赖的凋亡途径、线粒体动力学、线粒体自噬、线粒体免疫炎症,而受损线粒体造成的能量障碍又会成为扩大损伤的关键继发因素,进一步加重缺血性脑损伤。本文以线粒体为中心,对缺血性脑卒中发生时线粒体的变化及可能的干预手段进行归纳整理,以对缺血性脑卒中的研究和治疗提供可能的线索。

