C an opy2对大鼠心肌缺血再灌注损伤心肌细胞凋亡的影响
宋丽茹,孙晨,马佳乐,杨滨,郭睿,闫萍
1.山西医科大学生物化学与分子生物学教研室,山西太原030001;
2.山西医科大学第二临床医学院心内科,山西太原030002
急性心肌梗死(acute myocardial infarction,AMI)是一种致死率较高的心血管疾病[1],再灌注能够有效减少AMI梗死面积,但再灌注本身可加重心肌损伤,称为心肌缺血再灌注损伤(myocardial ischemiareperfusion injury,MIRI)[2]。缺血组织快速恢复血流引起氧化应激损伤,导致细胞凋亡[3]。上述研究表明,减少AMI早期梗死边缘区心肌细胞的凋亡可明显降低MIRI的发生,是治疗AMI的主要研究方向之一。
Canopy2(Canopy FGFsignalingregulator2,CNPY2)由182个氨基酸组成,相对分子质量约21 000[4]。课题组前期研究发现,降低CNPY2可导致肿瘤细胞凋亡增加[5]。同时,有报道表明,心脏特异性过表达CNPY2能降低扩心病小鼠模型心肌细胞凋亡[6]。因此,推测CNPY2可能也与心肌细胞凋亡有关,而CNPY2是否参与MIRI早期心肌细胞凋亡尚不明确。多聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)是一种与细胞损伤密切相关的酶,可作为死亡底物参与细胞凋亡的过程。本研究通过大鼠MIRI模型分析MIRI后早期心肌组织中CNPY2的表达水平,且于大鼠体内体外分别过表达外源性CNPY2,初步探讨CNPY2对MIRI诱导心肌细胞凋亡的影响。
1 材料与方法
1.1病毒及细胞 Ade-GFP、携带人CNPY2基因(hCNPY2)的腺病毒Ade-hCNPY2-Flag和阴性对照腺病毒Ade-NC-Flag由生工生物工程(上海)股份有限公司构建;H9c2细胞由山西医科大学细胞库提供。
1.2主要试剂 异氟烷购自深圳瑞沃德生命科技公司;Protease Inhibitor Cocktail及HRP标记的山羊抗兔IgG购自美国Thermo Scientific公司;小鼠抗GAPDH单克隆抗体、HRP标记的山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司;兔抗CNPY2多克隆抗体购自美国Novus公司;兔抗PARP单克隆抗体购自美国CST公司;DMEM培养基购自美国Gibco公司;FBS购自美国ScienCell公司;Hoechst染色试剂盒购自上海碧云天生物技术公司;TUNEL试剂盒购自德国Roche公司;蛋白激酶K工作液购自北京Solarbio公司;DAB工作液购自上海基因科技有限公司。
1.3实验动物 普通级SD大鼠,雌性,6~8周龄,体重200~250 g,购自山西医科大学动物实验中心,动物合格证号为:SCXK(晋)2015-0001。本实验对大鼠的所有处理均以科研为目的进行养殖和使用,且按照动物伦理相关规定进行。
1.4细胞培养 将H9c2细胞用含10%FBS的DMEM高糖培养基,于37℃,5%CO2细胞培养箱中培养,常规换液,0.25%胰酶消化,进行传代,取第3代细胞进行后续试验。
1.5腺病毒M OI及感染时间的确定 将Ade-GFP按不同MOI(40、50、80、100、150)感染H9c2细胞,37℃,5%CO2细胞培养箱中培养48 h后,于倒置荧光显微镜下观察GFP表达情况,确定最适病毒MOI。以最适MOI感染H9c2细胞,相同条件连续培养10 d,每天于荧光显微镜下观察GFP的表达情况。
1.6CN P Y2蛋白的过表达 将Ade-hCNPY2-Flag和Ade-NC-Flag按最适MOI分别感染H9c2细胞,同时设空白对照组(未感染的H9c2细胞),于37℃感染48 h后,用0.5%NP-40蛋白裂解液提取细胞总蛋白,经12%SDS-PAGE分离后,转移至PVDF膜,用10%脱脂牛奶于室温封闭1 h;加入兔抗CNPY2多克隆抗体和小鼠抗GAPDH单克隆抗体(均1∶1 000稀释),于4℃孵育过夜;用TBST洗涤3次,每次10 min,分别加入HRP标记的山羊抗兔IgG和HRP标记的山羊抗小鼠IgG(均1∶1 000稀释),室温孵育1 h;ECL法显色。同时检测Ade-hCNPY2-Flag和Ade-NC-Flag感染H9c2细胞2、4、6、8 d后,细胞中CNPY2蛋白的相对表达水平,方法同上。
1.7过表达CN P Y2对体外缺血再灌注心肌细胞凋亡影响的检测 用腺病毒Ade-hCNPY2-Flag和Ade-NC-Flag感染第3代H9c2细胞,于37℃,5%CO2细胞培养箱中培养48 h;将H9c2细胞接种至6孔板中,待细胞融合度达50%~80%时,将细胞置37℃,5%CO2细胞培养箱中用DMEM高糖培养基(含10%FBS)培养,待细胞贴壁,弃培养基,PBS洗涤3次,加入H2O2(300μmol/L,2.5 h)氧化应激,诱导H9c2细胞凋亡;弃培养基,PBS冲洗,用固定液固定10 min;弃固定液,PBS洗涤2次,加入Hoechst 33258染色液,避光静置5 min;弃染液,PBS洗涤2次,滴加抗荧光淬灭封片液进行封片,荧光显微镜下观察,拍照。同时,采用Western blot法检测PARP蛋白的表达水平,方法同1.6项,其中一抗为兔抗PARP单克隆抗体,稀释度为1∶1 000。
1.8CN P Y2在大鼠心肌细胞中的定位 取大鼠心脏,将心脏组织置福尔马林溶液固定,制备2μm石蜡组织切片,透明,脱水,柠檬酸钠缓冲液修复,用20%山羊血清封闭,加入兔抗CNPY2多克隆抗体(1∶1 000稀释),于4℃孵育过夜;PBST洗涤3次,每次10 min,加入HRP标记的山羊抗兔IgG(1∶1 000稀释),室温作用30 min;PBST洗涤3次,每次10 min,进行细胞核DAPI染色,封片,拍照,观察CNPY2在细胞中的定位。同时设空白对照组(未滴加一抗)。
1.9大鼠M I R I心肌细胞中CN P Y2表达水平的检测SD大鼠经异氟烷吸入麻醉,气管插管,维持气管通气。左胸部第三四肋骨间打开胸腔,暴露心脏,用手术针线结扎左冠状动脉前降支,打活结,即刻给予Adeh-CNPY2-Flag心肌注射(100μL/200 g体重),60 min后去除结扎,恢复血供,完成再灌注。同时设假手术组(不注射病毒,仅手术)。取大鼠假手术组及再灌注后1、4、7 d组心脏组织的梗死及边缘区部分,采用Western blot法检测细胞中CNPY2蛋白的表达水平,方法同1.6项,以确定再灌注的最适时间。
1.10CN P Y2对大鼠M I R I心肌细胞凋亡影响的检测1.10.1TUNEL染色 按1.9项处理大鼠,分别给与Ade-hCNPY2-Flag和Ade-NC-Flag注射,于再灌注4 d,取两组大鼠心脏,制备为4μm的石蜡组织切片,脱水,加入蛋白激酶K工作液(20μg/mL),于37℃孵育20 min;PBS洗涤2次,两组均滴加反应液(TUNEL试剂盒中Enzyme Solution 5μL+Label Solution 45μL混合液),同时设相应对照组(滴加50μL Label Solution),37℃暗湿孵育60 min;PBS洗涤3次,滴加50μL converter-POD,37℃湿孵育30 min;PBS洗涤3次,滴加50μL DAB工作液,室温放置1~5 min;染色后树胶封片,显微镜下观察,拍照。
1.10.2Western blot检测 同1.10.1项处理小鼠,于再灌注4 d,取两组大鼠心脏组织,迅速加入液氮,研磨成粉末,用蛋白裂解液提取总蛋白,BCA法测定蛋白含量。取50μg蛋白,经12%SDS-PAGE分离后,Western blot法(同1.6项)检测PARP蛋白表达水平。
1.11统计学分析 应用ImageJ 2软件分析图像,Graphpad Prism 6.0软件进行统计学分析,所有数据均采用均值±标准差(x±s)表示,组间比较采用t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1最适M OI及感染时间 MOI=50时,荧光显微镜下绿色荧光最多,见图1,因此确定H9c2细胞的最佳MOI为50。以MOI=50进行细胞感染,感染6 d时还可见部分细胞存在绿色荧光,感染8 d时绿色荧光明显减少,见图2。因此确定感染后1周内为最适感染时间。
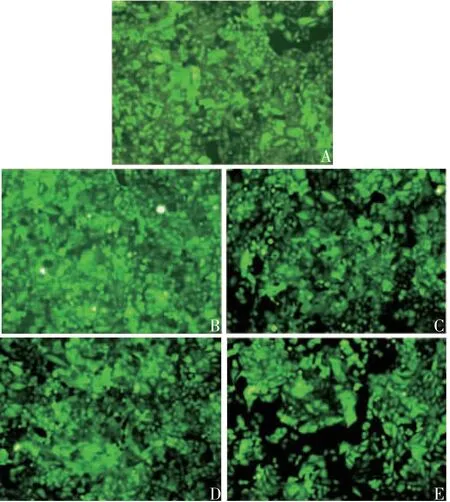
图1 不同MOI感染H9c2细胞的镜下观察(×100)Fig.1 Microscopy of H9c2 cells infected at various MOIs(×100)
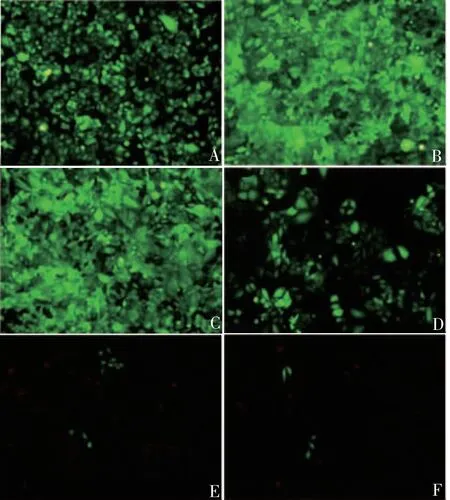
图2 不同感染时间H9c2细胞的镜下观察(×100)Fig.2 Microscopy of H9c2 cells infected for various days(×100)
2.2CN P Y2蛋白的过表达 以MOI=50感染,空白对照组、Ade-hCNPY2-Flag组和Ade-NC-Flag组H9c2细胞中CNPY2蛋白表达水平分别为0.050、2.271、0.057,Ade-hCNPY2-Flag组明显高于空白对照组及Ade-NC-Flag组(t分别为6.232和5.717,P<0.05),见图3。Ade-hCNPY2-Flag感染细胞后CNPY2蛋白表达水平逐渐升高,感染后4 d达最高,随后逐渐下降,但与Ade-NC-Flag比较,感染后2、4、6、8 d时,Ade-hCNPY2-Flag组中CNPY2蛋白表达水平明显升高(t分别为16.26、15.69、8.334、5.508,P分别为<0.01、0.01、0.05、0.05),见图4和图5。

图3 Western blot法检测各组H9c2细胞中CNPY2蛋白的表达情况Fig.3 Western blotting of CNPY2 expressed in H9c2 cells of various groups

图4 Western blot法检测不同感染时间H9c2细胞中CNPY2蛋白的表达情况Fig.4 Western blotting of CNPY2 protein expressed in H9c2 cells infected for various days

图5 不同感染时间H9c2细胞中CNPY2蛋白的表达水平Fig.5 Expression levels of CNPY2 protein in H9c2 cells infected for various days
2.3过表达CN P Y2对体外缺血再灌注心肌细胞凋亡的影响 Ade-NC-Flag+H2O2组和Ade-hCNPY2-Flag+H2O2组在一个视野下平均细胞凋亡率分别为17.61和7.250,表明过表达CNPY2可显著降低细胞凋亡率(t=5.147,P<0.05),见图6。Ade-NCFlag+H2O2组和Ade-hCNPY2-Flag+H2O2组细胞凋亡蛋白PARP的活性分别为0.583和0.269,表明过表达CNPY2蛋白可显著降低细胞凋亡蛋白PARP的表达水平(t=6.325,P<0.01),见图7。

图6 Hoechst33258染色法检测过表达CNPY2后H9c2细胞的凋亡情况(×200)Fig.6 Determination of apoptosis of H9c2 cells after CNPY2 overexpression by Hoechst33258 staining(×200)

图7 过表达CNPY2对H9c2细胞中PARP蛋白表达水平的影响Fig.7 Effectof CNPY2 overexpression on PARPprotein expression level in H9c2 cells
2.4CN P Y2的定位 CNPY2在心肌细胞的胞浆中表达,见图8。

图8 CNPY2在心肌细胞中的表达(×400)Fig.8 Expression of CNPY2 in cardiomyocytes(×400)
2.5大鼠M I R I心肌细胞中CN P Y2的蛋白表达水平假手术组及再灌注后1、4、7 d过表达组大鼠心肌细胞中CNPY2蛋白的表达水平分别为0.726、0.304、0.220、0.618。与假手术组比较,再灌注后过表达组1、4、7 d大鼠心脏梗死及边缘区组织中CNPY2的表达水平均明显降低(t分别为11.57、25.06、3.639,P分别<0.01、<0.001、<0.05),CNPY2的表达水平在再灌注1周内显著降低,第4天时尤为明显。见图9。

图9 Western blot法检测大鼠MIRI心肌细胞中CNPY2蛋白的表达Fig.9 Determination of CNPY2 expression in cardiomyocytes of rats with MIRIby Western blot
2.6CN P Y2对大鼠M I R I心肌细胞凋亡的影响
2.6.1TUNEL染色 Ade-hCNPY2-Flag和Ade-NCFlag组的细胞凋亡率分别为0.570和1.442,前者明显低于后者(t=9.947,P<0.01),见图10。表明对大鼠缺血心脏给予外源性CNPY2后,可明显抑制MIRI的发生。

图10 各组大鼠MIRI早期心肌凋亡情况的镜下观察(×400)Fig.10 Microscopy of myocardium apoptosis at early stage of MIRI(×400)
2.6.2Western blot检测 Ade-hCNPY2-Flag和Ade-NC-Flag组PARP蛋白表达水平分别为0.570和1.442,前者明显低于后者(t=9.947,P<0.01),见图11。表明缺血后过表达CNPY2对MIRI诱导的早期心肌凋亡可发挥显著保护作用。

图11 大鼠MIRI心肌细胞中PARP蛋白的表达水平Fig.11 Expression level of PARP in cardiomyocytes of rats with MIRI
3 讨论
MIRI的发生机制涉及多种病理生理行为,包括氧自由基的大量产生、钙超载、细胞凋亡、心肌能量代谢障碍等因素共同参与[7]。其中氧化应激损伤和细胞凋亡是MIRI中的重要环节。心肌由终末分化的心肌细胞组成,其负责心脏泵功能,成年哺乳动物心肌细胞几乎无再生能力,而过度的心肌细胞死亡,心脏会出现严重且持久的病理学效应[8]。细胞凋亡是一种高度调节的程序性细胞死亡过程,其中Caspase 3是细胞凋亡的关键执行者,一旦被激活,立即发生下游的级联反应,导致细胞凋亡[9]。当细胞内接受到凋亡信号时,在多种蛋白水解酶的作用下,激活后裂解成活性亚单位,激活的Caspase 3继续切割其不同底物,其中PARP是最重要作用底物之一[10],激活的Caspase 3切割为两个裂解片段而失去其正常功能,从而导致细胞凋亡[11]。
PARP是一种与细胞损伤密切相关的酶,也叫DNA修复酶,大量存在于真核细胞中。其中,PARP-1的含量最为丰富,是家族重要成员之一,相对分子质量约为116 000,约占细胞内酶活性的90%,PARP主要参与DNA转录、复制、修复、信号传导、细胞凋亡和基因调控等过程[12]。全长PARP识别凋亡信号,可将PARP羧基端的催化结构域(相对分子质量89 000)和氨基端的sbDNA结合结构域(相对分子质量24 000)分离,因此,PARP蛋白的Western blot检测可见2条蛋白条带,分离的越多表明凋亡越严重。PARP剪切是细胞凋亡的重要指标之一,通常认为是Caspase 3激活的指标。
本研究结果表明,MOI=50时,H9c2细胞感染效果最佳,感染1周内为最适感染时效,外源CNPY2-F LAG均高表达。同时建立过H2O2诱导H9c2细胞凋亡条件,通过细胞核Hoechst33258染色和West-ern blot检测凋亡蛋白PARP,明确CNPY2抗氧化应激诱导的心肌细胞H9c2凋亡,提示外源给予CNPY2对降低心肌细胞氧化应激损伤后的凋亡具有积极作用。因此,在缺血再灌注早期给予外源CNPY2,可能会降低MIRI和改善后期心功能。本研究在体内进行动物MIRI的模型制备,经免疫荧光追踪显示,心肌细胞是心脏CNPY2主要来源。与假手术组比较,给予Ade-hCNPY2-Flag的小鼠再灌注7 d内心脏梗死及边缘区CNPY2的蛋白水平显著降低(P<0.05),再灌注4 d时降低最明显(P<0.001)。在此基础上,通过腺病毒Ade-hCNPY2-Flag及Ade-NC-Flag分别注射来干预MIRI心肌早期CNPY2水平,TUNEL染色和Western blot检测表明,缺血早期过表达CNPY2可有效抑制活体大鼠MIRI早期的心肌凋亡。本研究为临床治疗AMI提供了新的靶点和思路,后续将对CNPY2保护心肌MIRI的分子机制进行进一步深入研究。

