新生牛血清快速筛选方法的建立
张豆,李月影,申硕,明平刚
武汉生物制品研究所有限责任公司,湖北武汉430207
Vero细胞是异倍体贴附依赖性细胞,细胞形态为成纤维细胞[1-3],属于传代细胞系。新生牛血清(newborn bovine serum,NBS)是疫苗生产用细胞培养不可缺少的重要物质,血清中生长激素、结合蛋白、蛋白酶抑制因子等物质在细胞生长和保护中发挥重要作用。血清质量会受小牛产地、个体差异、出生后采血时间、季节等因素的影响[4-9],导致各批次间质量存在差异。因此,在疫苗生产中,要建立NBS的筛选方法。在大批量使用或变换NBS进行大规模生产前,需对不同厂家及不同批次的NBS进行筛选[10-12]。
武汉生物制品研究所有限责任公司研制的新型冠状病毒灭活疫苗在生产中采用Vero细胞规模化培养病毒制备疫苗,血清筛选采用细胞收获量法,但该方法工作量大,时间长,不利于血清的大量筛选。因此,需建立更加快速的血清筛选方法。
本研究采用细胞收获量测定法、微量终点稀释测定法、相对增长率测定法、细胞3次连续传代培养法、细胞倍增时间测定法对12种来自不同公司,不同批号的NBS进行筛选,以期建立适应Vero细胞培养的NBS快速筛选方法。
1 材料与方法
1.1细胞及血清 Vero细胞(137代)由武汉生物制品研究所有限责任公司提供;12批NBS分别来自山西润生大业生物材料有限公司[批号分别为200426140(编号为A)和200505140(编号为M)]、内蒙古金源康生物工程有限公司[批号分别为20200424(编号为B)和20200524(编号为E)]、兰州民海生物工程有限公司[批号分别为20200317(编号为D)、20200512(编号为F)、20200605(编号为I)、20200527(编号为J)和20200217(编号为K)]、浙江天杭生物科技股份有限公司[批号分别为18060102(编号为G,为正在车间生产使用的一批血清,设为对照血清)、20060101(编号为H)和20050104(编号为L)]。
1.2主要试剂及仪器 M199培养基和非动物源性重组胰蛋白酶替代物购自美国Gibco公司;PBS(pH 7.4)由武汉生物制品研究所有限责任公司培养基室提供;碳酸氢钠购自美国Sigma公司;倒置显微镜购自德国Leica公司;细胞计数仪购自美国Thermo公司。
1.3细胞收获量测定法 将T175瓶中汇合度为100%的Vero细胞制成细胞悬液,按1∶8比例进行传代,分别加入T25培养瓶中,每批血清用3个T25培养瓶平行培养。将10 mL含10%待测血清或10%对照血清(实验前对待测血清和实验血清进行盲编,得到实验数据后揭盲)的培养基加至相应T25瓶中,于37℃,5%CO2孵箱中培养5 d。加入2 mL消化液消化并计数,按1∶8传代比例转移至新的T25瓶中,细胞共传代3次,传代周期为5 d,记录每1代次的细胞收获量。计算每次计数每组3个样本的总数和平均值。分别将3次第1、3、5天的各组细胞总数的平均数求和,并按照求和结果,从高到低排序并计分(如有6个样品,排在第1的计6分,第2的计5分,以此类推排第6的计1分)。将每种样品第1、3、5天的计分累加,并按照从高到低排序,计分相同的比较第5天的细胞总数,多的排在前面(第5天细胞总数相同的比较第3天细胞总数,第3天细胞总数相同的比较第1天细胞总数)。排在对照前的视为优胜血清,排在对照后的第5天细胞总数不低于对照20%的可备用,低于对照20%的淘汰。
1.4微量终点稀释测定法 在48孔板中加入含10%试验血清或对照血清的细胞培养液,向48孔板第1列的每孔中加入T25瓶中汇合度为100%的Vero细胞约20 000个,从第1~12列进行倍比稀释,细胞数分别为20 560、10 280、5 120、2 560、1 280、640、320、160、80、40、20、10个,体积为1 mL。每批血清设3个平行组。将48孔板培养板置37℃,5%CO2孵箱中培养10 d,观察在同一细胞浓度下不同血清的细胞生长状况,一般将稀释度较高的细胞作为主要观察对象[13-14]。从第7~11列(初始浓度为320、160、80、40、20个/孔)开始计数,第1~6列细胞已长满,12列细胞数量太少,均不计数。选则第7~10列进行评价。按照结果从高到低排序并计分,计分相同的比较第7列细胞总数,数量多的排在前面(第7列细胞总数相同的比较第8列细胞总数,第8列细胞总数相同的比较第9列细胞总数)。排在对照前的视为优胜血清,可备用。
1.5相对增长率测定法 将T175瓶中汇合度为100%的Vero细胞制成细胞悬液并计数,按1.0×105个/mL的终密度等体积分别加入T25培养瓶中,每批血清使用3个T25培养瓶平行培养。将10 mL含试验血清或对照血清的培养基加至相应瓶中,于37℃,5%CO2孵箱中培养5 d。加入2 mL消化液消化并计数,按1∶8的传代比例转移至新瓶中。细胞共传代3次,传代周期为5 d,计算每1代次的细胞收获量总数和平均值。并按下式计算细胞相对增长率[15]。细胞总数不低于对照组20%的可备用,低于对照组20%的淘汰。即相对增长率大于120%的血清可备用。

1.6细胞3次连续传代培养法 将T175瓶中汇合度为100%的Vero细胞制成细胞悬液并计数,按1.0×105个/mL的终密度等体积分别加入T25培养瓶中,每批血清使用3个T25培养瓶平行培养。将同一批细胞按每瓶1×105个的数量接种至T25培养瓶中,于37℃,5%CO2孵箱中培养5 d后,按每瓶1×105个细胞接种于T25瓶传代,连续传代3次并计数,计算每1代次细胞收获量的总数和平均值,并计算细胞相对增长率[10]。细胞总数不低于对照组20%的可备用,低于对照组20%的淘汰。即相对增长率大于120%的血清可备用。
1.7细胞倍增时间测定法 将T25瓶中汇合度为100%的Vero细胞,制成细胞悬液并计数。在48孔板每孔接种1.0×104个/mL细胞,培养液中含10%试验血清或对照血清的细胞培养液,每孔液体体积为1 mL,充分混匀。每批血清接种21孔。将48孔板培养板置37℃,5%CO2孵箱中培养,每隔24 h取3孔细胞计数,连续观察7 d,绘制细胞生长曲线,并按下式计算细胞倍增时间[9]。细胞生长曲线的最高峰值即血清促进细胞生长的最大增殖量。选择倍增时间小于对照组的血清作为备用血清。

式中T为细胞生长时间,A=log2Y/X(Y为细胞峰值前1 d细胞数,X为接种细胞数)。
1.8统计学分析 应用GraphPad Prism 6.01软件进行统计学分析,组间比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1细胞收获量测定法 12批血清积分结果由高到低排序为:J(34)、F(32)、K(29)、B(22)、E(20)、A(17)、M(15)、L(14)、G(13)、D(12)、H(11)、I(6),各试验组与对照组G相比,差异均有统计学意义(t分别为14.26、5.898、14.52、7.142、5.774、15.4、8.072、8.708、23.43、20.28、9.424,P分别为0.004 9、0.027 6、0.004 7、0.019、0.028 7、0.004 2、0.015、0.012 9、0.001 8、0.002 4、0.01)。其中,J、F、K、B、E、A、M、L、G、D、H可作为备用血清。见图1。

图1 细胞收获量测定法筛选不同批次NBSFig.1 Screening of NBSof various batches by cell harvest assay
2.2微量终点稀释测定法 12批血清积分结果由高到低排序为:J(46)、A(41)、K(41)、B(31)、E(30)、M(30)、F(26)、D(23)、L(16)、G(13)、H(10)、I(5),各试验组与对照组G比较,差异均有统计学意义(t分别为3.867、3.973、3.661、2.862、3.095、2.721、3.105、2.397、2.294、2.967、3.993,P分别为0.001 7、0.001 4、0.002 6、0.012 6、0.007 9、0.016 6、0.007 8、0.03、0.037 7、0.009 8、0.001 3)。其中,J、A、K、B、E、M、F、D、L可作为备用血清,见图2。
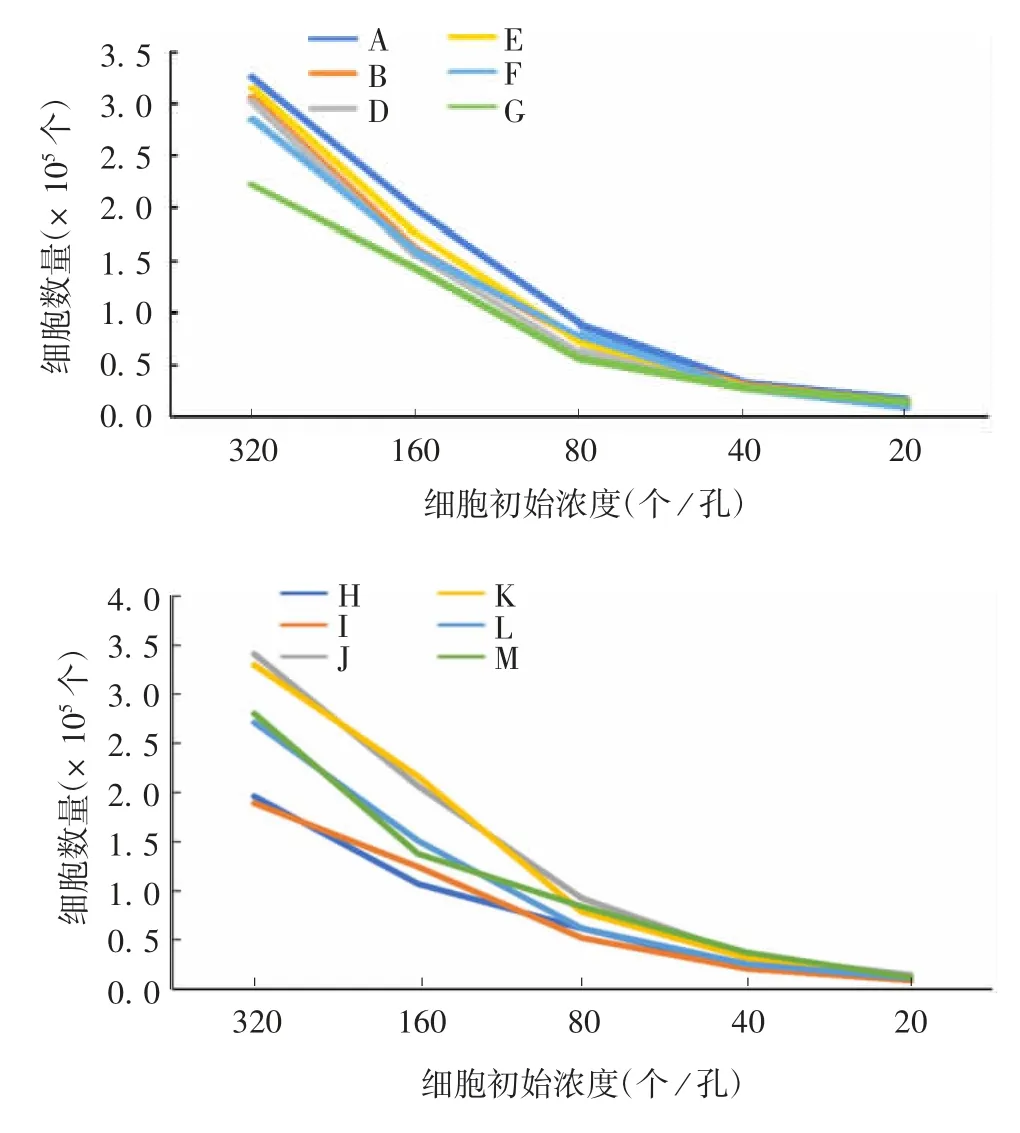
图2 微量终点稀释测定法筛选不同批次NBSFig.2 Screening of NBS of various batches by micro end point dilution assay
2.3相对增长率测定法 12批血清筛选结果由高到低排序为:J、F、A、E、K、L、M、D、B、G、I、H,各试验组与对照组G比较,差异均有统计学意义(t分别为6.231、11.9、6.757、9.595、9.614、3.256、7.891、5.773、3.075、4.045、3.005,P分别为<0.000 1、<0.000 1、<0.000 1、<0.000 1、<0.000 1、0.007 6、<0.000 1、<0.000 1、0.010 6、0.001 9、0.016 9)。J、F、A、E、K、L、M、D、B、G、I、H组的相对增长率分别为184%、172%、163%、149%、137%、128%、128%、117%、110%、100%、96%、92%,其中J、F、A、E、K、L、M可作为备用血清。
2.4细胞3次连续传代培养法 12批血清筛选结果由高到低排序为:J、F、A、D、K、E、L、B、G、M、H、I,其中M、H组与对照组G比较,差异无统计学意义(t分别为0.343 9和0.206 1,P分别为0.739 8、0.981 8),因此不参与排序;其余各试验组与对照组G比较,差异均有统计学意义(t分别为5.66、4.484、6.177、6.739、2.571、2.556、2.718、2.541、2.118,P分别为0.005、0.002、0.003、<0.000 1、0.033 1、0.033 8、0.026 3、0.034 7、0.042)。J、F、A、D、K、E、L、B、G、M、H、I组相对增长率分别为166%、164%、136%、135%、121%、120%、118%、112%、111%、100%、99%、98%,其中,J、F、A、D、K、E可作为备用血清。
2.5细胞倍增时间测定法 12批血清按细胞倍增时间由短到长排序为K(16.5 h)、L(16.78 h)、E(16.8 h)、I(17.5 h)、A(17.9 h)、D(17.9 h)、F(21.3 h)、B(22 h)、J(22.1 h)、G(22.3 h)、M(25.8 h)、H(26.2 h),其中J、M、H组与对照组G比较,差异无统计学意义(t分别为0.392 2、0.785 4、0.974 2,P分别为0.701 3、0.446 3、0.347 1),因此不参与排序;其余各试验组与对照组G比较,差异均有统计学意义(t分别为3.6、3.928、4.382、2.838、2.352、2.762、4.148、3.235,P分别为0.003 2、0.001 7、0.007 7、0.01 4、0.035 1、0.016 1、0.001 1、0.006 5)。见图3。K、L、E、I、A、D、F、B可作为备用血清。
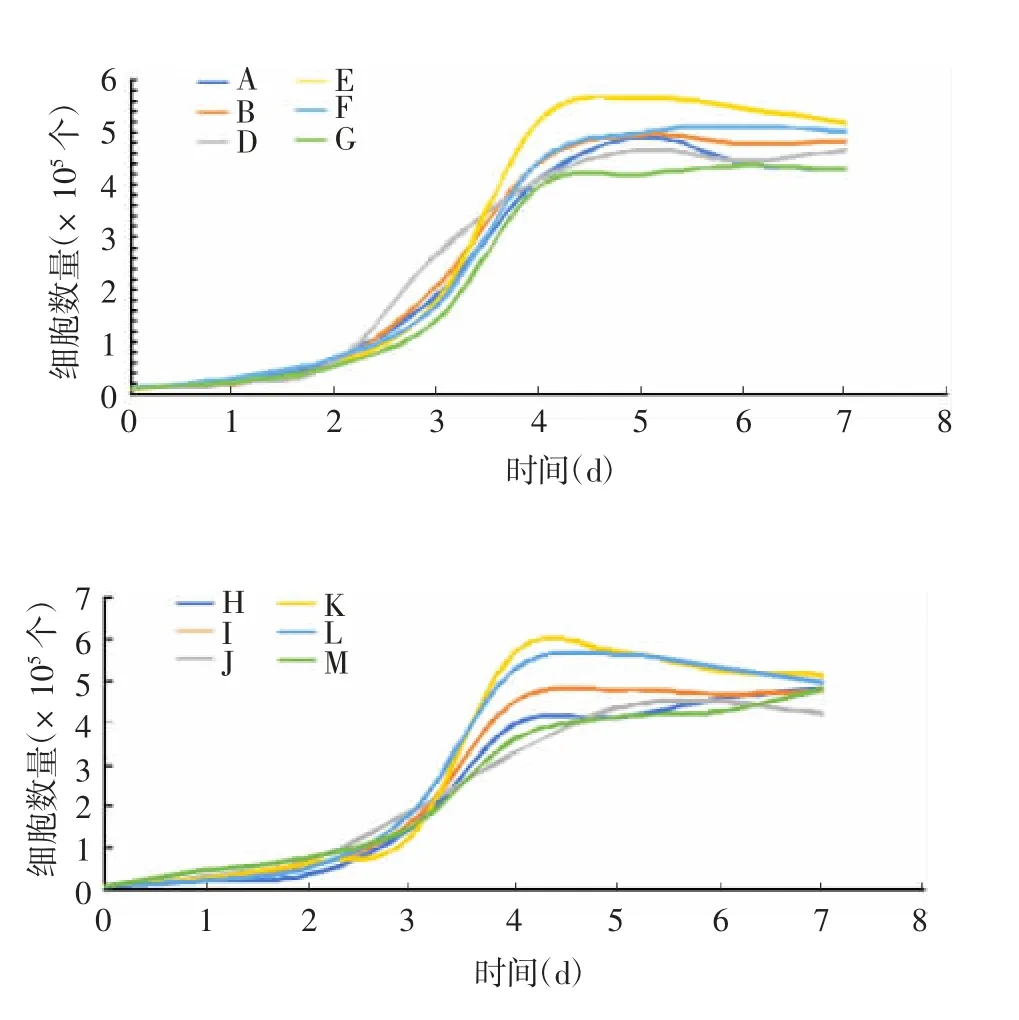
图3 细胞倍增时间测定法筛选不同批次NBSFig.3 Screening of NBS of various batches by doubling time assay
3 讨论
对于NBS的筛选有多种方法,本研究主要探索适用于疫苗规模化生产车间NBS快速筛选的方法。考虑到生产车间对于筛选时间的要求,本研究选择了细胞收获量测定法、微量终点稀释测定法、相对增长率测定法、细胞3次连续传代培养法、细胞倍增时间测定法5种方法对来源于不同厂家的11个批次的NBS进行了筛选,并设置正在车间生产使用的1批血清作为对照组。
细胞收获量测定法是目前武汉生物制品研究所有限责任公司筛选NBS的方法,该方法存在时间长,工作量大的缺点。相对增长率测定法和细胞3次连续传代培养法与细胞收获量测定法较相似,相对增长率测定法与细胞收获量测定法操作类似,均是连续传代3次,按1∶8比例传代。但相对增长率测定法是在传代第5天进行计数。计算相对增长率相比细胞收获量操作简化了许多,用相对增长量评价NBS比相对积分的方法更能定量计算细胞数量。从两种方法的筛选结果来看,相对增长率测定法与细胞收获量测定法结果基本一致。
细胞3次连续传代培养法与上述两种方法不同的是每次以固定的细胞数进行传代。每次接种时需使各瓶中细胞数一样,而实际上并不能保证各瓶中细胞数一致。以固定比例进行3次连续传代时,若开始传代时接种的细胞数量差别较大,则经过3次传代的累积,会造成极大的误差。而本研究中的细胞3次连续传代培养法每次传代时均会进行计数,以固定的细胞数量传代,可有效减小因实际传代细胞量不一致造成的误差。
微量终点稀释测定法和细胞倍增时间测定法与其他3种方法相比,操作更加简便,耗时也短。细胞倍增时间测定法用细胞增长1倍的时间长短来评价NBS的质量。该种评价方法不可取,因为有的血清使细胞在生长初期增殖快,但后期生长放缓,本实验结果也验证了该说法。细胞倍增时间测定法试验结果与其他4种方法的试验结果差距显著,而其他4种方法试验结果基本保持一致。
综上所述,本研究中选择的5种NBS筛选方法中,微量终点稀释测定法、相对增长率测定法和细胞3次连续传代培养法是适用于疫苗生产车间的快速筛选方法。

