虾青素提高人胶质瘤细胞放射敏感性的效应和机制
何淼 李超 杨桄权 陈兆红
(德阳市人民医院,四川 德阳 618000)
脑胶质瘤恶性程度高、发病率高,约占成人原发性恶性脑部肿瘤的80%〔1,2〕。星形细胞瘤是脑胶质瘤最主要的组成部分〔3〕。神经胶质瘤尤其是星形细胞瘤患者的预后很差,恶性脑胶质瘤的中位生存期仅15个月〔4,5〕。多种因素促成了脑胶质瘤的难治性:胶质瘤的生长极具浸润性,与周边正常组织难以区分,导致手术完全去除瘤体难度极大,手术切除率很低;脑胶质瘤本身的增殖活力高、对多种凋亡诱导因子具有抗性;由于血脑屏障(BBB)的先天作用,多种化疗药物难以透过BBB达到病灶局部的有效药物浓度〔6〕。放射治疗在脑胶质瘤治疗中占据重要地位,手术切除加放疗是其标准治疗手段,可延长患者的中位生存期〔7,8〕。随着先进放射治疗技术的突飞猛进,放疗在脑胶质瘤治疗当中的地位将会更加重要。然而,放疗效果同样受到手术切除范围、化疗情况、放疗前功能状态等多方面的影响〔9〕,且脑胶质瘤存在严重的放疗抵抗,因而如何在不增加副作用的前提下进一步提高放射治疗效果进而提高患者的生存质量是国内外研究热点〔10〕。由于药物到达脑胶质瘤病灶需要穿透BBB,而大多数药物无法高效穿过BBB,病灶局部药物不足以达到有效浓度,这一特殊的固有解剖位置成为严重制约靶向脑胶质瘤放疗增敏剂开发的因素。因此,开发高效低毒的脑胶质瘤放疗增敏剂意义重大。虾青素(ATX)是一种类胡萝卜素,广泛分布于水生动植物当中〔11〕。ATX具有强抗氧化作用,大量研究表明其在体内外对多种疾病均具有治疗作用,并且几乎无毒副作用〔12〕。研究表明ATX可通过调控细胞凋亡、自噬、细胞周期等多种途径,对多种癌症发挥抗肿瘤潜力,包括口腔癌〔13〕、结肠癌〔14〕、白血病〔15〕及肝细胞癌〔16〕等。更重要的是,ATX具有良好的BBB穿透能力,可穿过BBB深达脑瘤病灶发挥药效。然而ATX是否可对脑胶质瘤发挥放疗增敏作用,至今尚无文献报道。本研究拟以人胶质细胞瘤细胞株U251为研究对象,检测ATX对其放射敏感性的调控作用,并对其作用机制进行了初步研究。
1 材料与方法
1.1材料与仪器 胶质瘤细胞U251由中科院上海生命科学研究所提供;ATX购自美国Sigma公司,并将其10 mg粉末溶解在100 μl二甲基亚砜(DMSO)中后,加入超纯水配成浓度为10 g/L的悬液备用;DMEM高糖培养基购自Gibco公司;胎牛血清(FBS)购自美国Hyclone公司;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购自BD公司;蛋白裂解液购自美国Kaygen公司;二喹啉甲酸(BCA)试剂盒购自碧云天生物技术研究所;二抗购自美国CST公司;细胞培养箱购自美国Thermo公司;6 MV X线直线加速器购自德国西门子公司;流式细胞仪购自美国Beckman Coulter公司;酶标仪购自TECAN公司(型号为Infinite F50)。
1.2方法
1.2.1细胞培养 将人脑胶质瘤U251细胞株在含有10%FBS和100 U/ml青霉-链霉素的DMEM高糖培养液中进行常规培养,并放置于条件为37℃、5%CO2饱和湿度培养箱中,细胞生长良好,3~4 d进行1次传代。采用对数生长期的细胞实施实验。
1.2.2细胞分组 将对数生长期的U251细胞接种在6孔板中(每孔1×105/ml)并分组:未照射对照组、未照射+5 μmol/L ATX组、未照射+20 μmol/L ATX组、照射对照组、5 μmol/L ATX+照射组、20 μmol/L ATX+照射组。
1.2.3CCK-8检测细胞活力实验 将人脑胶质瘤U251细胞(5 000个细胞/孔)接种在96孔板中,过夜培养。吸去培养基,以排枪向各孔中加入含不同浓度的100 μl ATX悬液,在作用后24 h加入10 μl CCK-8溶液,继续孵育2 h,用酶标仪测定450 nm波长处的吸光度(OD值),按照以下公式计算细胞抑制率并拟合曲线从而计算IC50值。
1.2.4克隆形成实验 将对数生长期的人脑胶质瘤U251细胞按照射剂量不同接种于含3 ml培养基中(按照照射剂量由低到高接种细胞数为200、400、800、1 200、1 600个/孔),在细胞培养箱中静置6 h待其贴壁。细胞贴壁后按照不同浓度进行给药。药物处理24 h后,以每皿3 ml DMEM高糖培养基换液,将细胞分别以8 Gy的剂量进行X射线照射。用磷酸盐缓冲液(PBS)洗涤细胞,并在新鲜培养基中培养。13 d后,用甲醇固定细胞,干燥后以结晶紫染色10 min,清水缓缓冲去染液,待其干燥。以肉眼计数克隆数:含50个以上的细胞团计数为1个克隆,计算克隆形成率、出种率(PE),细胞存活分数(SF)。采用Sigma Plot13.0软件对克隆形成实验进行曲线拟合及数据分析(单击多靶模型)。
1.2.5细胞凋亡实验 将对数生长期的U251细胞放入培养箱中培养24 h后,按6 Gy剂量进行照射。照后24 h收集全部细胞于离心管内,以1 000 r/min离心5 min,PBS洗涤并离心2次。加入500 μl的结合缓冲液悬浮细胞;将5 μl Annexin V-FITC和5 μl PI染色溶液混匀后在避光条件下室温中反应15 min,通过流式细胞仪检测,用流式细胞仪自带软件分析各组细胞凋亡率。
1.2.6Western印迹 收集细胞在蛋白裂解液中裂解,在4℃下以12 000 r/min离心20 min。通过BCA试剂盒定量蛋白浓度,使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电脉(SDS-PAGE)分离等量的蛋白质,在4℃下进行300 mA恒流转膜。随后将膜在5%脱脂牛奶中室温封闭1 h,在4℃下用B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)、含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3及β-actin一抗过夜孵育,加入二抗在室温下保持1 h,进行电化学发光(ECL)显影曝光检测。
1.3统计学方法 采用Graph Pad Prism6.0软件进行t检验及方差分析。
2 结 果
2.1ATX抑制U251细胞增殖 未照射+5 μmol/L ATX组〔(78.87±4.66)%〕和未照射+20 μmol/L ATX组细胞存活率〔(65.97±2.35)%〕均明显低于未照射对照组〔(93.69±3.56)%,均P<0.05〕。同时,5 μmol/L ATX+照射组〔(42.85±5.75)%〕和20 μmol/L ATX+照射组细胞存活率〔(34.79±3.05)%〕均明显低于照射对照组〔(67.47±5.22)%,P<0.05〕;且20 μmol/L ATX+照射组细胞存活率显著低于5 μmol/L ATX+照射组(P<0.05)。
2.2ATX提高U251细胞放射敏感性 未照射+5 μmol/L ATX组(0.94±0.02)与未照射对照组(0.98±0.02)克隆形成能力无明显统计学差异(P>0.05);未照射+20 μmol/L ATX组克隆形成能力(0.81±0.01)明显低于未照射对照组(P<0.05)。同时,5 μmol/L ATX+照射组(0.35±0.06)和20 μmol/L ATX+照射组(0.06±0.01)克隆形成能力明显低于照射对照组(0.77±0.01均P<0.05);且20 μmol/L ATX+照射组克隆形成能力明显低于5 μmol/L ATX+照射组(P<0.05)。
2.3ATX提高细胞辐射诱导后U251细胞凋亡 未照射对照组〔(3.366±0.364 1)%〕、未照射+5 μmol/L ATX组〔(4.118±0.205 2)%〕和未照射+20 μmol/L ATX组细胞凋亡率〔(4.750±0.186 7)%〕无统计学差异(均P>0.05)。5 μmol/L ATX+照射组〔(10.684±0.199 5)%〕与20 μmol/L ATX+照射组细胞凋亡率〔(15.912±0.368 9)%〕明显高于照射对照组〔(6.682±0.236 0)%,均P<0.05〕;且20 μmol/L ATX+照射组细胞凋亡率明显高于5 μmol/L ATX+照射组(P<0.05),见图1。

图1 虾青素提高细胞辐射诱导后U251细胞凋亡
2.4ATX调节U251细胞中Bcl-2、Bax和Caspase-3的蛋白表达 未照射对照组与未照射+5 μmol/L ATX组和未照射+20 μmol/L ATX组3组Bcl-2、Bax和Caspase-3蛋白无统计学差异(均P>0.05)。照射对照组Bcl-2、Bax表达水平明显高于5 μmol/L ATX+照射组与20 μmol/L ATX+照射组,而Caspase-3表达明显低于5 μmol/L ATX+照射组与20 μmol/L ATX+照射组(均P<0.05);且20 μmol/L ATX+照射组Bcl-2、Bax表达水平明显低于5 μmol/L ATX+照射组,而Caspase-3表达水平明显高于5 μmol/L ATX+照射组(均P<0.05),见图2,表1。

1~6:未照射对照组,未照射+5 μmol/L ATX组,未照射+20 μmol/L ATX组,照射对照组,5 μmol/L ATX+照射组,20 μmol/L+ATX+照射组图2 ATX调节U251细胞中Bcl-2、Bax和Caspase-3的蛋白表达
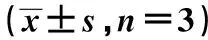
表1 Western印迹检测Bcl-2、Bax和Caspase3的蛋白表达
3 讨 论
放射治疗是脑胶质瘤治疗的重要组成部分,治疗技术和治疗策略已得到了明显改善,但晚期脑胶质瘤患者放疗预后仍然非常差,5年存活率为30%~35%〔9〕。相关研究发现,脑胶质瘤放疗失败的部分原因归于放疗抵抗导致的肿瘤侵袭、转移、复发〔2〕。因此,发现一种新型高效低毒放疗增敏剂以提高脑胶质瘤的放射敏感性和提高脑胶质瘤预后具有十分重要的意义。ATX属于叶黄素家族,具有抗氧化,抗肿瘤,抗炎和保护心脏的作用,对人类具有潜在的益处〔17〕。越来越多的研究表明,ATX作为一种有前景的治疗方法,可调节肿瘤进展中的几种生理反应〔12〕。研究发现,ATX可通过调节NF-κBp65和Wnt/β-catenin信号通路抑制人肝癌细胞系LM3和SMMC-7721的生长〔18〕。尽管ATX对人类肿瘤的作用已被广泛研究,但ATX在脑胶质瘤放疗中的作用研究未见报道。因此,本研究对ATX在脑胶质瘤治疗中潜在的放射增敏作用及其初步作用机制进行了研究。我们通过克隆形成实验发现给与ATX可降低IR后U251细胞的克隆形成能力,且随剂量增大其增敏效果越明显。本研究表明ATX对脑胶质瘤U251细胞具有放射增敏作用,且随着药物剂量的增加,其放射增敏效果增强。研究证实,细胞放射敏感性同细胞凋亡率密切相关,细胞照后凋亡率越高,其放射敏感性越强〔19〕。而我们的实验结果与此呼应,通过进一步检测凋亡通路关键分子的表达与活化发现,ATX可抑制U251细胞的抗凋亡因子Bcl-2及Bax的表达,促进凋亡执行蛋白Caspase-3的活化,从而有效地启动凋亡途径,实现了对该细胞照射之后生存率、克隆形成能力的调控。此外,相关研究提示由于肿瘤细胞c-myc癌基因表达被抑制,引起了肿瘤细胞的凋亡途径被下调,从而增强了其对放化疗的治疗抗性〔20〕,而ATX正是通过提高其凋亡途径达到消除放疗抵抗的目的,从而从理论上印证了ATX作为新型放疗增敏剂的开发前景。综上所述,虾青素对脑胶质瘤细胞具有十分明确的放射增敏作用,且该作用强弱与ATX的浓度间存在者一定的剂量相关性。此外,ATX的这种放射增敏性是通过增强U251细胞的凋亡通路而实现的,部分解释了其作用机制。然而,限于本研究的深度,ATX对人脑胶质瘤细胞放疗增敏作用的临床应用潜力及具体分子机制仍有待完善。

