脑蛋白水解物-Ⅰ防治C57小鼠脑衰老的作用机制
朱琳 任宇倩 倪钦帅 李义召 任雷鸣 郭云良
(1青岛大学医学部中西医结合中心,山东 青岛 266021;2济南房干康复医院;3河北医科大学中西医结合研究所)
衰老是一种生物过程,其特点是生理功能逐渐退化,导致发病率和死亡率上升。衰老是大脑衰退的主要因素之一,涉及逐渐的学习和记忆丧失,认知障碍和痴呆症,如阿尔茨海默病〔1,2〕。 Harley等〔3〕在1990年提出了衰老的端粒学说,端粒磨损是导致衰老的重要因素〔4,5〕,而端粒长度的维持主要依赖于端粒酶的活性。脑内端粒酶活性的降低可引起神经元衰老和死亡,进而导致认知功能衰退〔6〕,这提示激活端粒酶可能是保护神经元和延缓脑衰老的有效方法。端粒酶逆转录酶(TERT)是端粒酶催化亚基,在端粒酶活性调节中发挥重要作用,可以在转录和翻译水平调控端粒酶的表达。TERT可被多种转录因子上调从而增加端粒酶活性,其中信号传感器和转录激活因子(STAT)3已被证实是TERT的重要激活因子〔7〕。磷酸化STAT3是STAT3的主要活性形式,在神经系统中发挥重要作用。有研究表明,增加脑源性神经营养因子(BDNF)的表达和上调STAT的磷酸化水平〔8〕,可以促进神经再生,改善神经损伤。注射用脑蛋白水解物(CH)-Ⅰ是一种从猪脑组织中提取的富含多肽和游离氨基酸的混合物,具有类神经营养因子的作用,此类脑组织多肽可以透过血脑屏障,提高神经元存活率,调节神经元可塑性,修复神经元〔9,10〕。但是,迄今关于CH-Ⅰ对脑衰老损伤的作用及可能的作用机制鲜有报道。因此,本研究试图通过建立D-半乳糖诱导的动物衰老模型,探究CH-Ⅰ防治脑衰老损伤的作用及可能的机制。
1 材料和方法
1.1主要试剂 注射用CH-Ⅰ(批号:0190501-1,30 mg/支)购自河北智同生物制药公司;D-半乳糖(D-gal,批号:K1915124,纯度≥99%)购自上海阿拉丁试剂公司;端粒酶PCR-酶联免疫吸附试验(ELISA)试剂盒(1185666910)购自德国罗氏公司;STAT3(AF6294)、磷酸化(p)-STAT3(Tyr705,批号:AF3293)、β-actin(批号:AF7018)抗体购自美国Affinity公司;BDNF(批号:381133)抗体购自成都正能生物技术公司;TERT抗体(批号:NB100-317)购自美国Novus公司。
1.2主要仪器 酶标仪(SYNERGYH1)购自美国Bio-Tek公司;垂直电泳仪(PowerPacTMHC)购自美国Bio-Rad公司;光学显微镜(IX-70)购自日本Olympus公司;PCR仪(T100TM)购自美国Bio-Rad公司。
1.3实验动物 健康雄性C57/BL6N小鼠(SCXK2016-0006)48只,8周龄,SPF级,购自北京维通利华实验动物技术公司。饲养于青岛大学实验动物中心SPF级实验动物室,温度控制在23~25℃,自然光照,自由饮食,适应性饲养1 w。将小鼠随机分为正常组、模型组、CH-Ⅰ低剂量组(3 mg/kg)和CH-Ⅰ高剂量组(6 mg/kg),每组12只。对照组小鼠颈背部注射生理盐水,其余小鼠颈背部皮下注射D-gal 150 mg/kg,每天1次,持续8 w。根据Nam等〔11〕所述,D-gal给药3 w后,给药组小鼠按分组分别给予腹腔注射CH-Ⅰ 3 mg/kg和6 mg/kg,对照组和模型组小鼠腹腔注射等量生理盐水,持续5 w。药物干预结束7 d后,使用Morris水迷宫试验检测小鼠的学习能力。动物实验过程严格遵守动物伦理学要求。
1.4Morris水迷宫实验 采用Morris水迷宫实验〔12〕检测小鼠的空间学习和记忆能力。小鼠连续5 d进行隐藏平台测试,小鼠每天进行4次训练,并在第6天进行探针试验。在隐藏平台测试中,小鼠可以在60 s内自由到达隐藏平台,并允许在平台上停留30 s。当小鼠找到平台时,记录所需时间,如果小鼠在60 s内找不到平台,将被引到平台并停留30 s。平台在第6天被移除,各组小鼠自原平台对角线象限出发寻找平台,记录找到原平台所用时间和在平台象限停留时间。
1.5苏木素-伊红(HE)染色 水迷宫实验结束后,每组随机选取4只小鼠深度麻醉,经心脏灌注0.9%生理盐水和4%多聚甲醛,完整取脑〔13〕。脑组织常规脱水、透明、浸蜡、包埋,自乳头体后(海马区)连续冠状切片,厚度7 μm,每隔3张抽取1张,贴于多聚赖氨酸处理的切片上。根据HE试剂盒的说明进行染色,海马切片常规脱蜡水化,苏木素染色3 min,分化液分化10 s,自来水浸泡15 min,伊红染色1 min,自来水终止显色。常规脱水、透明,中性树胶封片。光镜下观察海马结构,细胞核呈蓝色、细胞质呈不同程度的红色。倒置显微镜下观察海马CA1区染色情况,每张切片随机选取5个不重叠的高倍(×400)视野,计数细胞,取其均值。以变性细胞指数(DCI=变性细胞数/细胞总数)表示损伤程度。
1.6Western印迹 提取小鼠海马组织中的总蛋白,二喹啉甲酸(BCA)法测定其蛋白浓度。样品用十二烷基硫酸盐-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转移到聚偏乙烯(PVDF)膜上。5%脱脂奶粉(1×TBST 配制)室温封闭2 h。洗膜后加一抗(BDNF 1∶1 000、STAT3 1∶1 000、p-STAT3 1∶1 000、TERT 1∶500、β-actin 1∶1 000)于4℃孵育过夜,洗膜后加二抗(1∶10 000)室温孵育1.5 h,ECL发光试剂显色。使用ImageJ软件计算目的蛋白与内参蛋白β-actin的比值。
1.7端粒酶活性检测 采用端粒酶PCR-ELISA试剂盒检测端粒酶活性。使用试剂盒自带的裂解液裂解小鼠海马组织,将裂解提取物添加到含有端粒酶底物的反应混合物中。随后转移到PCR仪中进行延伸和扩增,测量方案如下:25℃ 30 min;94℃ 5 min,94℃ 30 s,共30个循环;50℃ 30 s,72℃ 90 s,72℃ 10 min。RNA酶灭活的提取物作为阴性对照,试剂盒提供的提取物作为阳性对照。将5 μl PCR产物加入25 μl变性试剂和225 μl杂交缓冲液后,向链霉亲和素预涂的96孔板中加入100 μl/孔的PCR产物,37℃变性杂交2 h,然后使用抗地高素过氧化物酶结合物和3,3′,5,5′-四甲基联苯胺(TMB)底物进行ELISA检测,使用酶标仪测定450 nm和690 nm处的吸光度。相对吸光度=样品吸光度(A450 nm-A690 nm)-阴性对照吸光度(A450 nm-A690 nm),相对吸光度大于0.2为端粒酶阳性。
1.8统计学分析 采用SPSS22.0 软件进行单因素方差分析、LSDt检验。
2 结 果
2.1水迷宫实验结果 模型组抵达平台所用时间较对照组显著延长(P<0.01),而在平台象限的停留时间较对照组明显缩短(P<0.01),这提示模型鼠的学习记忆能力出现障碍。与模型组相比,CH-Ⅰ低、高剂量组抵达原平台所用时间较模型组显著缩短(P<0.05),在平台象限停留时间明显延长(P<0.01),并且CH-Ⅰ高剂量组和低剂量组小鼠之间无显著性差异(P>0.05)。见图1、表1。
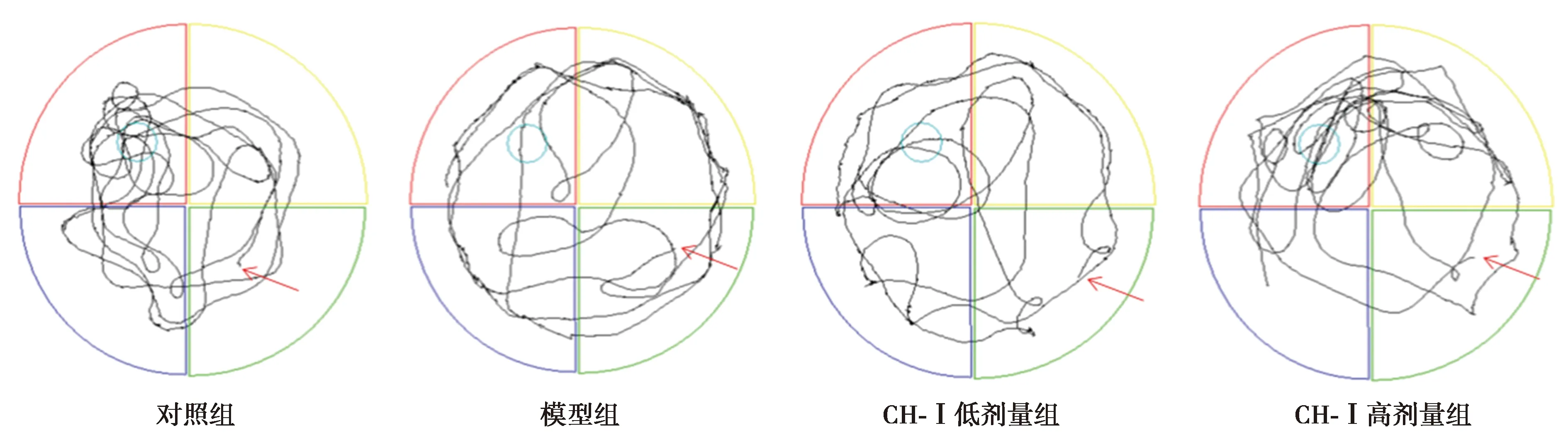
图1 各组小鼠在水迷宫探索实验中的运动轨迹
表1 CH-Ⅰ对小鼠抵达平台时间和平台象限停留时间的影响
2.2小鼠海马CA1区HE染色 对照组海马CA1区神经元排列整齐,核内可见明显核仁;模型组海马神经元出现神经元排列无序、松散,细胞核固缩深染,并有部分形成空洞,DCI(0.58±0.03)较对照组(0.21±0.02)明显升高(P<0.01),提示D-gal可导致小鼠海马区神经元发生病理改变。CH-Ⅰ组小鼠海马神经元损伤较模型组减轻,细胞排列趋于整齐,少数细胞固缩深染;与模型组相比,CH-Ⅰ低剂量组和高剂量组的DCI显著降低至0.50±0.03(P<0.05)和0.44±0.06(P<0.01),CH-Ⅰ高、低剂量组之间无显著性差异(P>0.05)。见图2。
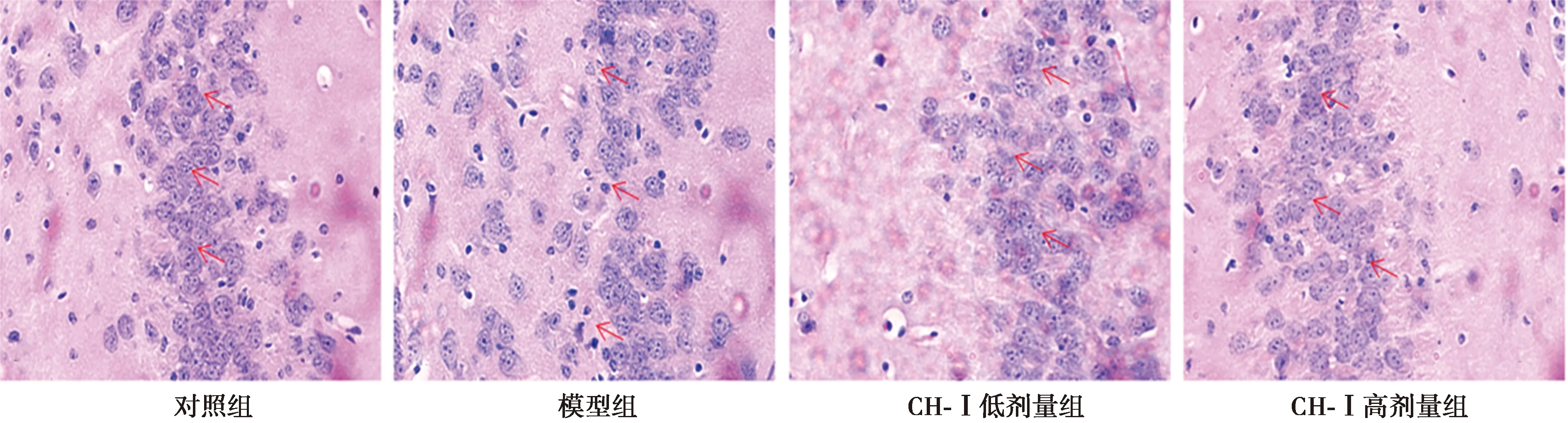
图2 CH-Ⅰ对各组小鼠海马组织神经元形态结构的影响(HE染色,×400)
2.3小鼠海马组织中TERT的表达和端粒酶活性 模型组海马组织中TERT表达水平(0.18±0.13)较模型组(0.35±0.14)明显下降(P<0.01),CH-Ⅰ低、高剂量组海马组织中TERT表达较模型组明显增加(0.25±0.13、0.29±0.15;P<0.05)。与对照组(1.11±0.17)相比,模型组端粒酶活性(0.60±0.13)显著降低(P<0.01)。而与模型组相比,CH-Ⅰ低、高剂量组端粒酶活性显著升高(0.72±0.14、0.87±0.15;P<0.05)。CH-Ⅰ高、低剂量组之间无显著性差异(P>0.05)。见图3。
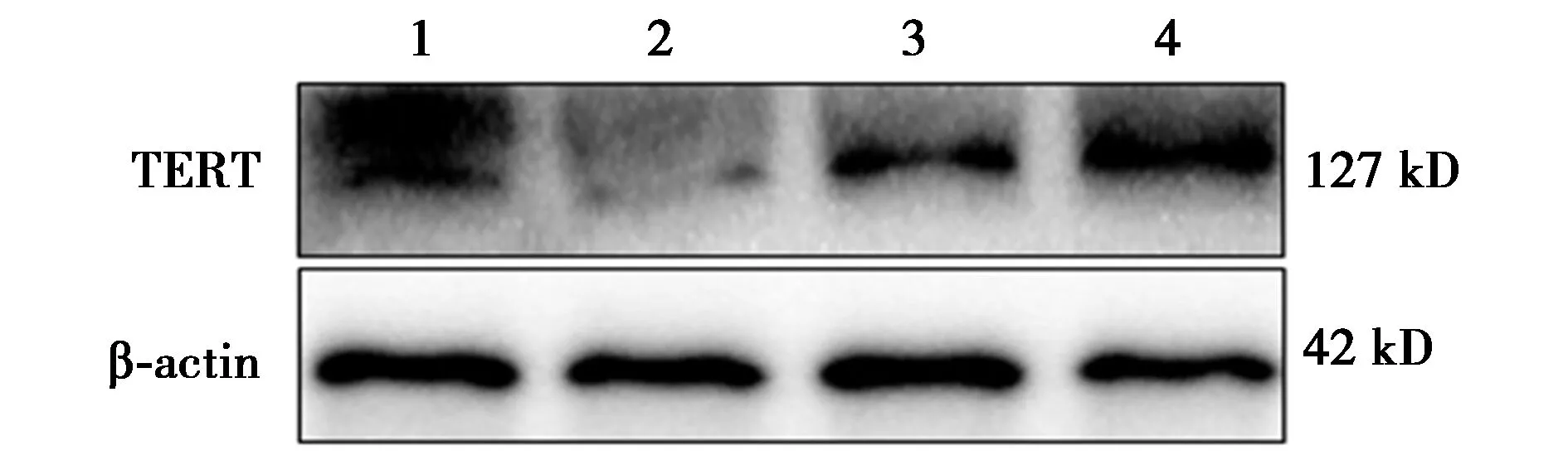
1~4:对照组、模型组、CH-Ⅰ低剂量组、CH-Ⅰ高剂量组;下图同图3 CH-Ⅰ对各组小鼠海马组织TERT蛋白表达的影响
2.4小鼠海马组织中BDNF、STAT3、p-STAT3的蛋白表达情况 与对照组(0.77±0.04)相比,模型组海马组织中BDNF表达(0.51±0.05)显著下降(P<0.01)。CH-Ⅰ低、高剂量组海马组织中BDNF水平(0.65±0.05、0.71±0.04)较模型组均显著升高(P<0.05)。与对照组(0.69±0.04)相比,模型组p-STAT3水平(0.33±0.03)明显下降(P<0.01),CH-Ⅰ低、高剂量组海马组织中p-STAT3水平(0.48±0.04、0.757±0.05)较模型组均显著升高(P<0.05),尽管总STAT3的表达水平不变。见图4。
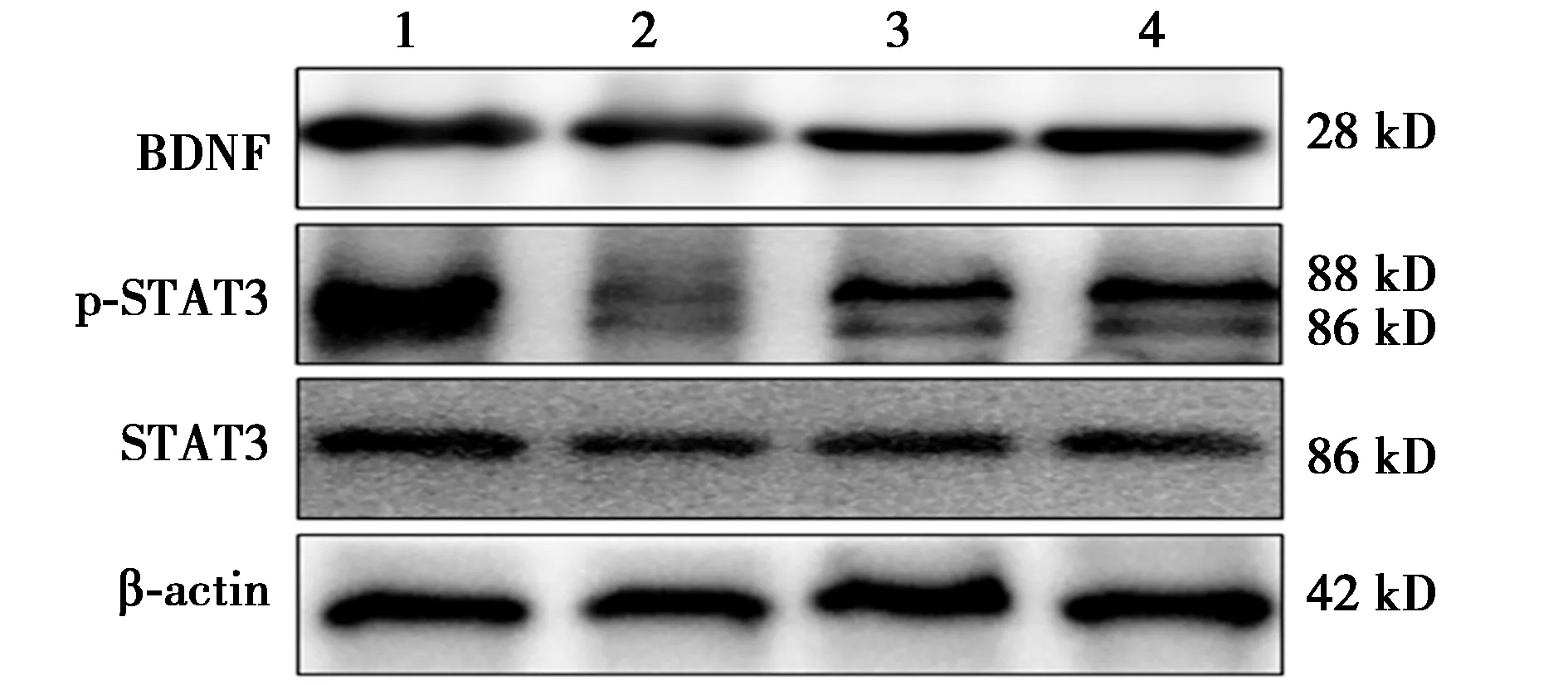
图4 CH-Ⅰ对各组小鼠海马组织BDNF蛋白表达和p-STAT3水平的影响
3 讨 论
自然衰老是一个渐进的过程,与一系列形态和行为变化有关,包括神经退行功能障碍,如运动和认知表现〔14〕。天然活性物质的发现可能是延缓大脑衰老的有效干预措施。长期接触D-gal会导致类似自然衰老的症状〔15〕,因此,D-gal诱发的衰老模型被广泛用于抗衰老研究。本研究小鼠学习记忆能力结果与Li等〔16〕的研究结果相似,表明CH-Ⅰ对D-gal引起的衰老小鼠的神经损伤具有保护作用。
端粒酶失活与多种神经退行性疾病的发生密切相关〔17~19〕,而Jaskelioff等〔20〕研究表明,端粒酶重新激活逆转了大脑的衰老过程,包括神经干细胞增殖和分化、大脑大小和嗅觉功能等〔20〕,因此激活端粒酶已被认为是延缓脑衰老的有效方法。TERT是端粒酶的关键结构和主要调节亚基,作为端粒酶的重要组成部分仅存在于端粒酶阳性细胞中,而TERT的表达依赖于多种转录因子〔21〕。STAT3是一个潜在的转录因子,在胚胎发育、免疫和炎症等生理过程中发挥作用〔22〕,可以将生长因子和细胞因子的信号从细胞膜传送到细胞核上,使其到达目标基因〔23〕。研究表明〔24,25〕,STAT3是TERT重要的激活剂,可以上调TERT的表达并提高端粒酶活性。因此STAT3在TERT的表达和端粒酶激活中发挥着重要作用。
一些药物已被证实可以通过影响端粒酶活性发挥延缓衰老的作用〔26~28〕。Benito等〔8〕研究表明,增加BDNF和STAT3的磷酸化水平,可以促进神经再生,改善神经损伤,并且通过增加BDNF的表达和磷酸化STAT3也可以改善大鼠〔29〕的记忆缺陷,本研究表明CH-Ⅰ可显著提高D-gal衰老小鼠海马组织中的BDNF表达水平。CH-Ⅰ改善D-gal诱导衰老小鼠的认知功能障碍,减轻衰老小鼠海马神经元的损伤,其作用机制可能与CH-Ⅰ提高海马组织中BDNF的表达水平,并上调TERT的表达和STAT3磷酸化水,激活端粒酶的活性有关。本研究有望对防治神经系统衰老损伤及老年相关性疾病,提供新的途径和思路。

