沉默miR-107对乳腺癌细胞侵袭及上皮-间质转化的影响
代云峰 曹春姚 李昂 任明 魏环兵 贾翠英 郎尉雅 李鹏辉 鲍红光 刘云龙 张旭东 潘洪明
(齐齐哈尔医学院 1附属第二医院 检验科,黑龙江 齐齐哈尔 161006;2附属第二医院心血管内五科;3基础医学院;4附属第二医院胸外科;5附属第二医院信息中心)
乳腺癌是女性发病率最高的恶性肿瘤,乳腺癌的晚期转移已经成为该类肿瘤预后效果差的主要因素〔1~3〕。在乳腺癌发生和发展的过程中,癌细胞受到细胞内遗传因素和细胞外肿瘤微环境的复杂调控。这些调控因素一方面通过影响细胞周期、DNA损伤修复等影响细胞的增殖活性,另一方面也通过调控细胞的迁移和侵袭能力影响肿瘤细胞的转移〔4〕。研究表明,肿瘤细胞的上皮-间质转化(EMT)是肿瘤转移的重要步骤〔5,6〕。在EMT的过程中,细胞表面E-钙黏蛋白(Cadherin)、N-Cadherin、波形蛋白(Vimentin)等表达上调,细胞连接和细胞极性丧失,细胞失去上皮细胞形态,转而呈现间质细胞形态,并获得迁移和侵袭能力〔7〕。
部分微小RNA(miRNA)对乳腺癌细胞的EMT发挥了重要的调控作用〔8〕,如miR-200可以通过靶向E盒结合锌指蛋白(ZEB)调控多种恶性肿瘤细胞的EMT〔9,10〕。miR-107是一类非保守miRNA,被发现参与调控结胰腺癌EMT的过程〔11〕,然而其在乳腺癌中的作用还了解不多。为此,本文探究了miR-107对乳腺癌细胞系T47D、MDA-MB-231迁移和EMT的影响。
1 材料与方法
1.1试剂 对照miRNA和miR-107抑制物在广州锐博公司合成。培养细胞所需的DMEM培养基、RPMI1640培养基、Opti-MEM培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)LipofectmineRNAi Max购自美国ThermoFisher公司;细胞总RNA提取试剂盒、莫洛尼鼠白血病病毒反转录酶(M-MLV)逆转录酶和qPCR SuperMix购自全式金生物科技有限公司;Transwell培养小室购自Millipore公司;抗磷酸酯酶与张力蛋白同源物(PTEN)、蛋白激酶B(AKT)、磷酸化(p)-AKT抗体购自美国CST公司,辣根过氧化物酶耦联的二抗购自美国SantaCruz公司。
1.2细胞培养和转染 正常乳腺组织细胞系Hs578Bst和乳腺癌细胞系MCF7、HS578T、T47D和BT-549购自中国医学科学院细胞库。其中Hs578Bst、HS578T和MCF7细胞系培养在90% DMEM+10%FBS培养基中,T47D和BT-549细胞使用90% RPMI1640+10%FBS进行培养。细胞分为3组:空白转染组、对照miRNA组和miR-107抑制剂组。对照miRNA和miR-107的转染:取2个1.5 ml离心管中加入100 μl Opti-MEM培养基,随后分别加入5 μl miRNA和5 μl转染试剂,室温静置5 min后,混合并轻轻混匀,继续静置5 min后加入细胞培养基中。转染6 h后更换新培养基。
1.3实时荧光定量PCR 离心收集细胞,并用PBS清洗一遍,按照RNA提取试剂盒操作说明进行总RNA提取。提取得到的总RNA用焦碳酸二乙酯(DEPC)H2O溶解,并调整浓度为0.5 μg/μl。随后使用M-MLV逆转录酶进行cDNA合成。首先将总RNA与18寡聚胸腺嘧啶脱氧核糖核酸〔Oligo(dT)18〕引物混合,65℃变性5 min,后立刻冰浴退火2 min。随后在反应体系中加入脱氧核糖核苷酸(dNTPs)、M-MLV、核酸酶抑制剂,放置在PCR仪中42℃反应30 min,得到的产物即为cDNA模板。随后使用实时荧光定量PCR混合物进行目的基因mRNA表达水平的检测。反应体系首先经过95℃预变性30 s,随后利用95℃变性5 s,60℃退火延伸30 s的反应扩增40个循环,最后加入解离程序检测溶解曲线。通过ΔΔCt计算得到目的基因与内参基因GAPDH相对表达水平,所用引物:E-cadherin正义链:5′-ACAGCACGTACACAGCCCTA-3′,反义链:5′-GCAGAAGTGTCCCTGTTCCAG-3′;Vimentin正义链:5′-AGCCGAAAACACCCTGCAAT-3′,反义链:5′-CGTTCAAGGTCAAGACGTGC-3′;Twist1正义链:5′-GGCACCATCCTCACACCTCT-3′,反义链:5′-GCTGA-TTGGCACGACCTCT-3′;N-cadherin正义链:5′-ATTGGACCATCACTCGGCTTA-3′,反义链:5′-CACACTGGCAAACCTTCACG-3′;GAPDH正义链:5′-GCACCGTCAAGGCTGAGAAC-3′,反义链:5′-TGGTGA-AGACGCCAGTGGA-3′;miR-107正义链:5′-CATACTAGTGTCTTCTGGACAGGCTCTG-3′,反义链:5′-CTTAAGCTTA-GAATCTCTCACATACACAC-3′。
1.4细胞划痕试验 将细胞接种于6孔培养板中,待细胞贴壁后分别转染对照miRNA和miR-107模拟物,转染6 h后换液,使得细胞继续呈单层贴壁生长状态直至细胞汇合度达到80%~90%。用1 ml移液器枪头在孔板底部划一条直线,随后在于第一条直线垂直的方向划一条相交的直线。划线完成后,用PBS清洗2次,去除脱落的细胞,随后加入新鲜培养基。在划线后0 h和24 h用倒置相差显微镜对同一划线位置进行拍照,并用Image J软件测量划痕面积(S),则24 h时细胞迁移率=(S0 h-S24 h)/S0 h×100%。
1.5细胞侵袭实验 将正常传代培养的细胞接种于6 cm细胞培养皿中,待细胞贴壁后分别转染对照miRNA和miR-107抑制物,转染6 h后更换无血清培养基,饥饿处理24 h。随后用胰蛋白酶消化细胞,并离心用PBS清洗1次,用无血清培养基重悬并调整细胞密度为5×105个/ml。取200 μl细胞接种于预先包被基质胶的Transwell培养小室中,并将小室放置在含有10% FBS完全培养基的24孔细胞培养板中,与37℃ CO2培养箱中培养24 h。随后取出Transwell小室,用棉签拭去小室内的基质胶和细胞,并用4%甲醛溶液固定10 min。随后用0.1% 结晶紫溶液对迁移至小室底部的细胞进行染色10 min,在体视显微镜下对染色后的小室底部细胞进行拍照,并用Image J软件统计单位面积上的细胞数目。
1.6蛋白质免疫印迹实验 转染对照miRNA或miR-107模拟物的细胞经过消化、离心收集后,用PBS重悬细胞,并用冰浴超声的方式对细胞进行裂解。细胞裂解液经过4℃,12 000 r/min离心去除细胞碎片,收集上清加入5×十二烷基硫酸钠(SDS)上样缓冲液,100℃水浴加热10 min,得到变性的全细胞蛋白样品。利用SDS-聚丙烯酰胺凝胶电泳的方法对蛋白样品进行分离,随后将蛋白样品转印到聚偏氟乙烯(PVDF)膜上。使用5%的脱脂牛奶在室温封闭带有蛋白样品的PVDF膜,随后加入一抗稀释液,室温孵育1 h,再加入二抗稀释液,室温孵育45 min。最后PVDF膜经过漂洗后,加入化学反光底物对膜上蛋白进行显色,并使用凝胶成像仪获取蛋白条带信息。
1.7统计学方法 采用SPSS17.0软件进行t检验。
2 结 果
2.1miR-107在乳腺癌细胞系中表达 与正常乳腺组织细胞Hs578Bst(1.00±0.00)相比,miR-107在乳腺癌细胞系HS578T(2.79±0.34)、MCF7(1.49±0.22)、T47D(1.86±0.41)和BT549(1.22±0.12)中表达水平均显著上升(t=9.002、9.002、3.762、3.606,P<0.001,P<0.05)。
2.2沉默miR-107对乳腺癌细胞系HS578T迁移的影响 空白转染组细胞迁移率为(71.46±6.89)%。与对照miRNA组相比,miR-107抑制剂组细胞迁移率明显降低〔(69.13±5.77)% vs (54.84±6.25)%,t=3.315,P<0.05〕,表明沉默miR-107可以抑制乳腺癌细胞的迁移。
2.3沉默miR-107对乳腺癌细胞系HS578T侵袭能力的影响 空白转染组细胞侵袭数为(32.3±4.9)个。与对照miRNA组相比,miR-107抑制剂组侵袭细胞数明显减少〔(30.8±4.7)个 vs (23.5±5.4)个,t=2.884,P<0.05〕。见图1。
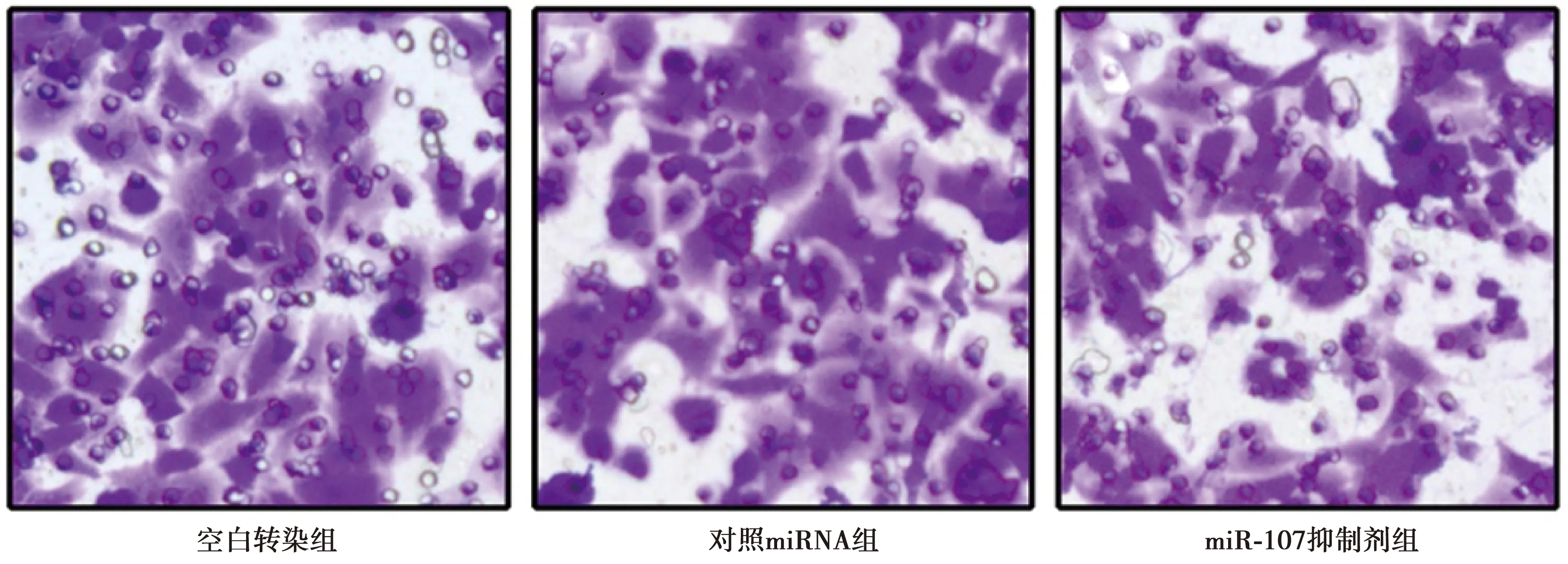
图1 结晶紫染色显示各组侵袭到下室的HS578T细胞(×100)
2.4沉默miR-107对乳腺癌细胞系EMT的影响 与对照miRNA组相比,miR-107抑制剂组HS578T细胞中E-cadherin mRNA表达水平显著下降,而N-cadherin、Vinmentin和Twist的mRNA表达水平上调(P<0.05,P<0.01)。见表1。

2.5沉默miR-107对乳腺癌细胞系HS578T PTEN/AKT信号通路的影响 与对照miRNA组相比,miR-107抑制剂组24 hHS578T细胞中PTEN蛋白的表达水平明显下调(0.98±0.16 vs 0.45±0.11;t=4.728,P<0.05),而磷酸化(p)-AKT的水平则明显上升(0.34±0.07 vs 0.68±0.09;t=5.165,P<0.05),见图2。表明miR-107通过PTEN调控了AKT信号通路。
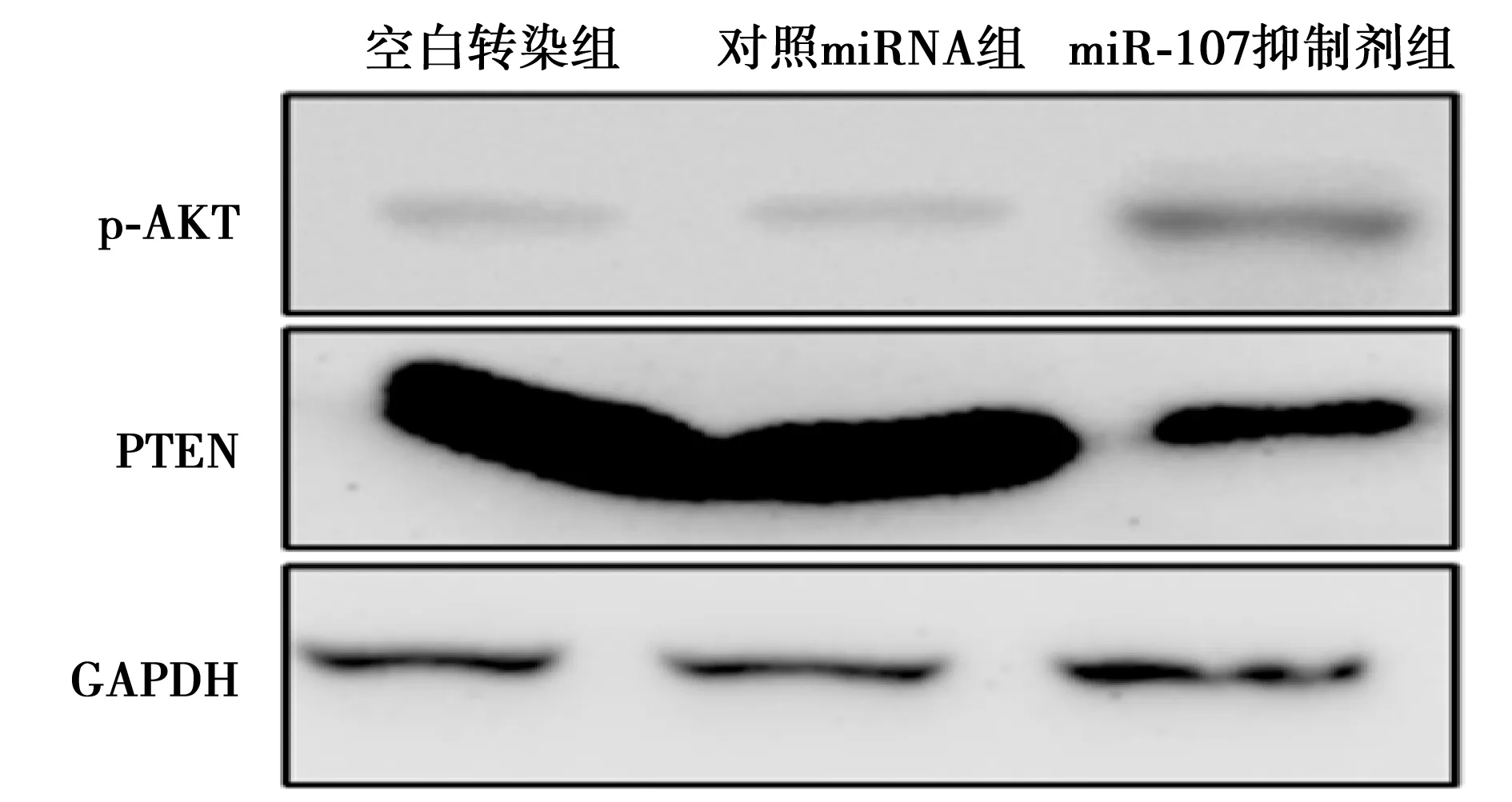
图2 蛋白质免疫印迹实验检测各组细胞PTEN、p-AKT表达水平
3 讨 论
miRNAs在调控肿瘤细胞的增殖、迁移、浸润等方面发挥了重要的作用,部分miRNAs中肿瘤组织中的表达水平与疾病的恶性程度和预后有明显的相关性〔12,13〕。miR-107已经被发现在胃癌〔14〕、肝癌〔15〕、胰腺癌〔16〕等多种恶性肿瘤组织中表达水平呈现异常,而这种异常的表达很可能跟肿瘤的发生和转移密切相关。下调miR-107的表达也会影响多种肿瘤细胞的增殖、迁移等过程〔17〕。在乳腺癌组织中也发现了miR-107表达水平的上调,其表达水平与乳腺癌的淋巴转移有明显相关性〔18〕,但miR-107对乳腺癌疾病发展的调控作用还不是特别清楚。
本研究发现,沉默miR-107的表达显著抑制乳腺癌细胞系的迁移和侵袭能力。肿瘤细胞的EMT是指肿瘤细胞失去上皮细胞形态,而转变为间质细胞类型,伴随这一过程往往会让肿瘤细胞获得侵袭和转移的能力。EMT一个重要特点是细胞间的连接减少,细胞膜蛋白E-cadherin表达水平下调,而N-cadherin的表达水平上升,此外,发生EMT的细胞中也会出现Vinmentin及相关转录因子Twist表达水平的上升〔6〕。本研究说明沉默miR-107促进了乳腺癌细胞EMT的过程。因此miR-107对乳腺癌细胞侵袭能力的影响很可能是通过对其EMT过程的调控实现的。
miR-107在多种肿瘤中通过调控不同的靶蛋白发挥不同的作用。在宫颈癌细胞中,miR-107通过靶向髓样细胞白血病(MCL)1调控共济失调-毛细血管扩张和Rad3相关蛋白(ATR)/细胞周期检验点激酶(Chk)1信号通路,并影响细胞侵袭〔19〕;在胃癌细胞中,miR-107则靶向神经纤维瘤蛋白(NF)1和DICER1调控胃癌细胞的侵袭和转移〔20,21〕,影响疾病进展;在肝癌细胞中,miR-107被发现可以靶向Axin2蛋白〔22〕。miRNA对底物蛋白的调控作用通常是通过与其mRNA结合,影响mRNA的稳定性及其转录活性,进而影响下游蛋白的表达。此外,有研究表明,miR-107可以直接靶向EMT关键调节蛋白PTEN〔11〕。本研究也发现,在乳腺癌细胞HS578T中,沉默miR-107同样可以抑制PTEN蛋白的表达,进而促进细胞AKT的磷酸化修饰。综上所述,在乳腺癌细胞系中表达水平显著上升,而沉默miR-107的表达则可以通过靶向PTEN/AKT信号通路,促进细胞EMT,影响乳腺癌细胞的迁移和侵袭。提示miR-107不仅可以作为肿瘤标志物,也可能作为新的药物作用靶点用于乳腺癌的临床治疗中。

