宫颈癌细胞分泌外泌体对宫颈癌细胞增殖、凋亡功能及MAPK/ERK信号通路的影响
刘晶 王景 葛静 王旭 冯艳萍 房桂英 李林
(河北医科大学第一医院妇产科,河北 石家庄 050031)
外泌体富含DNA、RNA、蛋白质等多种成分,在免疫反应、细胞通讯、血管生成、肿瘤发生等过程中发挥重要作用;血液、唾液、腹腔积液、胸水、尿液等体液中均可分离出外泌体,故外泌体在人体内分布比较广泛〔1〕。外泌体在恶性肿瘤发生发展中的作用越来越受到重视,各种来源的外泌体可产生特异性恶性肿瘤相关的mRNA、蛋白质等活性物质,并可将这些活性物质传递给免疫细胞、内皮细胞、间质细胞、炎症细胞等,通过改变受体细胞蛋白功能达到促进恶性肿瘤增殖、凋亡、侵袭迁移等目的〔2,3〕。外泌体在宫颈癌中的作用也受到大家关注,易红艳等〔4〕采用差速超离心法分离宫颈癌细胞Siha细胞外泌体,并发现其可介导宫颈癌前细胞Ect1发生上皮间质转化,从而提高Ect1细胞的体外侵袭能力。但宫颈癌细胞来源的外泌体在宫颈癌增殖凋亡中的作用及其可能作用机制尚不十分清楚。丝裂原活化蛋白激酶/胞外信号调节激酶(MAPK/ERK)信号通路为细胞内重要的促进细胞增殖、抑制细胞凋亡信号通路之一〔5〕,可通过影响其下游的细胞增殖及凋亡相关蛋白的活性,在宫颈癌细胞增殖、凋亡中发挥重要作用〔6〕。本研究旨在探讨宫颈癌C33A细胞外泌体对其自身增殖凋亡影响的可能作用机制。
1 材料与方法
1.1细胞系、主要试剂及仪器 人宫颈癌C33A细胞系(ATCC细胞库),FKH-67染剂、四甲基偶氮唑蓝(MTT)试剂盒、DAPI、Alex Fluro 594 Phalloidin(美国Sigma公司);RPMI1640培养基、KGM培养基、胎牛血清、胰蛋白酶(美国Hyclone公司);兔抗人CD81抗体、兔抗人CD63抗体、兔抗人ERK1/2多克隆抗体、兔抗人磷酸化(p)ERK1/2多克隆抗体(美国Abcam公司);JEM-1400透射电子显微镜(日本电子公司);共聚焦显微镜(德国Leica公司)。
1.2方法
1.2.1人宫颈癌C33A细胞培养 C33A细胞复苏后,用RPMI1640(含青霉素和链霉素)的培养基常规培养,C33A细胞生长稳定后用磷酸盐缓冲液(PBS)洗涤,更换无血清KGM培养基培养,每3 d换液1次,收集上清液用于提取外泌体。
1.2.2C33A细胞外泌体的提取和鉴定 将上述收集的C33A细胞上清液离心(300 r/min)5 min,去掉死亡细胞,再离心(2 000 r/min)20 min,再离心(10 000 r/min)30 min,将离心得到的上清液进行浓缩,在浓缩上清液中加入总外泌体分离试剂过夜孵育,离心(10 000 r/min)60 min,用PBS重悬沉淀,用磷钨酸负染。透射电镜下拍照并观察分泌的外泌体形态;并用Western印迹测定分泌外泌体CD63和CD81蛋白表达情况。
1.2.3C33A细胞对外泌体的摄取实验 将C33A细胞接种到共聚焦培养皿中(接种密度为1×104个/ml)常规培养,待细胞贴壁生长后加入PKH67(2 μg)标记外泌体,培养48 h后用PBS液清洗,多聚甲醛(4%)固定10 min,Triton透化10 min增加通透性,加入牛血清白蛋白(BSA)孵育30 min降低染色背景,加入Alex Fluro 594 Phalloidin染色细胞骨架中的F-actin,加入DAPI染色细胞核,共聚焦显微镜下拍照并观察C33A细胞对外泌体的摄取情况。
1.2.4C33A细胞分组 将C33A细胞分为外泌体(Exo)组和对照(C)组,Exo组C33A细胞中加入含10 μl外泌体的RPMI1640培养基,C组C33A细胞中加入含等量PBS的培养基〔7〕,收集培养24 h细胞用于后续研究。
1.2.5MTT测定C33A细胞增殖能力 将Exo组和C组C33A细胞接种到96孔板中培养,每组设7个复孔,分别于培养1 d、3 d、5 d加入5 g/L MTT染色,继续培养4 h,吸出上清液,加入DMSO 150 μl震荡均匀,酶标仪测定波长570 nm处吸光度(A)值。
1.2.6克隆形成实验测定C33A细胞集落形成能力 将Exo组和C组C33A细胞平铺于6孔板中,每孔300个细胞,每组设7个复孔,培养2 w,弃去培养基,甲醇固定30 min,结晶紫(0.4%)染色15 min,拍照并统计每孔集落形成数量。
1.2.7流式细胞术测定C33A细胞凋亡能力 将Exo组和C组C33A细胞接种到6孔板中,每孔2×105个细胞,每组设7个复孔,分别加入Annexin-V 5 μl和PI 5 μl混匀,反应15 min,加入缓冲液400 μl,流式细胞仪检测C33A细胞凋亡情况。其中左下象限为活细胞;右上象限为坏死细胞;右下象限为凋亡细胞。
1.2.8Western印迹测定C33A细胞中ERK1/2、p-ERK1/2蛋白水平 将Exo组和C组C33A细胞中加入RIPA裂解液,提取总蛋白,用二喹啉甲酸(BCA)法进行定量测定,每组取40 μg总蛋白进行电泳,并转膜,脱脂奶粉封闭1 h,加入兔抗人ERK1/2多克隆抗体(1∶1 000)和兔抗人p-ERK1/2多克隆抗体(1∶1 000)过夜孵育,以β-actin为内参,加入二抗(1∶15 000)孵育1 h,电化学发光(ECL)显色,暗室曝光显影,Image J软件分析蛋白水平,ERK1/2、p-ERK1/2蛋白水平=ERK1/2、p-ERK1/2条带灰度值/β-actin条带灰度值。
1.3统计学分析 采用SPSS20.0软件进行t检验。
2 结 果
2.1C33A细胞来源外泌体鉴定 超速离心法富集C33A细胞外泌体,透射电镜下见外泌体直径40~140 nm,呈类圆形囊泡结构;Western印迹检测见C33A细胞来源囊泡状小体中富含CD63和CD81蛋白,表明C33A细胞中分离的囊泡状小体为外泌体,见图1和图2。
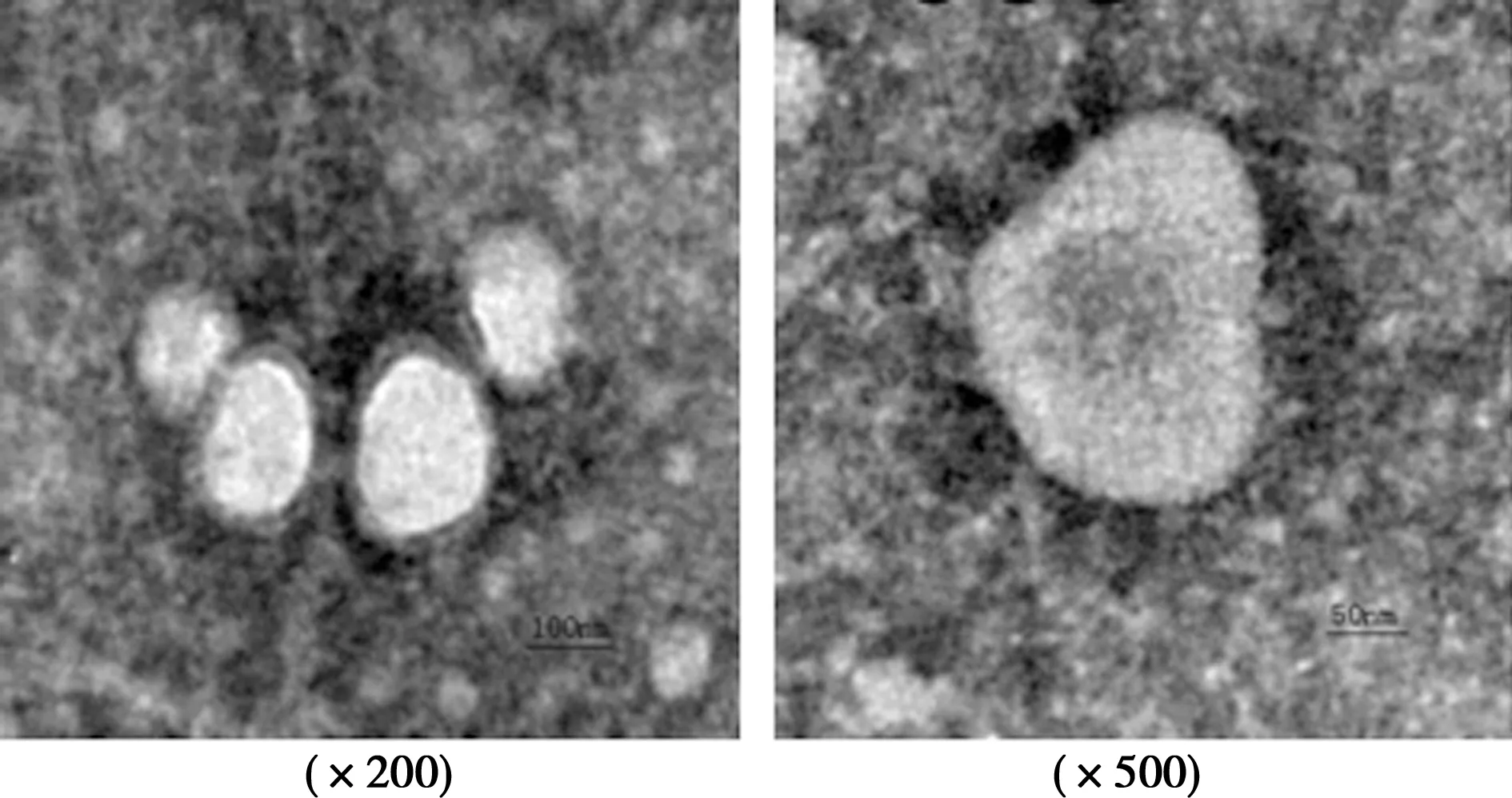
图1 电镜下观察C33A细胞来源囊泡状小体形态
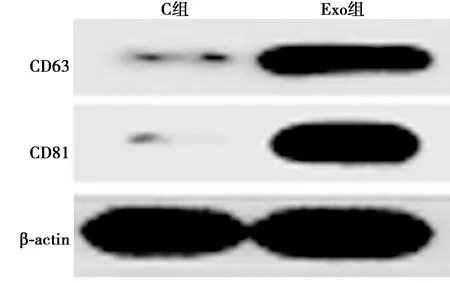
图2 Western印迹测定外泌体中CD63、CD81蛋白水平
2.2C33A细胞摄取外泌体情况 激光扫描共聚焦显微镜下发现:外泌体作用C33A细胞72 h后,细胞骨架中的F-actin被Alex Fluro 594 Phalloidin染色为红色;细胞核被DAPI染色为蓝色;被PKH67标记的外泌体呈绿色荧光,主要位于细胞质中,主要在细胞核周围分布,且几乎所有C33A细胞均可见绿色荧光,表明C33A细胞来源的外泌体可被C33A细胞摄取。见图3。
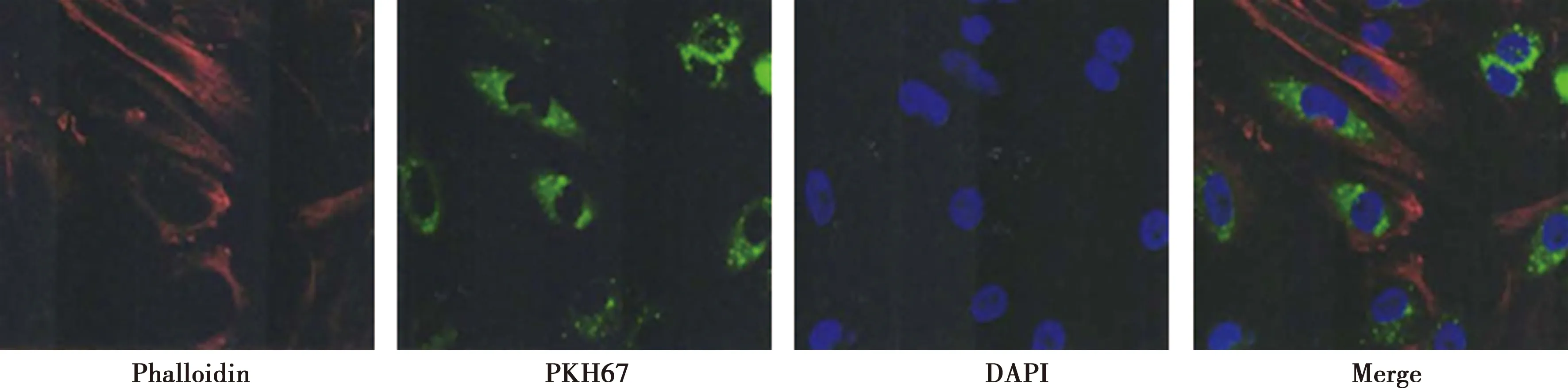
图3 免疫荧光测定C33A细胞摄取外泌体情况(×400)
2.3外泌体对C33A细胞增殖能力的影响 1 d、3 d、5 d,Exo组C33A细胞A值明显高于C组(P<0.05),见表1。
表1 各组C33A细胞A值比较
2.4外泌体对C33A细胞集落形成数的影响 Exo组C33A细胞集落形成数明显高于C组(P<0.001),见图4、表2。
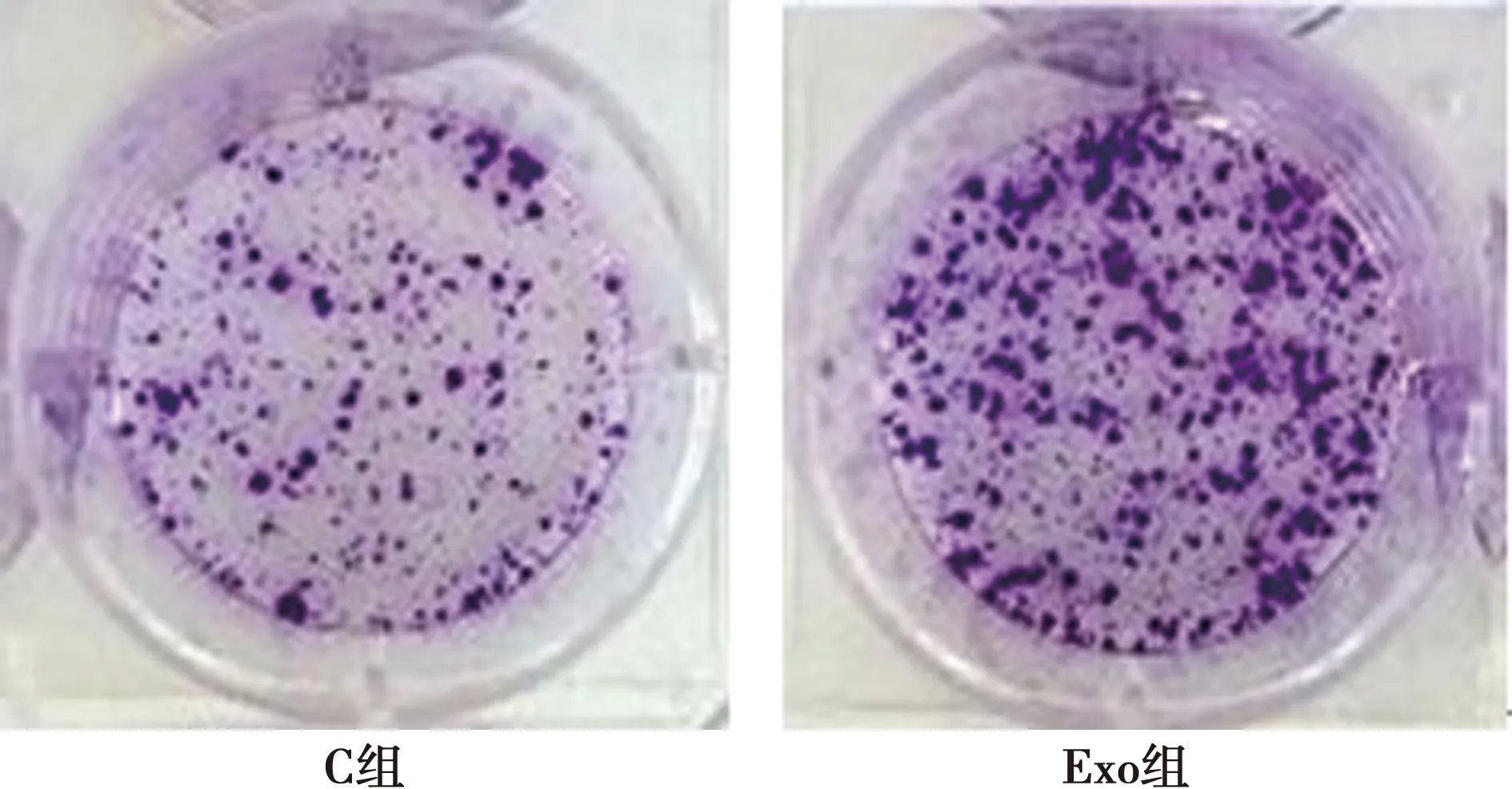
图4 克隆形成实验测定C33A细胞集落形成能力
表2 各组C33A细胞集落形成数和细胞凋亡率比较
2.5外泌体对C33A细胞凋亡能力的影响 Exo组C33A细胞凋亡率明显低于C组(P<0.001),见表2、图5。
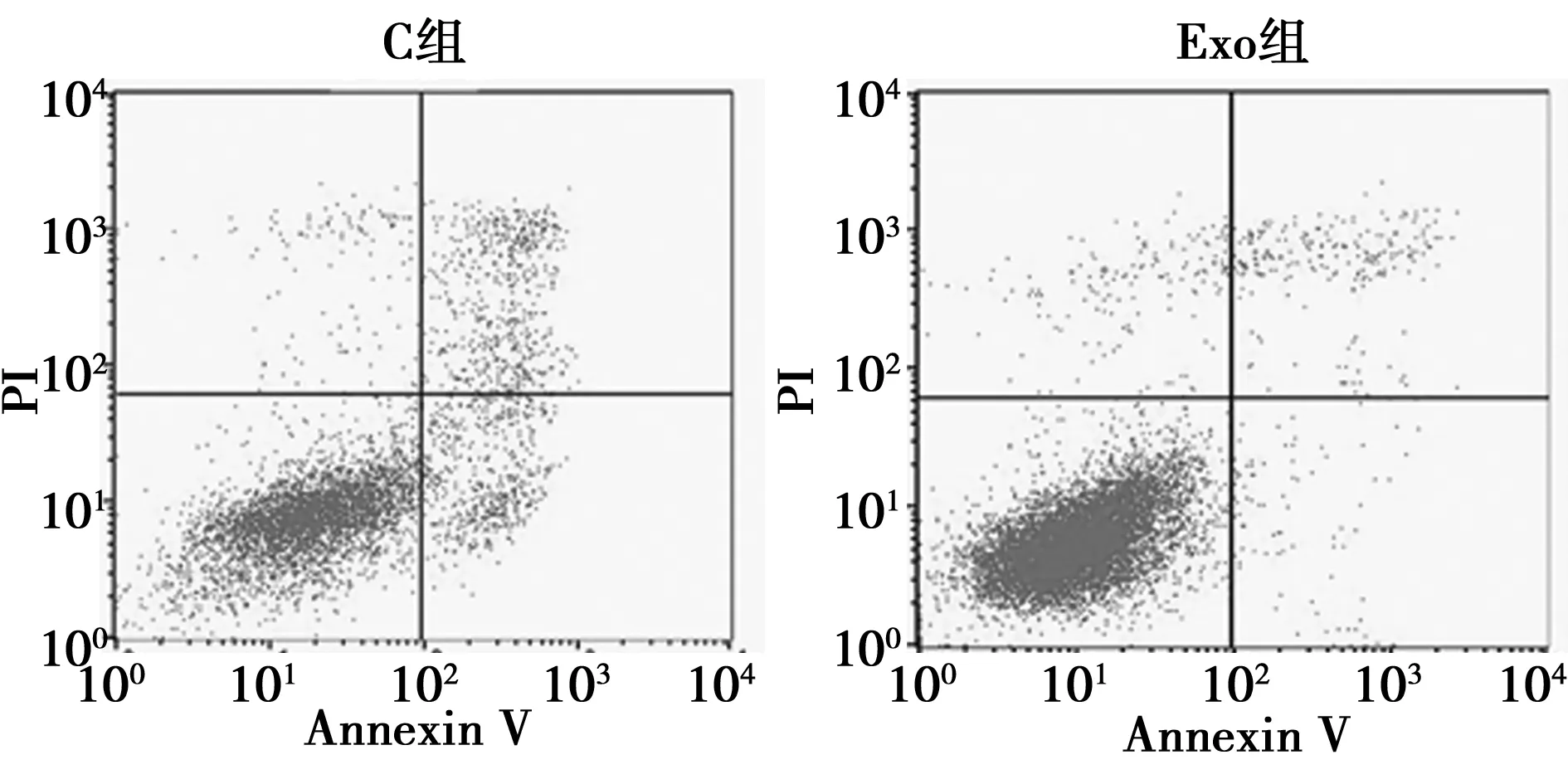
图5 流式细胞术测定C33A细胞凋亡能力
2.6外泌体对C33A细胞MAPK/ERK信号通路的影响 两组C33A细胞ERK1/2蛋白水平差异无统计学意义(P>0.05);Exo组C33A细胞p-ERK1/2蛋白水平明显高于C组(P<0.001),见表3、图6。
表3 各组C33A细胞ERK1/2、p-ERK1/2蛋白水平比较
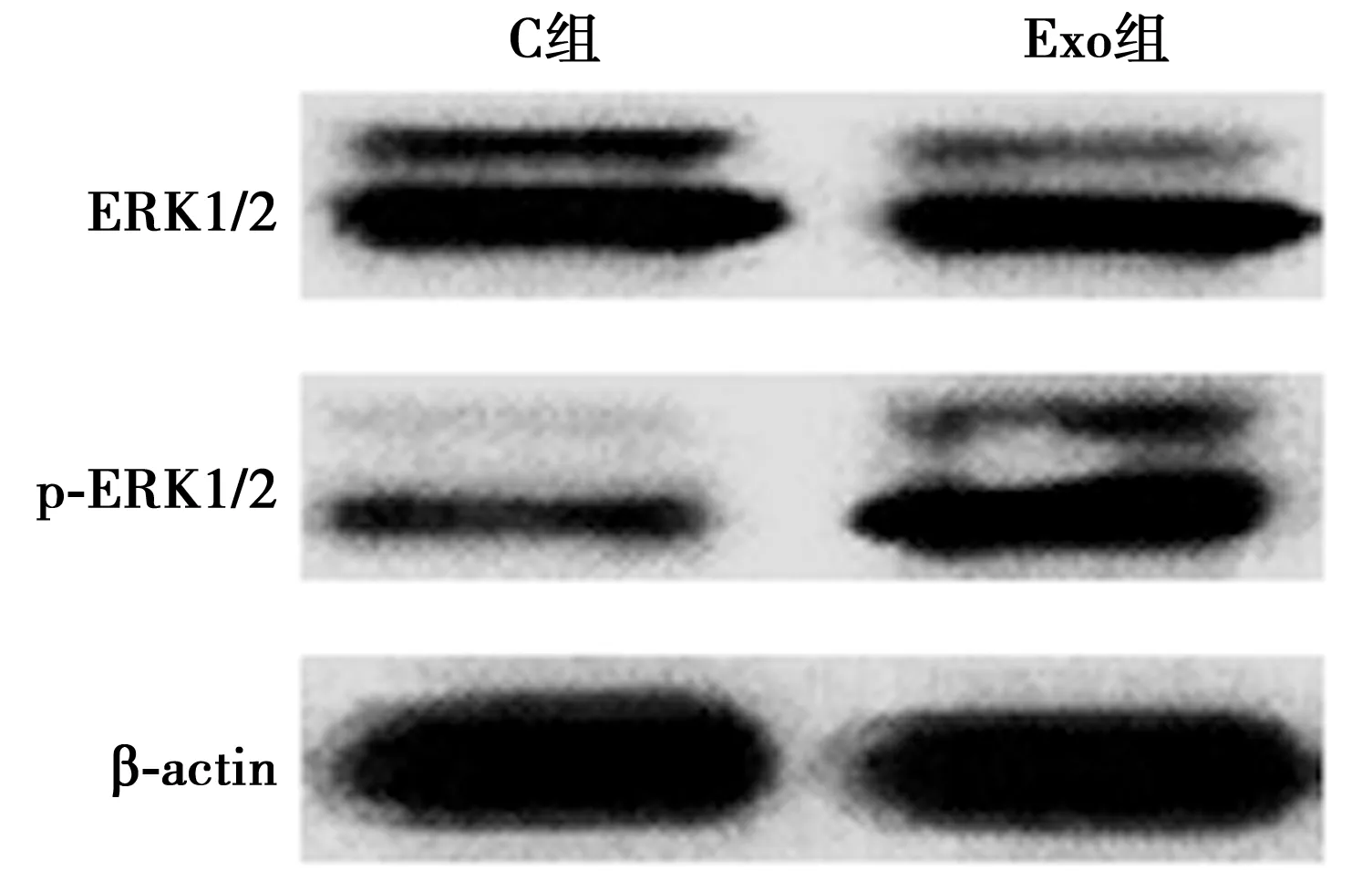
图6 Western印迹测定各组C33A细胞ERK1/2、p-ERK1/2蛋白水平
3 讨 论
外泌体合成的第一步为细胞质膜向内凹陷形成内体,内体的膜结构向内凹陷,胞质RNA和蛋白被选择性装进内部囊泡,形成多泡体,多泡体和细胞膜相融合,释放外泌体〔8〕。外泌体可能通过内吞、直接融合、通过外泌体表明蛋白结合三种方式作用于靶细胞〔9〕。外泌体虽可被多数细胞分泌,但在癌症等病理条件下外泌体的释放增加,其在恶性肿瘤微环境中的含量尤其丰富,外泌体可介导细胞之间交流,肿瘤细胞来源的外泌体常携带有恶性肿瘤抗原,并且外泌体内的RNA和蛋白质等具有生物学功能,这些RNA和蛋白质传递到效应细胞中,在恶性肿瘤的增殖、凋亡及侵袭迁移中发挥重要作用〔10,11〕。研究发现外泌体在恶性肿瘤细胞增殖和凋亡中发挥重要作用,如乳腺癌细胞的外泌体在可促进CD133+癌细胞增殖并抑制细胞凋亡〔12〕;癌细胞来源外泌体可促进非小细胞肺癌细胞增殖并抑制细胞凋亡〔13〕;巨噬细胞来源的外泌体抑制乳腺癌细胞凋亡,促进乳腺癌细胞增殖〔14〕。本研究结果表明宫颈癌细胞来源外泌体在其自身增殖和凋亡中发挥重要作用。
MAPK/ERK信号通路为促进细胞增殖和抑制细胞凋亡的主要通路之一〔15〕,磷酸化激活的ERK(p-ERK)可通过促进细胞周期蛋白D1表达,使细胞周期蛋白D1水平升高,是细胞周期从G1期向S期转换,促进细胞分裂增殖,从而增加宫颈癌细胞的增殖能力〔16,17〕。p-ERK对细胞凋亡终末效应器半胱氨酸蛋白酶(caspase)-3的活性具有直接抑制作用,对各种刺激诱导的细胞凋亡具有阻断作用〔18〕;p-ERK还可通过活化细胞凋亡蛋白抑制剂IAPs等抑制凋亡分子间接抑制caspase-3活性,进而抑制宫颈癌细胞凋亡,从而促进宫颈癌的发展〔19〕。外泌体可通过多种信号通路参与恶性肿瘤的增殖凋亡过程〔20〕,如Chen等〔21〕研究发现肝细胞癌细胞来源的外泌体可通过MAPK/ERK信号传导途径促进肝细胞癌细胞上皮-间质转化,引发肝细胞癌的进展和复发。Qu等〔22〕研究发现肝细胞癌细胞来源的外泌体在体外和体内可通过MAPK/ERK通路促进肝细胞癌细胞增殖。上述研究提示MAPK/ERK在宫颈癌的增殖凋亡中发挥重要作用,外泌体可通过MAPK/ERK信号通路参与恶性肿瘤的增殖凋亡过程,由此推测MAPK/ERK信号通路可能参与外泌体影响宫颈癌增殖凋亡的过程。本研究结果表明宫颈癌C33A细胞来源外泌体可激活宫颈癌C33A细胞中MAPK/ERK信号通路,宫颈癌C33A细胞来源外泌体可能通过MAPK/ERK信号通路促进其自身增殖、抑制其凋亡。
——外泌体与老年慢性疾病相关性的研究进展

