miR-132在慢性心力衰竭大鼠下丘脑室旁核表达
李晶 张驰 王鑫 刘羽承 郭锦华, 王东 贾琳琳
(佳木斯大学基础医学院 1生理教研室,黑龙江 佳木斯 154000;2微生态-免疫调节网络与相关疾病重点实验室;3佳木斯市妇幼保健院;4佳木斯市肿瘤医院)
中枢机制在慢性心力衰竭(CHF)发病进程中具有重要效应,广大科研工作者主要把调控心血管活动的重要中枢并具调节体液平衡的核团即下丘脑室旁核(PVN)作为研究靶点。有研究发现,存在于PVN中的促肾上腺皮质激素释放激素神经元(CRH能神经元)若过度激活可增加交感神经系统的兴奋性〔1,2〕,可能是通过增加活性氧簇生成及肾素-血管紧张素(Ang)-醛固酮系统(RAAS)和炎性因子之间的表达丧失平衡而造成的。通常临床上判定患者预后及治疗的靶点之一是交感神经过度激活,这也是CHF的重要病理特征。生物内源性的非编码小RNA(microRNA)中发现较早的就是首次在神经系统中发现的miR-132,其与多种中枢神经系统(CNS)疾病的发生和发展关系尤为密切〔3,4〕,并且调节CNS的功能和发育。有研究发现,miR-132 可借助多种信号途径上调谷氨酸受体(兴奋性神经递质)的表达〔4,5〕。还可由AngⅡ诱导miR-132表达上调来促进心肌纤维化和心肌肥厚的发生。本研究观察miR-132在CHF下丘脑PVN的表达并探讨其可能影响下丘脑PVN交感输出的机制。
1 材料与方法
1.1实验动物及分组 健康、雄性、清洁级SD大鼠36只以随机数字原则分为CHF组、假手术(Sham)组、正常对照(Ctrl)组各12只。体重225~255 g,实验动物购自哈尔滨医科大学实验动物中心,动物许可证号为SCXK(黑)2019-001。
1.2模型制造 给予大鼠水合氯醛(浓度10%,剂量40 mg/kg)腹腔部位注射,CHF组左冠状动脉前降支结扎的具体术式操作如下:当大鼠处于深麻醉状态时,进行仰卧位固定在自制的手术台上(厚泡沫盒盖子),借助小儿喉镜行经口的气管插管术,并连接小动物呼吸机。待呼吸平稳后(呼吸机参数设置成和大鼠呼吸频率一样)于左侧第4、5肋间隙持手术剪进入胸腔(预先碘伏消毒、婴儿理发器剃掉胸部鼠毛),钝性分离后充分暴露心脏(借助眼科开睑器向两侧推拉肋骨),切勿触碰心脏,确定好左冠状动脉所在位置后,用5-0眼科手术线穿过左冠状动脉前降支偏上的位置,并打结2次;打完结后肉眼可见心尖颜色马上变浅。Ctrl组不给予任何处理;Sham组左冠状动脉前降支仅把手术线在其下方穿过,并不打结。3组均在4 w后进行心功能检测,以左室舒张末压力(LVEDP)≥15 mmHg判定CHF模型建立成功〔6〕。
1.3仪器和试剂 主要仪器:高效液相色谱(HPLC)仪(赛智科技有限公司)、BL-420生物机能信号系统(成都泰盟公司)、石蜡切片机(Leica RM2235)、东芝四维彩超(型号Aplio50)、倒置光学显微镜(Olympus)、全自动多功能酶标仪(Bio Tek)、VE-186转移电泳槽(上海天能科技有限公司)、全自动凝胶成像系统(Bio-Rad)、立体显微镜(SZ6060)等。主要试剂、试剂盒和相关抗体等购于碧云天生物技术有限公司和武汉博士德生物有限公司,引物由上海Invitrogen公司设计并提供。
1.4心功能检测 应用婴儿心脏彩超和BL-420生物信号系统检测血流动力学来反映心功能,连续测5个心动周期并记录心率(HR)、LVEDP、左室收缩压(LVSP)、射血分数(EF)的数据变化。按参考文献〔6〕步骤进行、临床专业超声医师操作。断头处死动物,开胸取心脏和肺称重后,再分离右心室及室间隔称重,分别计算肺、体质量比(L/BW)和右心室、体质量比(RVW/BW)。
1.5酶联免疫吸附试验(ELISA)检测 严格按照试剂盒说明书的步骤进行操作。从内侧静脉取静脉血(长度约2 cm、内径1.0 mm的毛细吸管,经肝素预处理后备用)。交感神经兴奋性高低用血浆中递质去甲肾上腺素(NE)水平表示,同时检测血浆中利钠肽 (BNP)浓度。
1.6逆转录聚合酶链反应(RT-PCR)检测 试验结束在麻醉状态下断头快速取下脑组织,按照大鼠脑定位图谱确定PVN区域(视交叉后缘向后1.5~2.0 mm,垂直7.1~8.1 mm)。并测定PVN中miR-132表达量。具体操作按下述步骤进行:提取组织中的总RNA,以从样本中提取1 μg作为逆转录模板来制作cDNA,后把cDNA作为模板建立RT-PCR体系。miR-132表达量及反应条件参考杨波等〔7〕方法。
1.7HPLC检测 HPLC法检测下丘脑PVN谷氨酸含量。把脑组织(下丘脑PVN组织经超声粉碎)匀浆后取上清液备用,并由佳木斯大学药学院专业技术人员完成。
1.8组织学观察 持续4 w的试验结束后,麻醉状态下断头并处死大鼠。同时,剪开胸腔并把心脏充分暴露出来,在冰盘上快速剪下心脏,然后用生理盐水冲洗干净,并用滤纸把盐水吸干净。取心尖部心肌组织固定于4%多聚甲醛溶液中。常规方法处理苏木素-伊红(HE)染色后光学显微镜下观察。
1.9统计学分析 采用SPSS19.0软件行t检验。
2 结 果
2.1心功能检测结果 Ctrl组与Sham组各项心功能指标没有显著差异(P>0.05);CHF组中除HR外,其余各项心功能指标均与Ctrl组和Sham组差异显著(P<0.05)。见表1。

2.2RT-PCR检测结果 CHF组miR-132在下丘脑PVN中表达(32.37±4.52)较另外两组明显增加(P<0.05);miR-132在Ctrl组与Sham组下丘脑PVN的表达(7.72±0.23 vs 8.59±0.31)无明显差异(P>0.05)。见图1。

图1 miR-132在3组下丘脑PVN的相对表达
2.3ELISA和HPLC检测结果 CHF组血浆NE、BNP水平及下丘脑PVN谷氨酸含量与Ctrl组与Sham组相比明显增加(P<0.05);Ctrl组与Sham组血浆NE、BNP和下丘脑PVN谷氨酸含量无明显差异(P>0.05)。见表2。
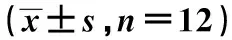
表2 3组血浆NE、BNP及下丘脑PVN谷氨酸含量
2.4组织学检测结果 光学显微镜下观察到CHF组心肌组织出现由缺血缺氧导致的肌纤维紊乱、皱缩和肌间隙增宽,部分心肌细胞出现脂肪和空泡变性;Ctrl组与Sham组心肌组织未见异常。见图2。

图2 3组心肌组织学检测结果(HE染色,×400)
3 讨 论
心血管反射调节紊乱和CNS整合机制紊乱可导致交感神经过度激活,应用受体阻断剂不能降低心衰状态下循环血液中的NE浓度,而阻断中枢内某些体液因素的作用能改善交感神经兴奋性和心功能,提示CNS整合机制可能在CHF进程中起着更重要的作用。下丘脑PVN中核团的相关神经体液调节因子的异常表达可致交感神经活动增强,是由于该核团可直接调控脊髓交感神经节前神经元的活动状态。而下丘脑PVN中最主要的兴奋性神经递质就是谷氨酸,可借助氨基酸递质调控交感输出,并参与心血管反射活动。向CHF大鼠PVN内微量注射谷氨酸受体拮抗剂,对肾交感神经的兴奋性及HR和血压都有显著的降低效应〔8,9〕。本实验结果也证实了这一点。miR-132是一类进化保守的miRNA,由于在与神经相关的组织中广泛、高度表达并与CNS功能密切相关而被称为“NeurimmiR”〔10〕。在CNS与学习和记忆相关的脑区海马等部位,脑源性神经营养因子(BDNF)可促进miR-132表达,可能是通过有丝分裂原活化蛋白激酶(MAPK)/细胞外调节蛋白激酶(ERK)1/2通路发挥效应,同时诱导突触中可塑性相关蛋白的合成量及增加兴奋性递质谷氨酸受体的表达来发挥作用〔11〕。Krol等〔12〕研究结果证实神经细胞的实时状态也可调控miRNA的表达和新陈代谢,而大多数神经细胞中miRNA的转变加速或缩减都和谷氨酸受体被兴奋或被抑制相关。由此本文推测心力衰竭时下丘脑PVN miR-132可能通过影响谷氨酸或受体的表达来影响交感输出;同时兴奋性增高的谷氨酸能神经元也可反馈调控miR-132的表达。而作用于谷氨酸的离子通道型受体门冬氨酸(NMDA)来发挥作用的主要有RAAS中的Ang转换酶1型受体(AT1R)及Ang转换酶。从而提高谷氨酸能神经元兴奋性、突触传递效能和PVN交感输出〔13〕。在外周心肌组织,AngⅡ可诱导miR-132表达上调参与心肌肥厚和纤维化进程。本研究结果说明CHF后心脏功能明显降低。本研究中尚未阐述miR-132与谷氨酸之间的相互作用机制及此两种因子对交感神经兴奋性影响的效应。此外,动物实验证实miR-132抑制剂可用于治疗CHF并具有良好的药代动力学、安全性和耐受性;临床实验证实在具有典型症状的CHF患者循环血液中,miR-132水平随心力衰竭的严重程度而升高,特别是低浓度的miR-132可作为评价患者再入院治疗的风险因素〔14,15〕。

