纳米雄黄酸飞品对人乳腺癌细胞增殖、凋亡及自噬的影响*
桂 春,明小芳,邹 雪,杨晓利,张秀桥,郑 新
(湖北中医药大学药学院 武汉 430065)
据世界卫生组织国际癌症研究机构报道,2020年全世界有1900余万新发癌症病例,其中女性新发癌症病例约占一半[1]。由于全球人口老龄化、环境污染、肥胖等原因,预计到2040年,癌症新发病例将在此基础上继续增长50%,恶性肿瘤对人类健康的危害非常大[1]。其中乳腺癌新发病例呈爆发式增长,已取代肺癌成为全球发病第一的恶性肿瘤,发病率约30%[2]。中国每年确诊恶性肿瘤患者中有近9%为乳腺癌病人,由此可见乳腺癌对人类生命健康的危害越来越大[2]。
1963年比利时克里斯蒂安提出“自噬”概念,到2016年日本学者大禹良点因发现了细胞自噬的生物学机制而获得诺贝尔生理奖[3],自此开启了细胞自噬在生命学科热门研究的高峰时期[4]。近年来,中草药提取物或其有效成分在调节肿瘤细胞自噬及信号通路等相关方面的研究持续增加,且在乳腺癌方面的报道也越来越多。如泽泻醇A、粉防己碱、常山酮、麦冬皂苷等均可通过自噬途径诱导乳腺癌细胞死亡[5]。
现代研究表明中药能通过多靶点、多途径治疗乳腺癌,弥补现代医学方式治疗所产生的耐药性、毒副作用大等问题,发挥其独特的优势[6]。雄黄为矿物药硫化物类雄黄族雄黄,具有解毒杀虫、燥湿祛痰、截疟等功效,主要成分为二硫化二砷(As2S2)。因其具有较大的毒性、较低的溶解度和生物利用度等缺点,在临床上的使用受到较大限制[7]。将雄黄纳米化后,不仅可以减少用药量,而且可以提高其溶解度及生物利用度[8]。研究表明纳米雄黄具有治疗白血病、抗肺癌和抗肝癌作用[9-10];纳米雄黄颗粒可通过抑制基质金属蛋白酶(MMPs)和血管生成来抑制乳腺癌小鼠肿瘤的迁移、侵袭和转移[11]。课题组前期制备了纳米雄黄酸飞品(Acid Cleaning-Realgar Nanoparticles,NRPP),并对其抗肿瘤活性进行了筛选,发现其能有效抑制乳腺癌MCF-7细胞增殖[12-14]。为进一步探究NRPP对乳腺癌细胞增殖的影响,本论文选择了三种乳腺癌细胞做活性筛选,并分别从凋亡和自噬角度初步开展其机制研究,以期为今后开发治疗乳腺癌的药物提供科学依据。
1 材料
1.1 细胞株
人乳腺癌细胞MCF-7、MDA-MB-231及MDAMB-435S购自中国典型培养物保藏中心。
1.2 药物与试剂
矿物药雄黄购自湖南石门,经湖北中医药大学张秀桥教授鉴定为硫化物类雄黄族雄黄。
CCK-8(批号:67120500,Biosharp公司);Hoechst 33258染料(批号:B2883,Sigma公司);电镜固定液和812包埋剂购自美国SPI公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号:SA00001-2,Proteintech公司);LC3抗体(批号:14600-1-AP,Proteintech公司)、GAPDH抗体(批号:8884S,CST公司)、p62抗体(批号:39749S,CST公司)、p-Akt抗体(批号:4060Ss,CST公司)、p-mTOR抗体(批号:5536s,CST公司)、p-PI3K抗体(批号:ab182651,abcam公司)、COXIV抗体(批号:11242-1-AP,Proteintech公司)。
1.3 仪器
iMark酶标仪、电泳仪(美国Bio-Rad公司);Tecnai G2 20 TWIN型透射电子显微镜(美国FEI公司);FluorChem FC3型化学发光系统(美国Proteinsimple公司);荧光倒置显微镜(日本Olympus公司)。
2 方法
2.1 NRPP的制备
将雄黄药材研磨成细粉,过200目筛。采用高能球磨机对雄黄粉体进行球磨,得到纳米雄黄生品,继续酸水飞法重复操作10次,合并所有悬液并倾去上清液,将沉淀抽滤并真空干燥即得NRPP。用PBS配成浓度为2.0 mg·mL-1的NRPP药物母液,0.22 μm微孔滤膜过滤除菌后,于4℃储存备用[11]。
2.2 细胞培养
用含10%胎牛血清和100 U·mL-1青霉素-链霉素的DMEM培养基培养MCF-7、MDA-MB-231及MDAMB-435S细胞,置于37℃、5% CO2细胞培养箱中。当细胞贴壁生长至80%左右,消化传代培养,每隔2-3 d传代一次。
2.3 CCK-8法检测细胞增殖抑制率
取处于对数生长期的细胞接种于96孔板中,调整细胞密度为3×104个·mL-1。设置NRPP浓度为0、10、20、40、80 μg·mL-1,分别给药12、24和48 h。药物作用相应的时间后每孔加入CCK-8试剂10 μL避光孵育1 h,450 nm波长下用酶标仪测量各孔光密度(OD),并计算细胞抑制率。细胞抑制率(%)=[1-(OD(加药)-OD(调零组))(/OD(空白)-OD(调零组))]×100%。
2.4 Hoechst 33258法染色前后观察细胞形态学变化
取处于对数生长期的细胞,以1×105个·mL-1接种于6孔板中,设置NRPP浓度为0、20、40、60、80 μg·mL-1,药物作用12 h后,于荧光显微镜下观察细胞形态学变化,拍照记录。各组加入细胞固定液固定,PBS润洗,33258染液室温下染色再润洗,荧光倒置显微镜下观察并拍照记录。
2.5 透射电子显微镜观察细胞超微结构变化
取处于对数生长期的细胞,以2×105个·mL-1接种于培养皿中,设置对照组和NRPP给药组(40 μg·mL-1),药物作用9 h,电镜固定液固定、离心,用含锇酸的PBS固定,依次用乙醇及丙酮脱水、包埋、切片,染色常温干燥过夜,透射电子显微镜下观察并拍照记录。
2.6 蛋白质印迹法(Western blot)检测细胞自噬及通路相关蛋白表达
取对数生长期细胞,以2×105个·mL-1接种于培养皿中,药物作用适当时间;加入裂解液提取总蛋白,BCA法进行蛋白定量。经SDS-PAGE凝胶电泳分离蛋白,湿法转膜,5%脱脂牛奶室温下封闭后加入稀释后的一抗于4℃孵育过夜,用TBST洗涤后加入二抗室温孵育1 h,TBST洗涤3次,ECL显色后使用凝胶成像系统显影,并采用Image J v1.51软件分析,以目的蛋白与内参(GAPDH)的灰度值比值作为目的蛋白的相对表达量。
2.7 统计学处理
采用SPSS 22.0软件进行统计学分析。计量资料以平均值±标准差()表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
3 结果
3.1 NRPP对MDA-MB-435S细胞增殖的影响
3.1.1 NRPP 对 MCF-7、MDA-MB-231、MDA-MB-435S细胞增殖的抑制作用
结果如图1所示,与对照组相比,在NRPP终浓度10-120 μg·mL-1内,NRPP对3种乳腺癌细胞的抑制率随着药物浓度或作用时间的增加逐渐增强(P<0.05或P<0.01),且具有剂量依赖性。当药物干预时间为12 h和24 h时,MDA-MB-231细胞IC50值最小,分别为43.84±2.63 μg·mL-1、34.61±1.72 μg·mL-1,当药物干预时间为48 h时,MDA-MB-435S细胞的IC50值最小,为23.06±1.29 μg·mL-1,如表1所示。结果提示:NRPP可抑制MDA-MB-435S细胞增殖。
3.1.2 NRPP对MDA-MB-435S细胞形态的影响
结果如图2所示,在荧光显微镜下观察,药物干预24 h,对照组细胞贴壁生长,排列紧密且形态良好呈正常梭形;随着NRPP(10、20、40、80 μg·mL-1)作用浓度的增大,细胞数量逐渐减少,细胞间间隙增大,细胞逐渐皱缩、变圆、破碎。结果提示:NRPP可抑制MDAMB-435S细胞增殖。
3.2 NRPP对MDA-MB-435S细胞凋亡的影响
3.2.1 NRPP对MDA-MB-435S细胞凋亡形态学的影响
结果如图3所示,在荧光倒置显微镜下观察,药物干预12 h,对照组细胞贴壁生长,排列紧密且形态良好呈正常梭形;随着NRPP(10、20、40、80 μg·mL-1)作用浓度的增大,细胞数量逐渐减少,细胞间间隙增大,有呈现亮蓝色皱缩的细胞,但未见明显的细胞凋亡小体。结果证实:NRPP可抑制MDA-MB-435S细胞增殖,凋亡现象不明显。
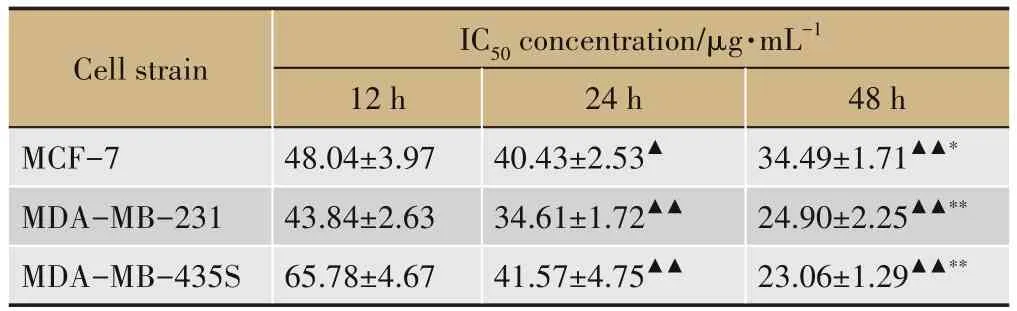
表1 NRPP对3种乳腺癌细胞干预12、24和48 h的IC50

图1 NRPP对MCF-7、MDA-MB-231及MDA-MB-435S细胞增殖的影响

图2 荧光显微镜下观察MDA-MB-435S细胞形态(×100)
3.2.2 NRPP对MDA-MB-435S细胞凋亡相关蛋白表达的影响
结果如图4所示,当药物作用时间为9 h,随着NRPP(0、10、20、40、80 μg·mL-1)剂量增大,cleaved-PARP蛋白相对表达量上升趋势不明显,且无显著性;Bcl-2蛋白相对表达量变化不明显。当NRPP剂量为80 μg·mL-1,随着作用时间(0、1、3、6、9 h)的延长,cleaved-PARP蛋白相对表达量变化不明显;Bcl-2蛋白相对表达量呈下降趋势(P<0.01)。结果提示:NRPP诱导MDA-MB-435S细胞发生凋亡现象不明显。
3.3 NRPP对MDA-MB-435S细胞自噬的影响
3.3.1 NRPP对MDA-MB-435S细胞超微结构的影响

图3 荧光倒置显微镜下观察MDA-MB-435S细胞凋亡现象(×200)

图4 NRPP对凋亡蛋白Bcl-2和cleaved-PARP表达水平的影响
结果如图5所示,在透射电镜下观察,对照组细胞的细胞核、线粒体等结构良好;NRPP(40 μg·mL-1组)细胞器明显减少,线粒体空泡化,细胞质中出现许多呈散在分布的囊泡样结构,包裹许多内源性物质,并可见囊泡样的膜结构,形成自噬体。结果提示:NRPP可能诱导MDA-MB-435S细胞发生自噬。
3.3.2 NRPP对MDA-MB-435S细胞自噬相关蛋白表达的影响
结果如图6所示,当药物作用时间为9 h,随着NRPP(0、10、20、40、80 μg·mL-1)剂量增大,p62蛋白相对表达量逐渐下降(P<0.01);LC3-Ⅱ/Ⅰ蛋白相对表达量逐渐上升。当 NRPP 剂量为 80 μg·mL-1,随着作用时间(0、1、3、6、9 h)的延长,p62蛋白相对表达量呈下降趋势(P<0.05);LC3-Ⅱ/Ⅰ蛋白相对表达量逐渐上升(P<0.01)。结果提示:NRPP可诱导MDA-MB-435S细胞发生自噬。
3.3.3 NRPP对MDA-MB-435S细胞自噬通路相关蛋白表达的影响
结果如图7所示,当药物作用时间为9 h,随着NRPP(0、10、20、40、80 μg·mL-1)剂量增大,p-PI3K和p-Akt蛋白相对表达量变化不明显,且无显著性;p-mTOR蛋白相对表达量有下降趋势(P<0.01)。当NRPP剂量为80 μg·mL-1,随着作用时间(0、1、3、6、9 h)的延长,p-PI3K、p-Akt和p-mTOR蛋白相对表达量变化均不明显,且无显著性。结果提示:NRPP诱导MDA-MB-435S细胞自噬与PI3K/Akt/mTOR信号通路关系不明显。
结果如图8所示,药物作用时间为9 h,随着NRPP(0、20、40、80 μg·mL-1)剂量增大,COXIV蛋白相对表达量逐渐下降(P<0.05或P<0.01)。结果提示:NRPP可能通过线粒体自噬诱导MDA-MB-435S细胞死亡。

图5 透射电镜下观察MDA-MB-435S细胞超微结构(×1700和×5000)

图6 NRPP对p62和LC3-Ⅱ/Ⅰ表达水平的影响
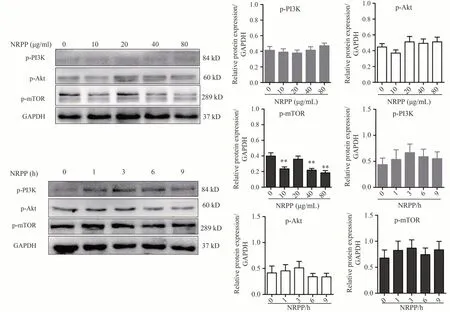
图7 NRPP对PI3K/Akt/mTOR通路蛋白表达水平的影响

图8 NRPP对线粒体自噬蛋白C OXIV表达水平的影响
4 讨论
细胞自噬与凋亡控制着生物体内细胞器和蛋白质的周转,是细胞程序性死亡的两种方式,为人体生命活动不可或缺的过程。随着现代生物医疗技术的飞速发展,纳米技术在中医药领域的应用越来越广泛,目前关于将雄黄纳米化来提升其生物利用率、减毒增效、增强靶向性等优点已得到多研究的证实。王涛[15]研究发现相较于原药雄黄,亲水性纳米雄黄制剂在水中的分散性更高,生物利用度增大;以小鼠三阴性乳腺癌(T41细胞和巨噬细胞RW264.7)移植瘤模型和慢性髓系白血病为对象进行药物干预实验,结果显示亲水性纳米雄黄制剂可有效降低白血病细胞存活率,促进白血病细胞凋亡并阻滞细胞周期;王胜玫等[9]通过实验证明雄黄纳米化后增加了其水溶性,提高了生物利用率;随着纳米雄黄浓度的升高,对肺癌A549细胞的抑制作用逐渐增强,同时促进细胞凋亡作用加强。本课题组前期研究并制备了纳米雄黄(NRPP),在急性毒性、质量标准、抗肿瘤活性等方面开展了系列研究[8,10-12],证实了将雄黄纳米化后其溶解度提高,毒性降低,致使乳腺癌细胞对其更加敏感。
为进一步确定NRPP对乳腺癌细胞活性的影响并探究其作用机理,本论文中首先采用CCK-8实验检测了NRPP对3种人源性乳腺癌细胞增殖的抑制率,实验结果显示NRPP对三种乳腺癌细胞增殖均有较强的抑制作用,且在干预细胞48 h时,对MDA-MB-435S细胞的抑制作用最强,且药物对细胞的半数抑制浓度IC50值较低。故后续实验以MDA-MB-435S细胞为受试对象,进一步探索NRPP抗乳腺癌的作用机制,寻找作用靶点,为后期深入信号通路研究奠定基础。
采用Hoechst 33258染色,观察NRPP对MDAMB-435S细胞增殖的影响,以及凋亡发生时的形态学现象,Western blot法检测凋亡标志性蛋白cleaved-PARP和抑凋亡蛋白Bcl-2表达水平。结果显示NRPP对MDA-MB-435S细胞增殖有较显著的抑制作用,细胞损伤严重,但凋亡现象不明显,未见明确的凋亡小体;提示NRPP抑制MDA-MB-435S细胞增殖的作用靶点可能不是凋亡途径。为继续寻找NRPP抗乳腺癌的作用靶点,作者从细胞自噬的角度展开研究,分别对细胞自噬形态学、标志性自噬蛋白、信号通路方面进行实验。
采用透射电子显微镜观察自噬形态学现象,给药组实验结果中观察到线粒体空泡、死亡细胞数量增多、受损伤的线粒体及自噬体等现象,提示NRPP可以诱导MDA-MB-435S细胞自噬死亡。微管相关蛋白轻链LC3Ⅱ/Ⅰ的表达量大小可作为自噬的标志物来反映细胞内自噬活性,在自噬形成时LC3-Ⅰ会酶解转化为LC3-Ⅱ,LC3Ⅱ/Ⅰ比值大小与自噬活性呈正相关[16-18]。p62为一种泛素结合蛋白,在LC3作用域(LIR)内与LC3蛋白结合,还可作为自噬体与底物之间的适配蛋白,参与自噬调节过程[19-21],在细胞发生自噬过程中扮演重要角色。故文中运用Western blot法检测自噬金标杆蛋白LC3Ⅱ/Ⅰ和p62蛋白的表达水平,结果显示LC3-Ⅱ/Ⅰ和p62蛋白过表达,提示NRPP可通过诱导MDA-MB-435S细胞发生自噬,从而抑制细胞的增殖。
NRPP通过何种信号通路诱导MDA-MB-435S细胞发生自噬。查阅文献可知PI3K/Akt/mTOR途径为细胞自噬经典途径[22],当信号通路被抑制时激活自噬。Yang等[23]研究发现纳米雄黄可通过抑制PI3K/Akt/mTOR信号通路来抑制肺癌干细胞增殖,且从体内外两个方面验证了该结果;丹参酮Ⅰ可通过抑制PI3K/Akt/mTOR通路诱导卵巢癌A2780和ID-8细胞凋亡并促进自噬,进而抑制肿瘤生长[24]。故本论文首先检测了PI3K/Akt/mTOR的表达水平,实验结果显示磷酸化p-PI3K、p-Akt和p-mTOR蛋白相对表达量变化均不显著。纳米雄黄的主要成分为As2S2,是一种砷剂。砷暴露能使线粒体空泡化,嵴肿胀、破裂和消失,有研究表明线粒体自噬可不依赖于PI3K/Akt/mTOR途径产生[25]。则我们考虑NRPP不通过经典途径诱导细胞自噬,而是通过线粒体自噬呢?结合前期荧光显微镜和透射电子显微镜观察MDA-MB-435S细胞形态及超微结构变化,已观察到NRPP干预后细胞出现线粒体空泡、线粒体受损,提示NRPP可能通过线粒体自噬诱导MDA-MB-435S细胞死亡,故继续开展实验验证此推测。
COX Ⅳ蛋白是一种呼吸链复合物,位于线粒体内膜上[26-27]。当线粒体受损伤时,COX Ⅳ脱离线粒体,表达水平下降[28]。故COX Ⅳ常被作为线粒体自噬的标志蛋白。Western blot实验提示随着NRPP作用浓度的升高,COX Ⅳ表达逐渐降低,并呈现浓度依赖性(P<0.05),证实NRPP可通过线粒体自噬诱导MDA-MB-435S细胞死亡。
综上所述,本论文探究NRPP抑制三种乳腺癌细胞的增殖,找到了相对敏感的细胞株MDA-MB-435S;然后对NRPP抑制MDA-MB-435S细胞增殖的作用靶点展开研究,发现其可以通过自噬诱导死亡而非凋亡;进而对其自噬的信号通路深入研究,发现NRPP诱导MDA-MB-435S细胞发生可能是线粒体自噬而非PI3K/Akt/mTOR自噬经典途径。
本文从抑制细胞增殖、诱导凋亡和自噬3个方面进行了研究,明确了NRPP可通过线粒体自噬途径诱导MDA-MB-435S细胞自噬性死亡,该结果为本课题组后续展开进一步体内验证奠定了基础,为今后NRPP抗乳腺癌新药研发提供了依据。

