土鳖虫通过改善炎症抑制深静脉血栓形成的机制研究*
罗淑芳 ,黄博宁 ,何广铭 ,桂蜀华 ,詹雅娴 ,张威鹏 ,林宝琴 **
(1.广州中医药大学第一附属医院 广州 510405;2.深圳市市场监督管理局许可审查中心 深圳 518071;3.广东一方制药有限公司 佛山 528244;4.广州中医药大学中药学院 广州 510006)
深静脉血栓形成(Deep Vein Thrombosis,DVT)在人群中发病率高达1.52‰,是心血管疾病死亡的主要原因之一[1-2]。目前抗凝和溶栓为DVT的基本治疗方法,可以使用的西药主要有华法林、肝素、尿激酶和利伐沙班,但这些药物均有自发性出血的严重不良反应[3-4]。络脉血瘀湿阻是DVT的主要病机,在中医属“脉痹”、“血瘀证”范畴,因此应以活血化瘀为主要治法[5-6]。中药具有安全、有效、副作用小的特点,在预防和治疗DVT中具有独特优势。
土鳖虫又名土鳖、土元、地乌龟,最早记载于《神农本草经》中,《金匮要略》和《本草纲目》等经典著作中均有记述,为鳖蠊科昆虫冀地瞥Steleophagaplancyi(Boleny)或地鳖(Eupolyphaga sinensisWalker,ESW)的雌虫干燥体,是中医临床常用的活血化瘀类中药。其性味咸寒、有小毒、归肝经。2020年版《中华人民共和国药典》记载道土鳖虫破血逐瘀,续筋接骨,用于跌打损伤、筋伤骨折、血瘀经闭、产后瘀阻腹痛、癥瘕痞块[7]。
现代药理研究表明,土鳖虫具有抗凝血、溶解血栓、抗肿瘤、调节血脂、促进骨骼愈合、镇痛、抗菌、抗缺血缺氧及保护血管内皮细胞等广泛的药理作用[8-12]。前人对土鳖虫抗血栓的研究多集中于土鳖虫对体外血栓的影响[13-15]。Wang等[13]发现土鳖虫具有纤溶酶原和纤溶酶原激活物质活性的蛋白质具有体外抗血栓作用。黎子蔚等[14]发现地鳖纤溶活性蛋白具有较强的体外溶栓活性。郎杰等[15]发现土鳖虫对体外血栓的形成具有抑制作用。而土鳖虫的体内抗栓作用及机制研究则少有报道。因此,我们采用狭窄法诱导SD大鼠下腔静脉血栓形成模型,给药土鳖虫以考察其抗体内深静脉血栓形成的机制。
1 材料
1.1 动物
SPF(Specific Pathogen Free,SPF)级 SD 大鼠,雄性,体质量250-300 g,由广州中医药大学实验动物中心提供,合格证号:SCXK(粤)2018-0034。
1.2 药物及试剂
土鳖虫配方颗粒(广东一方制药有限公司生产,批号:8031823,生药来源:Eupolyphaga sinensisWalker的雌虫干燥体,提取率:0.22 g颗粒/g生药,其主要化学成分见图1);生理盐水(佛山双鹤药业有限公司,批号:140911A);戊巴比妥钠(德国默克公司,批号:110320);注射用头孢曲松钠(深圳立健药业有限公司,批号:14081301);二磷酸腺苷(ADP,北京雷根生物技术有限公司,批号:0605A18);肝素钠(成都市海通药业有限公司,批号:180109);4%多聚甲醛(天津市福晨化学试剂厂,批号:20110211);硫酸氢氯吡格雷(深圳信立泰药业股份有限公司,批号:22140201);大鼠白细胞介素-1β(Interleukin-1β,IL-1β)ELISA试剂盒(美国eBioscience公司,批号:145535023);大鼠肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α) ELISA试剂盒(联科生物科技有限公司,批号:238280121);山羊血清(康为世纪生物科技有限公司,货号:CW0130S);4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(美国Sigma公司,货号:D9542);免疫组化试剂盒(康维世纪有限公司,货号:CW2069S);抗TF抗体(英国Abcam公司,货号:ab151748);抗CD68抗体(英国 Abcam 公司,货号:ab31630);HRP-linked antirabbit IgG(美国CST公司,货号:7074);HRP-linked anti-mouse IgG(美国 CST公司,货号:7076);Anti-Ly6g 抗体(英国Abcam公司,货号:ab25024);抗荧光淬灭剂(碧云天生物科技,货号:P0126);Triton-X-100(美国AMRESCO公司,货号:T0694-100)。

图1 土鳖虫配方颗粒特征图谱
1.3 主要仪器
GXG电子天平(常熟市双杰测试仪器厂,型号:JJ3000);万分之一分析天平(梅特勒-托利多仪器上海有限公司,型号:EL204);离心机(美国赛洛捷克公司,型号:D3024R);血小板聚集仪(北京普利生公司,型号:LBY-NJ2);全自动血凝分析仪(希森美康医用电子上海有限公司,型号:SYSMEX CA-510);全自动血液流变分析仪(北京普利生公司,型号:LBY-N6B);全自动血液分析仪(日本希森美康医用电子有限公司,型号:SYSMEX XT-2000iv);全波长酶标仪(Thermo Fisher scientific公司,型号:Multiskan FC);激光共聚焦显微镜(上海卡尔蔡司管理有限公司,型号:LSM800);正置生物显微镜(日本OLYMPUS公司,型号:BX53)。
2 方法
2.1 模型制备
手术前各组动物禁食12 h。大鼠腹腔注射戊巴比妥钠(3%,1.2 mL·kg-1,36 mg·kg-1)麻醉。麻醉起效后,腹部剃毛,大鼠仰卧位放置在手术操作台上,固定四肢,腹部碘酒消毒。沿腹中线划开腹腔3-4 cm,朝手术者右侧方向轻微拨开腹腔脏器,确认左肾静脉下方与下腔静脉交界处为结扎点,见图2。用玻璃分针仔细游离腹主动脉和下腔静脉,在下腔静脉下方穿过5-0真丝缝合线,另取0.35 mm×50 mm规格针灸针与下腔静脉主干并排,缝合线将下腔静脉与针灸针一并扎紧,然后谨慎抽出并排的针,完成造模[16]。确认大鼠呼吸平稳,将大鼠腹腔脏器复位,滴加约0.5 mL生理盐水补充术后缺水。3-0真丝缝合线分别缝合皮下组织和皮肤,每层缝合的创口上均洒少许注射用头孢曲松钠粉末预防术后感染。
2.2 分组及给药
将动物分为正常组(Normal)、假手术组(Sham)、模型组(Model)、土鳖虫低剂量组(0.52 g ESW·kg-1)、土鳖虫高剂量组(1.04 g ESW·kg-1)、肝素组(HEP)、氯吡格雷组(CLP),共7个组。正常组、假手术组、模型组、土鳖虫低、高剂量组均按给药体积10 mL·kg-1·d-1灌胃,正常组和模型组给予蒸馏水。土鳖虫低和高剂量组给药剂量分别为0.52和1.04 g生药·kg-1·d-1,连续给药7天,于第6天造模,造模后1 h给药,第7天给药后1.5 h取材。肝素钠组造模后1 h及24 h尾静脉注射肝素钠,给药剂量为200 U·kg-1·d-1,给药体积为1 mL·kg-1·d-1,末次给药后1.5 h取材。氯吡格雷组造模前2 h及造模后24 h灌胃给予氯吡格雷,给药剂量为 25 mg·kg-1·d-1,给药体积为 10 mL·kg-1·d-1,末次给药后1.5 h取材。
2.3 血液样本采集
末次给药1.5 h后,戊巴比妥麻醉大鼠(3%,1.2 mL·kg-1),开腹,分离腹主动脉,用真空采血管取血。
2.4 检测指标
2.4.1 血栓湿重
末次给药1.5 h后,分离下腔静脉(含血栓),用滤纸吸干残留血液,分析天平精密称量质量(mg)。假手术组取血管1.5 cm左右;血栓超过1 cm的切取实际长度;血栓不够1 cm的切取1 cm。称重后,将血栓组织置于-80℃冰箱冷冻保存以待检测。
2.4.2 血小板聚集率的检测
取3.2%枸橼酸钠真空抗凝管收集的抗凝血于1000 r·min-1,25℃下离心10 min,取上清,即得富血小板血浆(Platelet Rich Plasma,PRP)。以生理盐水作为实验用贫血小板血浆(Platelet Poor Plasma,PPP)。取200 μL PPP和PRP分别加入到比色皿中,37℃温育3 min后检测:先放入PPP调零,然后取出PPP,放入待检的PRP,加入磁棒搅拌,加入50 μL 10 μmol·L-1ADP诱导血小板聚集,记录血小板最大聚集率。
2.4.3 凝血功能指标、全血粘度、血常规的检测
取3.2%枸橼酸钠抗凝血于1400 r·min-1,4℃下离心10 min,将分装好的血浆用全自动血凝分析仪检测活化部分凝血活酶时间(Activated partial thromboplastin time,APTT)、凝血酶原时间(Prothrombin time,PT)。取3.2%枸橼酸钠抗凝血用全自动血液流变分析仪检测全血粘度,取乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)真空抗凝管收集的抗凝血用全自动血液分析仪检测血常规。

图2 下腔静脉狭窄法诱导DVT模型的形态学图像

图3 土鳖虫对血栓湿重的影响(,n=10)

图4 各组下腔静脉(含血栓)的剖解图

图5 土鳖虫对ADP诱导的血小板聚集率的影响(,n=10)
2.4.4 血清中炎症因子的检测
用不含抗凝剂或促凝剂的真空采血管收集血液样本,于1100 r·min-1,4℃下离心10 min,获得血清,用ELISA方法分析血清中IL-1β和TNF-α水平。
2.4.5 组织病理学分析
取一部分静脉壁(含血栓)于4%多聚甲醛中,置于4℃冰箱充分固定48 h以上,常规石蜡包埋后,进行HE病理切片染色,高倍镜下(400倍)观察静脉壁及血栓中的炎性细胞浸润程度。并选取5个视野,计数静脉壁及血栓内的炎性细胞数量。
2.4.6 免疫组织化学分析
取一部分静脉壁(含血栓)以4%多聚甲醛固定,常规石蜡包埋后,进行组织病理学切片(4 μm)。切片经脱蜡、水化、热修复后,37℃下加入10%山羊血清封闭30 min,弃去血清,分别加入抗TF的抗体(1∶200)和抗CD68的抗体(1∶200),4℃孵育过夜,磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)洗片3次后滴加辣根过氧化酶标记的二抗,室温孵育1 h,PBS洗片3次。使用二氨基联苯胺法(3,3'-diaminobenzidine,DAB)显色试剂盒显色,显色后以苏木素复染,脱水,透明,中性树胶封片。光学显微镜下观察并采集图像。
2.4.7 免疫荧光分析
从-80℃冰箱中取出静脉壁(含血栓),冰冻切片(4 μm)于黏性载玻片上,用-20℃预冷丙酮溶液固定15 min,磷酸盐吐温缓冲液(Phosphate-Buffered Saline with Tween 20,PBST)洗片3次。室温下,切片置于1%Triton X-100通透20 min,PBST洗片3次后于37℃下加入10%山羊血清封闭60 min,弃去血清,加入抗Ly6g 的 抗 体(Fluorescein Isothiocyanate,FITC)(1∶1000)于37℃下孵育60 min,PBST洗片3次,并用DAPI复染5 min,激光扫描共聚焦显微镜下观察并采集荧光图像。
2.5 统计学分析
实验数据采用统计产品与服务解决方案(Statistical Product and Service Solutions,SPSS)20.0 统计软件处理。所有数据以均数±标准差()表示,两两比较用t检验,多组比较用单因素方差分析进行统计学比较。
3 结果
3.1 土鳖虫对血栓栓重的影响
结果如图3和图4所示。正常组和假手术组均没有血栓形成。与假手术组相比,模型组大鼠栓重显著增加(P<0.01);与模型组相比,土鳖虫剂量依赖性地降低栓重,高剂量组的血栓抑制率达58.20%(P<0.01)。

图6 土鳖虫对APTT和PT的影响(,n=10)
表1 土鳖虫对全血粘度的影响(,n=10)

表1 土鳖虫对全血粘度的影响(,n=10)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05;与土鳖虫低剂量组比较, bP<0.01。
5(s-1)16.54±2.65 16.19±2.75 12.48±2.47**12.69±1.76 16.10±1.68#b 13.73±1.94 14.46±1.92 Groups Normal Sham Model 0.52 g ESW·kg-1 1.04 g ESW·kg-1 HEP CLP Middle share(mPa.s)Low share(mPa.s)High share (mPa.s)200(s-1)5.22±0.38 5.10±0.49 4.28±0.59**4.01±0.26 4.67±0.40b 4.18±0.44 4.25±0.43 150(s-1)5.52±0.39 5.36±0.47 4.23±0.60**4.02±0.23 4.87±0.42#b 4.37±0.46 4.40±0.47 50(s-1)7.14±0.63 6.86±0.88 5.54±0.90**5.07±0.42 6.25±0.59b 5.44±0.69 5.61±0.71 30(s-1)8.37±0.76 8.16±0.94 6.11±1.05**5.92±0.52 7.27±0.67#b 6.33±0.81 6.58±0.82
表2 土鳖虫对血细胞数量的影响(,n=10)

表2 土鳖虫对血细胞数量的影响(,n=10)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05;与土鳖虫低剂量组比较,bP<0.01。
PLT(109·L-1)1130.14±130.44 999.74±140.42 873.54±183.01 771.20±195.19 1062.50±117.48#b 958.17±161.28 887.00±180.77 Groups Normal Sham Model 0.52 g ESW/kg 1.04 g ESW/kg HEP CLP WBC(109·L-1)2.40±1.19 3.95±1.14 4.32±2.17 3.74±1.27 4.30±0.76 6.36±4.34 2.29±1.07#RBC(1012·L-1)7.77±0.64 7.33±0.60 6.34±0.53**6.39±0.40 6.71±0.52 5.93±0.42 6.21±0.32 HGB(g·L-1)144.43±12.64 133.63±7.77 119.89±7.89**122.11±3.86 125.83±9.54 112.33±6.53#115.33±5.47

图7 土鳖虫对血清中IL-1β和TNF-α水平的影响(,n=10)

图8 土鳖虫对TF蛋白在大鼠模型的血栓和静脉壁表达水平的影响(,n=10)
3.2 土鳖虫对血小板聚集率的影响
正常组、假手术组和模型组的ADP诱导的血小板最大聚集率没有差异。与模型组比,氯吡格雷组血小板聚集率显著降低(P<0.01),但土鳖虫对血小板聚集率没有影响。见图5。
3.3 土鳖虫对APTT和PT的影响
结果如图6所示,与模型组相比,肝素组APTT和PT显著升高(P<0.01),但是土鳖虫对APTT和PT没有影响。
3.4 土鳖虫对全血粘度的影响
结果如表1所示,与假手术组相比,模型组大鼠全血粘度均有降低。与模型组相比,土鳖虫高剂量组中切(150 s-1)、低切(30 s-1)和低切(5 s-1)有显著升高(P<0.05)。
3.5 土鳖虫对血细胞数量的影响
结果如表2所示,与假手术组相比,模型组红细胞(Red blood cell,RBC)和血红蛋白(Hemoglobin,HGB)数量均减少(P<0.01)。与模型组相比,土鳖虫高剂量组血小板(Platelet,PLT)数量升高了21.63%(P<0.05)。
3.6 土鳖虫对血清IL-1β和TNF-α水平的影响
结果如图7表示,与假手术组相比,模型组大鼠血清中IL-1β(P<0.05)和TNF-α(P<0.01)水平均显著升高。低、高剂量土鳖虫均显著降低IL-1β和TNF-α水平。与模型组相比,土鳖虫低剂量组血清IL-1β和TNF-α 水平分别降低 81.76%(P<0.01)和 54.27%(P<0.01)。
3.7 土鳖虫对TF蛋白表达的影响
结果如图8所示,TF蛋白在模型大鼠的血栓和静脉壁中高表达。与模型组相比,低(P<0.05)和高(P<0.01)剂量土鳖虫显著降低TF蛋白表达水平。
3.8 土鳖虫对炎性细胞渗出和浸润的影响
如图7-11所示,与正常组和假手术组相比,模型组静脉壁的炎性细胞明显增多。与模型组相比,各给药组血管壁炎性细胞均有所减少,土鳖虫低剂量组和高剂量组炎性细胞抑制率分别为30.91%(P<0.01)和60.19%(P<0.01)。与模型组相比,土鳖虫低剂量组血栓中炎性细胞减少,抑制率为23.92%(P<0.01),土鳖虫高剂量组降低尤其明显,其对炎性细胞抑制率达51.43%(P<0.01)。
4 讨论
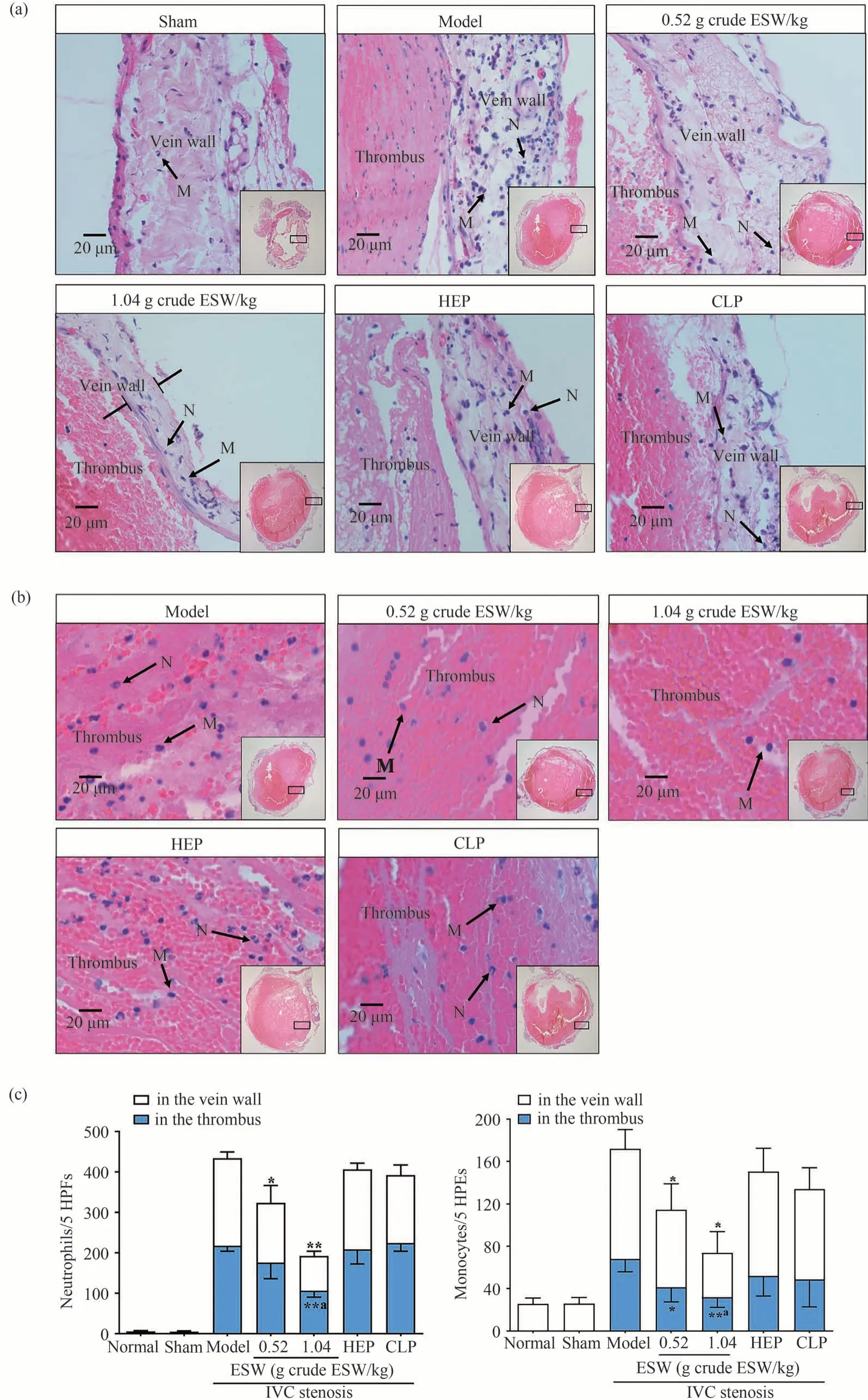
图9 土鳖虫对炎性细胞浸润的影响(,n=10)

图10 土鳖虫对单核细胞募集的影响(,n=10)
本研究结果显示高剂量土鳖虫明显升高DVT大鼠的血小板数量,这可能与土鳖虫抑制血栓形成相关。血小板参与静脉血栓的形成[17],土鳖虫可减少静脉血栓形成过程中的血小板消耗,使得血液循环系统中的血小板数量升高。本研究还发现土鳖虫提高DVT大鼠的全血粘度,这可能与其升高血小板数量密切相关。然而,有研究报道土鳖虫水提物对正常SD大鼠的全血粘度无明显影响[18],水提醇沉法制备土鳖虫的注射液可以显著降低正常的大耳白兔的全血粘度[19]。除此之外,本研究结果表明土鳖虫对ADP诱导的血小板最大聚集率没有影响,此结果与郎杰等[20]的研究结果基本一致。而王怡等[19]研究发现对正常大耳白兔给予土鳖虫后,能明显抑制改良SCHATZ法检测的血小板聚集率。许俊杰等[18]发现土鳖虫能显著抑制正常SD大鼠的血小板聚集率。本研究结果与前人的研究结果不一致的原因可能是实验方法、实验动物或造模方法不同。

图11 土鳖虫对中性粒细胞募集的影响(,n=10)
黄镇林等[9]发现土鳖虫抗凝组分F2-2多肽能显著延长肾上腺素配合冰浴刺激诱导的大鼠急性血瘀证模型的APTT、PT,而本研究发现土鳖虫配方颗粒对下腔静脉狭窄法诱导的DVT大鼠的APTT、PT没有影响。研究结果不一致的原因可能是受试物、造模方法不同。土鳖虫配方颗粒,是采用中医传统的水煎方法提取药物成分制备成颗粒。土鳖虫多肽F2-2,是采用酶解法从土鳖虫中提取获得[9]。两者的主要化学成分存在着较大的差异。此外,肾上腺素配合冰浴刺激的急性血瘀证模型的造模机理是源于中医理论。中医理论认为“寒邪”和“忧郁”为血液高凝(急性血瘀)的病因,冰浴刺激模拟“寒邪”入侵机体,加上注射肾上腺素模拟人体释放肾上腺素,从而复刻血液高凝模型[21]。然而,下腔静脉狭窄法诱导大鼠DVT的过程,实际上是血管的狭窄导致局部缺氧缺血引起的局部炎症所致,其造模机理与传统认为的血液高凝诱发血栓形成的观点不同[22-23]。
DVT形成的三大因素为血流滞缓、血管内皮细胞细胞损伤和血液高凝状态[24]。现代医学研究关注更多的是血栓形成的非高凝阶段。已有研究发现,炎症因子和免疫细胞在DVT的形成和发展中发挥着重要作用[25]。通过狭窄大鼠下腔静脉造成局部缺血缺氧,导致静脉内皮激活并表达出粘附分子和趋化因子[26]。粘附分子和趋化因子通过介导白细胞-内皮细胞、白细胞-血小板和白细胞-白细胞的粘附,促发静脉腔炎性细胞浸润和静脉壁炎性细胞渗出[27-30]。此外,中性粒细胞释放丝氨酸蛋白酶,降解组织因子途径抑制物和血栓调节蛋白,也可钝化抗凝系统功能[31]。由此可见,缺血缺氧最终可通过激活凝血系统和抑制抗凝系统诱导DVT。本实验对DVT大鼠给予土鳖虫后,静脉壁和血栓组织的中性粒细胞和单核细胞数量以及TF蛋白表达明显减少,而且血清IL-1β和TNF-α水平均显著降低,结果提示土鳖虫可能通过改善炎症微环境,修复静脉内皮损伤,发挥抗DVT的作用。
值得一提的是,土鳖虫具有促进纤维蛋白溶解的作用[20],但本研究尚未解释土鳖虫能否作用于纤溶系统而抑制下腔静脉狭窄法诱导的DVT。此外,血管狭窄造成内皮细胞缺氧而激活释放大量的活性氧同样可诱导一系列促血栓反应,最终导致静脉血栓形成[32]。土鳖虫能否通过改善内皮细胞氧化应激而抑制DVT仍需进一步的验证。
综上所述,土鳖虫具有显著抑制DVT的作用,其抗血栓作用很可能与其改善炎症微环境和修复内皮损伤有关。但是,土鳖虫抗血栓作用可能是多方面因素综合作用的结果。抗炎可能只是土鳖虫抗血栓作用机制中的一个,并且土鳖虫修复内皮损伤的分子机制有待深入研究。本研究也为土鳖虫活血化瘀功效的研究提供了新的思路。

