羟自由基氧化对牛肌原纤维蛋白结构与乳化性能的影响
马思丽,杨 波,李亚蕾,罗瑞明,马旭华
(宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
肉及肉制品在加工贮藏过程中极易受到温度、光照和氧气等外界条件的影响而导致蛋白质氧化,致使肉品质量下降,品质劣变严重[1-2]。蛋白质氧化会导致其结构改变,包括氨基酸侧链的修饰、蛋白质肽链骨架的断裂、蛋白分子内和分子间发生交联或聚合等,进而引起蛋白质凝胶性和乳化性等功能特性的改变[3]。
目前,关于蛋白质功能特性方面的研究,多集中于氧化对肌原纤维蛋白结构与凝胶特性的影响,而关于氧化对肌原纤维蛋白结构变化与乳化性能的研究较少,且现有研究报道结果不一致。Sun Weizheng等[4]采用Fenton体系构建羟自由基氧化体系(H2O2浓度分别为0、0.2、0.5、1.0、3.0、5.0、10 mmol/L),并于37 ℃将猪肌原纤维蛋白(蛋白终质量浓度10 mg/mL)氧化孵育3 h,探究化学氧化对猪肌原纤维蛋白乳化特性的影响,发现随H2O2浓度的增加,肌原纤维蛋白的电荷、表面活性和结构发生改变,蛋白质氧化对肌原纤维蛋白的乳化性能有负面影响。岳开华等[5]采用羟自由基氧化体系(FeCl3、抗坏血酸浓度均为0.1 mmol/L,H2O2浓度分别为1、5、10 mmol/L)于4 ℃条件下对海鲈鱼肌原纤维蛋白(蛋白终质量浓度10 mg/mL)分别氧化2、4、6 h,结果发现同一氧化时间下,蛋白质的乳化活性和乳化稳定性随氧化剂浓度增加呈下降趋势,而同一氧化剂浓度下,蛋白质的乳化活性和乳化稳定性随氧化时间的延长逐渐降低。李艳青[6]采用羟自由基氧化体系(FeCl3、抗坏血酸浓度均为0.1 mmol/L,H2O2浓度分别为0、0.1、1、5、10、20 mmol/L)于4 ℃条件下将鲤鱼肌原纤维蛋白(蛋白终质量浓度20 mg/mL)分别氧化孵育1、3、5 h,发现同一氧化时间下,随H2O2浓度的升高,鲤鱼肌原纤维蛋白乳化活性和乳化稳定性呈下降趋势;而张丽等[7]采用羟自由基氧化体系(0.01 mmol/L FeCl3、0.1 mmol/L抗坏血酸,H2O2浓度分别为0.3、0.4、0.5 mmol/L)于4 ℃条件下将牦牛肌原纤维蛋白(蛋白终质量浓度(15±0.5)mg/mL)氧化孵育24 h,发现适当氧化对牦牛肌原纤维蛋白的溶解性和乳化性有一定改善作用。可见,关于氧化强度对肌原纤维蛋白乳化性能的影响还需进一步研究。
在宰后成熟过程中引起肉品蛋白质氧化的途径有羟自由基氧化、高铁肌红蛋白氧化和脂质氧化3 种[8],其中羟自由基氧化被认为是鲜肉氧化的主要原因,它直接影响肌原纤维蛋白的结构与功能性质[6]。牛肉富含人体必需氨基酸,具有高蛋白质、低脂肪和低胆固醇等特点,深受消费者喜爱,但其在贮藏加工过程中易受到氧化的影响[9],因此,本研究主要针对牛肌原纤维蛋白,借助Fenton氧化体系构建羟自由基体外模拟氧化体系,分析不同氧化强度下肌原纤维蛋白理化特性、交联降解情况、结构以及乳化性能的变化,探究蛋白质氧化程度、结构变化和乳化性能的内在联系,以期为肉及肉制品的加工和贮藏提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜秦川牛肉采自宁夏泾源县清苑牧业有限公司,选取6 头48 月龄生长发育良好、体况相近、健康无病的秦川公牛(去势),屠宰后立即取背最长肌,真空包装置于装有冰袋的保温箱中运回实验室。
脲(尿素)、磷酸钠(磷酸三钠)、磷酸(质量分数85%)、氢氧化钠(粒状)(均为分析纯)国药集团化学试剂有限公司;抗坏血酸钠、无水氯化镁、考马斯亮蓝R250、盐酸胍、5,5’-二硫代双(2-硝基苯甲酸)、乙二醇双(2-氨基乙基醚)四乙酸(ethylene bis(2-oxyethylenenitrilo)tetraacetic acid,EGTA)(均为分析纯) 上海麦克林生化科技有限公司;2,4-二硝基苯肼(分析纯) 北京索莱宝科技有限公司;乙醇(体积分数95%)、氯化钠、十二烷基硫酸钠、氯化钾、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(均为分析纯) 西陇化工股份有限公司;冰乙酸(优级纯)、过氧化氢(质量分数30%,分析纯) 天津市大茂化学试剂厂。
1.2 仪器与设备
TGL-24M高速冷冻离心机 长沙平凡仪器仪表有限公司;UV-1200紫外分光光度计 上海美谱达仪器有限公司;SJ-3F便携式pH计 上海仪电科学仪器股份有限公司;JXFSTPRP-CL全自动样品冷冻研磨仪、JXH-100恒温混匀仪 上海净信实业发展有限公司;Spectrum Two傅里叶变换红外光谱仪 美国Perkin Elmer公司。
1.3 方法
1.3.1 原材料预处理
在实验室剔除牛背最长肌多余脂肪与结缔组织后,分割成大小薄厚均等的肉块(3 cm×3 cm×3 cm),无菌生理盐水冲洗干净后,用滤纸吸干表面水分,立即用液氮冷冻2 h,然后置于-80 ℃冰箱保存备用。
1.3.2 肌原纤维蛋白的提取
参考Park等[10]的方法并作适当修改。称取适量已切碎的肉样,按料液比1∶4(g/mL)加入分离缓冲液(0.1 mol/L NaCl、10 mmol/L Na3PO4、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0)混合,8 000 r/min匀浆30 s,暂停1 min,以同样转速再匀浆30 s,匀浆液过80 目筛,然后滤液在4 ℃、2 000×g离心15 min,收集沉淀。采用上述相同的混合和离心条件,重复操作2 次。所得沉淀按料液比1∶4(g/mL)加入0.1 mol/L NaCl溶液洗涤,离心2 次后收集沉淀即为肌原纤维蛋白,于4 ℃冷藏,24 h内用完。
1.3.3 肌原纤维蛋白的氧化
参考Xiong Youling[11]和方海砚[12]等的方法构建Fenton氧化体系:0.01 mmol/L FeCl3、0.1 mmol/L VC,H2O2浓度分别为0.5、1、5、10、20 mmol/L,以上氧化体系在50 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl,pH 6.0)中进行。将提取出的肌原纤维蛋白均匀分散于构建的氧化体系中(蛋白终质量浓度15 mg/mL),在4 ℃条件下氧化24 h后加入终浓度1 mmol/L EDTA终止反应,冷冻离心(4 ℃、4 000 r/min,10 min),沉淀用5 倍体积50 mmol/L磷酸盐缓冲液(pH 7.0)溶解,4 ℃、2 000×g离心15 min,收集沉淀,重复洗涤2 次以除去氧化剂。以肌原纤维蛋白分散于50 mmol/L磷酸盐缓冲液(含0.6 mmol/L NaCl,pH 6.0,蛋白终质量浓度15 mg/mL)为对照组,于4 ℃放置24 h,其余操作同氧化组。
1.3.4 羰基含量的测定
参考Oliver等[13]的方法并作适当修改。用0.1 mol/L KCl溶液将肌原纤维蛋白质量浓度调整为5 mg/mL,用2,4-二硝基苯肼反应测定羰基含量,摩尔吸光系数为22 000 L/(mol·cm)。
1.3.5 总巯基和游离巯基含量的测定
参考Yongsawatdigul等[14]的方法并稍作修改。
总巯基含量:取0.5 mL 1 mg/mL肌原纤维蛋白溶液加入10 mL离心管中,每管加入4.5 mL Tris-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、4 mmol/L EDTA、8 mol/L尿素,pH 8.0),混匀后加入0.5 mL Ellman试剂,涡旋混匀后在30 ℃条件下反应30 min,然后在波长412 nm处测定吸光度。
游离巯基含量:在不含尿素的情况下,于30 ℃反应30 min,其余操作同上。
根据巯基摩尔吸光系数13 600 L/(mol·cm)按式(1)计算巯基含量。实验重复3 次,结果以每毫克蛋白所含巯基物质的量表示。用考马斯亮蓝法,以牛血清蛋白做标准曲线,计算蛋白含量。

式中:A为样品组在412 nm波长处的吸光度;ρ为蛋白质量浓度/(mg/mL);11为稀释倍数。
1.3.6 二聚酪氨酸含量的测定
参考张丽等[7]的方法并加以修改,用20 mmol/L磷酸盐缓冲液(含0.6 mol/L KCl,pH 6.0)调节蛋白质量浓度,溶液经过滤除去不溶物质后,用考马斯亮蓝法测定蛋白质量浓度。用荧光分光光度计测定吸光度,发射波长420 nm,激发波长325 nm,狭缝宽度10 nm。二聚酪氨酸含量以相对荧光值(即吸光度除以蛋白质量浓度)表示。
1.3.7 表面疏水性的测定
参考Chelh等[15]的方法并稍作修改,用20 mmol/L磷酸盐缓冲液(含0.6 mol/L KCl,pH 6.0)将蛋白质溶液稀释至1 mg/mL。取1 mL稀释后的蛋白质溶液加入80 µL 1 mg/mL溴酚蓝溶液混匀,室温下搅拌10 min,7 000 r/min离心15 min,取上清液以20 mmol/L磷酸盐缓冲液(含0.6 mol/L KCl,pH 6.0)稀释10 倍后,测定595 nm波长处吸光度。以1 mL 20 mmol/L的磷酸盐缓冲液(pH 6.0)加入80 μL 1 mg/mL溴酚蓝溶液作为空白组。表面疏水性按式(2)计算:
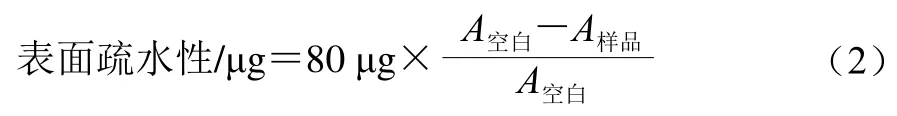
式中:A空白为空白组在595 nm波长处的吸光度;A样品为样品组在595 nm波长处的吸光度。
1.3.8 蛋白质二级结构的测定
参考Li Ke等[16]的方法并稍作修改,将氧化后的肌原纤维蛋白膏真空冷冻干燥后,与干燥的溴化钾按质量比1∶150充分混合,用玛瑙研钵碾磨,然后将粉末放入压片机中制成薄片。用傅里叶红外光谱仪采集光谱数据,扫描范围4 000~400 cm-1,扫描64 次,分辨率4 cm-1。获得1 700~1 600 cm-1的吸收光谱,用于酰胺Ⅰ带分析。利用PeakFit 4.12软件对1 700~1 600 cm-1波段内的光谱图进行傅里叶自动去卷积和二阶导数峰拟合,计算蛋白质二级结构α-螺旋、β-转角、β-折叠和无规卷曲的相对含量。
1.3.9 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
参考Shen Hui等[17]的方法并稍作修改,将不同氧化程度的肌原纤维蛋白悬浊液(4 mg/mL)与50 mmol/L Tris缓冲液(8 mol/L尿素、2 mol/L硫脲、3 g/100 mL SDS、0.05%溴酚蓝、20%(V/V)甘油,pH 6.8)按体积比1∶1混合,沸水浴中加热5 min,然后5 000 r/min离心5 min,取15 μL上清液加入到5%的浓缩胶中,用10%的分离胶分离样品。先以80 V恒压电泳至浓缩胶与分离胶分界处,再以120 V恒压电泳至底部。电泳结束后用考马斯亮蓝R250溶液染色30 min,然后在甲醇-冰醋酸-蒸馏水(2.5∶1∶6.5,V/V)中脱色12 h。
1.3.10 肌原纤维蛋白溶解度的测定
参照Wang Shuangxi等[18]的方法并略加修改。用20 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl,pH 6.0)将蛋白质溶液稀释至2 mg/mL, 5 000×g离心10 min,收集上清液。采用考马斯亮蓝法测定上清液中蛋白含量。计算上清液中蛋白含量与原溶液中蛋白含量的百分比即为肌原纤维蛋白溶解度。
1.3.11 肌原纤维蛋白浊度的测定
用20 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl,pH 6.0)将蛋白溶液稀释至1 mg/mL,吸取5 mL于试管中,分别于30、40、50、60、70、80 ℃水浴30 min后取出,冷却后以不加蛋白的溶液为空白,在600 nm波长处测定吸光度。浊度以A600nm表示。
1.3.12 肌原纤维蛋白乳化性能的测定
参考刘娟[19]的方法。肌原纤维蛋白溶解于0.1 mol/L pH 6.5磷酸盐缓冲溶液中,蛋白质量浓度1 mg/mL,将2.0 mL大豆油和8.0 mL蛋白溶液放入直径2.5 cm塑料离心管中,10 000 r/min高速匀浆1 min,立即从距离心管底0.5 cm处取匀浆液50 μL,加入到5 mL 0.1% SDS溶液中,振荡混匀后在500 nm波长处测定吸光度A0,静置10 min后再次在相同位置取匀浆液50 μL,加入到5 mL 0.1% SDS溶液中,振荡混匀后测定吸光度A10,用0.1% SDS溶液作空白对照。肌原纤维蛋白匀浆液的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsification stability index,ESI)分别按式(3)、(4)计算:

式中:φ为油相体积分数(0.2);ρ为蛋白质质量浓度/(mg/mL)。
1.4 数据分析
2 结果与分析
2.1 羟自由基氧化对牛肌原纤维蛋白羰基含量的影响
蛋白质羰基化合物是肉类在贮藏过程中蛋白质氧化的主要产物。因此,蛋白质的羰基含量是评价蛋白质氧化的重要指标之一[20]。由图1可知,随H2O2浓度的增加,羰基含量显著增加(P<0.05)。对照组(0 mmol/L H2O2)羰基含量为1.69 nmol/mg,当H2O2浓度为20 mmol/L时,羰基含量为5.33 nmol/mg,相比对照组增加了2.15 倍,这说明随H2O2浓度的增加,产生的羟自由基含量逐渐增加,肌原纤维蛋白的氧化程度也随之加剧。

图1 羟自由基氧化后牛肌原纤维蛋白中羰基含量的变化Fig. 1 Changes in carbonyl content in myofibrillar protein after oxidation by hydroxyl radical
2.2 羟自由基氧化对牛肌原纤维蛋白总巯基和游离巯基含量的影响
巯基的减少是氧化攻击下蛋白质变化的主要共同特征之一[11]。由图2可知,随H2O2浓度的增加,总巯基和游离巯基含量均显著降低(P<0.05)。对照组(0 mmol/L H2O2)总巯基含量和游离巯基含量分别为68.71 nmol/mg和64.32 nmol/mg,当H2O2浓度增加至20 mmol/L时,总巯基含量和游离巯基含量分别降至62.46 nmol/mg和48.68 nmol/mg,较对照组相比,分别降低了9.10%和24.32%。这可能是因为肌原纤维蛋白巯基容易被活性氧自由基攻击,转化为二硫键、亚磺酸、磺酸或被一氧化氮亚硝酰化[21]。

图2 羟自由基氧化后牛肌原纤维蛋白中总巯基、游离巯基含量的变化Fig. 2 Changes in contents of total sulfhydryl and free sulfhydryl groups in myofibrillar protein after oxidation by hydroxyl radical
2.3 羟自由基氧化对牛肌原纤维蛋白二聚酪氨酸含量的影响
酪氨酸也容易受到活性氧的攻击,产生的酪氨酸自由基和酪氨酸残基形成二酪氨酸[22]。由图3可知,随H2O2浓度的增加,二聚酪氨酸含量呈上升趋势(P<0.05),对照组中二聚酪氨酸含量为25.06,当H2O2浓度为20 mmol/L时,二聚酪氨酸含量为63.18,较对照组增加了1.52 倍。
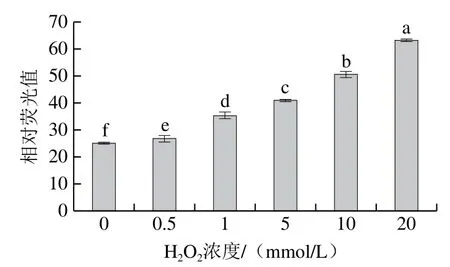
图3 羟自由基氧化后牛肌原纤维蛋白中二聚酪氨酸含量的变化Fig. 3 Change in dimer tyrosine content in myofibrillar protein after oxidation by hydroxyl radical
2.4 羟自由基氧化对牛肌原纤维蛋白表面疏水性的影响
表面疏水性即蛋白质表面疏水性氨基酸的含量,可以用来评估蛋白质构象的变化[22]。由图4可知,随H2O2浓度的增加,肌原纤维蛋白表面疏水性呈上升趋势(P<0.05)。对照组中肌原纤维蛋白溴酚蓝结合量为30.17 µg,当H2O2浓度增加至20 mmol/L,溴酚蓝结合量为55.04 µg,与对照组相比肌原纤维蛋白表面疏水性增加82.43%。

图4 羟自由基氧化后牛肌原纤维蛋白表面疏水性的变化Fig. 4 Change in surface hydrophobicity of myofibrillar protein after oxidation by hydroxyl radical
2.5 羟自由基氧化对牛肌原纤维蛋白二级结构的影响
1 700~1 600 cm-1波段主要由C=O的伸缩振动引起,该波段红外光谱可用于蛋白二级结构分析[4]。由表1可知,随H2O2浓度的增加,蛋白质氧化程度加剧,蛋白质二级结构中α-螺旋相对含量呈下降趋势(P<0.05),β-折叠呈上升趋势(P<0.05),β-转角整体呈下降趋势,无规卷曲则整体呈上升趋势,这说明氧化对蛋白质二级结构有影响,使蛋白质二级结构从有序向无序转变。

表1 羟自由基氧化后牛肌原纤维蛋白二级结构的相对含量变化Table 1 Changes in secondary structures of myofibrillar protein after oxidation by hydroxyl radical %
2.6 不同氧化强度肌原纤维蛋白的SDS-PAGE分析

图5 不同氧化强度肌原纤维蛋白的SDS-PAGE图Fig. 5 SDS-PAGE pattern of myofibrillar protein oxidized to different degrees
如图5所示,条带由上到下依次出现245 kDa的肌球蛋白重链、43 kDa的肌动蛋白以及15~25 kDa的肌球蛋白轻链。随H2O2浓度的增加,肌球蛋白重链和肌球蛋白轻链条带灰度逐渐变浅,说明氧化对肌球蛋白有影响;肌动蛋白条带灰度在0.5~1 mmol/L H2O2时略微减弱,说明氧化对肌动蛋白的影响较肌球蛋白较小。
2.7 羟自由基氧化对牛肌原纤维蛋白溶解度的影响
由图6可知,随H2O2浓度的增加,肌原纤维蛋白的溶解度呈先上升后降低的趋势(P<0.05),当H2O2浓度0~0.5 mmol/L时,溶解度变化不显著(P>0.05),H2O2浓度1 mmol/L,溶解度达到最大值35.22%,较对照组(0 mmol/L H2O2)增加了7.44%,之后随H2O2浓度的增加,肌原纤维蛋白溶解度显著降低(P<0.05),H2O2浓度20 mmol/L溶解度为28.39%,较对照组降低了13.39%。

图6 羟自由基氧化后牛肌原纤维蛋白溶解度的变化Fig. 6 Change in solubility of myofibrillar protein after oxidation by hydroxyl radical
2.8 羟自由基氧化对牛肌原纤维蛋白浊度的影响

图7 羟自由基氧化后牛肌原纤维蛋白浊度的变化Fig. 7 Change in myofibrillar protein turbidity after oxidation by hydroxyl radical
蛋白溶液加热后的浊度水平通常用于衡量肌原纤维蛋白热诱导聚集的变化情况[6]。由图7可知,不同氧化程度下,蛋白浊度均在40 ℃显著降低(P<0.05),这可能是由于蛋白质分子展开而导致浊度下降[23],随后浊度随温度升高呈上升趋势(P<0.05),这可能是由于肌原纤维蛋白的分子内和分子间相互作用会增强聚集[24]。30 ℃时,20 mmol/L H2O2组蛋白浊度较对照组增加了78.81%,80 ℃时,20 mmol/L H2O2组蛋白浊度增加了1.29 倍。在同一温度下,蛋白质氧化程度越大,浊度越高。以上结果说明氧化会导致肌原纤维蛋白变性,增强蛋白的聚集行为,导致蛋白质浊度增加。
2.9 羟自由基氧化对牛肌原纤维蛋白乳化性能的影响
蛋白质乳化性质一般用EAI和ESI评价,反映了蛋白质形成乳化体系及其稳定乳化体系的能力[5]。如图8所示,随H2O2浓度的增加,EAI和ESI都呈先上升后下降的趋势(P<0.05),当H2O2浓度为1 mmol/L时,EAI和ESI均达到最大,分别为18.33 m2/g和31.95%,较对照组分别增加38.13%和20.66%,H2O2浓度20 mmol/L,EAI和ESI分别为8.74 m2/g和20.02%,分别较对照组降低34.18%和24.41%,这说明羟自由基攻击引起的氧化严重影响了牛肌原纤维蛋白的乳化性能。
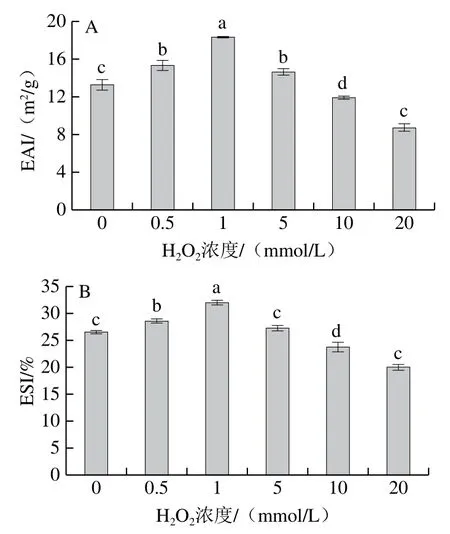
图8 羟自由基氧化后牛肌原纤维蛋白EAI(A)和ESI(B)的变化Fig. 8 Change in emulsification properties of myofibrillar protein after oxidation by hydroxyl radical
2.10 各指标间的相关性分析

表2 各指标间的Pearson相关性Table 2 Pearson correlation coefficients between all indicators tested
通过对牛肌原纤维蛋白在氧化过程中各指标之间进行Pearson相关性分析(表2)发现,牛肌原纤维蛋白在氧化过程中,羰基含量与二聚酪氨酸含量(r=0.989,P<0.01)、表面疏水性(r=0.988,P<0.01)、β-折叠相对含量(r=0.992,P<0.01)、浊度(r=0.976,P<0.01)、无规卷曲相对含量(r=0.361,P>0.05)呈正相关,与其他指标呈负相关。羰基含量是蛋白质氧化的重要指标之一,羰基含量与各指标之间均有相关性,表明羟自由基氧化对肌原纤维蛋白的结构与功能特性均有影响。表面疏水性与浊度(r=0.976,P<0.01)呈极显著正相关,与溶解度(r=-0.783,P<0.01)、EAI(r=-0.623,P<0.01)和ESI(r=-0.680,P<0.01)呈极显著负相关;α-螺旋相对含量与浊度(r=-0.988,P<0.01)呈极显著负相关,与溶解度(r=0.765,P<0.01)、EAI(r=0.658,P<0.01)和ESI(r=0.721,P<0.01)呈极显著正相关;β-折叠相对含量和与浊度(r=0.993,P<0.01)呈极显著正相关,与溶解度(r=-0.778,P<0.01)、EAI(r=-0.680,P<0.01)和ESI(r=-0.683,P<0.01)呈极显著负相关,表明蛋白质结构变化与乳化性质之间有密切联系。
3 讨 论
羰基主要通过氨基酸侧链的直接氧化、与还原糖的非酶羰基反应、与非蛋白糖基化化合物的结合以及多肽链的氧化断裂产生,是蛋白质最重要的表征模式[25]。本研究发现,在Fenton氧化体系中,随H2O2浓度的增加,羰基含量逐渐增加,这表明随H2O2浓度的增加肌原纤维蛋白氧化程度加剧。崔文斌等[8]的研究指出,牦牛肉在4 ℃氧化24 h后,羰基含量随H2O2浓度的增加呈上升趋势,这与本实验结果一致。扶庆权[26]采用Fenton氧化体系模拟鲜肉氧化得出相同结论。巯基的丢失也是肉与肉制品中蛋白质氧化的标志[27]。本研究发现,总巯基和游离巯基含量都随H2O2浓度的增加逐渐降低,可能是因为肌原纤维蛋白中的巯基氧化形成多肽分子间或分子内二硫键,或进一步氧化成磺酸类或其他氧化产物,从而导致巯基含量的下降[8]。另有研究表明,在自由基氧化体系中,酪氨酸极易被自由基攻击产生酪氨酸自由基和酪氨酸残基,形成二聚酪氨酸,因此二聚酪氨酸的含量变化也被用于研究蛋白质氧化的程度[25]。本实验中,随氧化剂浓度的增加,二聚酪氨酸的含量显著增加,这与赵冰等[28]在不同浓度H2O2氧化体系中肌原纤维蛋白氧化的研究结果类似,表明随H2O2浓度的增加,产生较多的羟自由基,使氨基酸侧链被攻击的几率变大,进而形成更多的酪氨酸自由基和酪氨酸残基,这些自由基和残基通过共价键与非共价键作用形成二聚酪氨酸[23]。
表面疏水性是蛋白质变性和水解的良好标志[29]。本研究发现,表面疏水性与羰基含量呈极显著正相关,表明随氧化程度的增加蛋白质表面疏水性呈上升趋势,这与Shen Hui[17]和Cao Yungang[30]等的研究结果类似。Estévez[20]提出表面疏水性的增加可能是因为氧化损伤诱导肌原纤维蛋白部分解折叠,从而暴露了埋藏于蛋白质分子内部的疏水性氨基酸。此外,氧化应激下某些肽的裂解也可能导致蛋白质表面疏水性的增强[31]。蛋白质二级结构主要通过骨架上羰基和酰胺基团之间形成的氢键维持,氢键是稳定二级结构的主要作用力,二级结构主要由α-螺旋、β-折叠、β-转角和无规卷曲4 种构象组成[12]。本研究结果表明,随氧化程度的增加,α-螺旋和β-转角相对含量呈下降趋势,β-折叠和无规卷曲相对含量呈上升趋势,表明氧化对蛋白质二级结构有影响。α-螺旋相对含量下降和β-折叠相对含量增加的原因是羟自由基通过削弱氢键改变蛋白质的二级结构,α-螺旋逐渐展开,多肽链重排形成β-折叠[32]。张海璐等[33]对羊肉中肌原纤维蛋白采用不同程度的体外模拟氧化,发现随氧化程度的增加,α-螺旋逐渐降低,与本实验结果一致。相关性分析发现,表面疏水性与α-螺旋和β-折叠相对含量极显著相关,表明蛋白质表面疏水性的增加与蛋白质二级结构的变化有关。Morzel等[25]指出氧化可能导致蛋白二级结构改变,导致溶液中极性和非极性基团数量的改变,因此可能增加表面疏水性。另有报道称氧化使埋藏在分子内部的疏水基团暴露,导致分子内氢键减少,使蛋白二级结构发生改变[4]。此外,Xiong Youling等[11]研究发现二级结构中α-螺旋和β-折叠的转变可能对牦牛肌原纤维蛋白的功能特性有影响。此外,张丽等[7]发现二级结构大多数指标与溶解度、浊度和乳化特性相关性显著。这与本研究中相关性分析结果类似,表明氧化导致的结构变化对其乳化特性等功能性质有影响。
SDS-PAGE图谱显示在不同氧化强度下蛋白质的交联聚集和降解情况[11],蛋白质发生降解主要表现为蛋白质条带的模糊、弱化和扩展[34],这表明氧化在一定程度对蛋白质的交联降解有影响。本研究发现随H2O2浓度的增加,肌球蛋白重链和肌球蛋白轻链条带灰度逐渐变浅,说明随氧化强度的增加,肌球蛋白发生交联。肌动蛋白条带灰度在0.5~1 mmol/L H2O2时稍有减弱,这说明与肌球蛋白相比,氧化对肌动蛋白的影响较小。Zhang Dong等[35]对不同氧化强度的猪肌原纤维蛋白进行SDS-PAGE分析发现,肌球蛋白重链和肌动蛋白条带灰度随氧化程度的增加逐渐变浅。肌球蛋白和肌动球蛋白构成了油滴周围的界面蛋白膜[16],因此氧化诱导肌球蛋白和肌动蛋白的交联可以解释高氧化强度下肌原纤维蛋白EAI和ESI降低的原因。
由于氧化引起的蛋白交联会导致肌原纤维蛋白发生聚集和沉淀,引起溶解度降低和浊度增加[6],因此溶解度和浊度都可以表征蛋白质聚集的程度[36]。本研究发现,随H2O2浓度的升高和氧化强度的增加,肌原纤维蛋白的溶解度呈先上升后下降的趋势,浊度呈先减小后增加的趋势。Zhang Dong等[35]得出类似结论。Estévez[20]指出轻微的氧化可能会导致蛋白质的部分解折叠,使肌原纤维蛋白的溶解度升高,浊度降低。之后,随着氧化强度的增加,肌原纤维蛋白的溶解度下降,浊度升高,这可能是因为氧化使蛋白质结构展开,导致分子内疏水性基团暴露,增加了蛋白质分子之间的疏水相互作用,从而导致蛋白质聚集[21]。此外,氧化使蛋白质中的巯基转化为二硫键,导致蛋白质聚集,也是溶解度降低和浊度增加的原因[37]。
肌原纤维蛋白是良好的乳化剂,因为其具有两亲性结构,可以降低液滴表面张力并稳定系统[38]。本研究发现,随氧化程度的增加,EAI和ESI都呈先上升后下降的趋势,表明适度氧化对肌原纤维蛋白的乳化性能产生有利影响,而过度氧化则会破坏肌原纤维蛋白的乳化特性。低强度氧化会诱导肌原纤维蛋白构象发生改变,蛋白质部分解折叠暴露出较多的疏水基团,使肌原纤维蛋白在形成乳液的过程中能更好地吸附在油-水界面,从而有效提升蛋白溶液的乳化活性和乳化稳定性[39]。李艳青[6]研究发现,在Fenton氧化体系中,氧化引起氨基酸侧链改变,使蛋白质发生变性,导致蛋白聚集体产生,蛋白不能形成稳定的界面膜,从而使其乳化活性和乳化稳定性下降,并指出EAI和ESI与溶解度呈正相关,这与本研究结果一致,即蛋白质溶解度越低,乳化活性和乳化稳定性也相对越低,这可能是因为蛋白质在发挥乳化作用前需先溶解并转移到表面[40]。相关性分析发现,EAI和ESI与表面疏水性和β-折叠相对含量呈显著负相关,这与Sun Weizheng等[4]的结论相似,这可能是由于高强度氧化诱导表面疏水性和β-折叠相对含量的增加,造成表面活性和蛋白质分子表面作用力减弱,导致界面蛋白膜的黏度降低,乳液液滴间通过疏水相互作用的排斥力增加,从而导致乳液稳定性下降[41-42]。
4 结 论
本实验研究了不同氧化强度下,牛肌原纤维蛋白理化特性、结构以及乳化性能的变化及其内在联系。结果表明:随H2O2浓度的增加,羰基含量和二聚酪氨酸含量逐渐增加,总巯基和游离巯基含量下降,表明随H2O2浓度的增加肌原纤维蛋白的氧化程度加剧。随氧化程度的增加,表面疏水性和α-螺旋相对含量呈上升趋势,β-折叠相对含量呈下降趋势。SDS-PAGE结果表明氧化诱导蛋白质产生交联。溶解度、EAI和ESI都随氧化程度的增加呈先上升后下降的趋势,浊度呈先减小后增加的趋势。相关性结果表明氧化诱导的蛋白质结构变化对肌原纤维蛋白的乳化性能有影响。综上所述,Fenton氧化体系中产生的羟自由基能够显著促进肌原纤维蛋白的氧化,导致其结构发生改变,进而影响其乳化性能,因此有必要根据肌原纤维蛋白的氧化特性和结构变化,实施相应的调控方案控制蛋白质氧化,减少肉品在贮藏与加工过程中的损失。

