敲低DR5表达对rmhTRAIL联合5-FU干预结肠癌细胞增殖及凋亡的影响
孙同友,周硕,梁秀军,武慧杰,廉蕊
1 承德市中心医院放化疗科,河北 承德 067000;2 承德医学院研究生院;3 承德医学院基础医学研究所
结直肠癌(CRC)是人类最常见的恶性肿瘤之一,每年有超过60 万人死于CRC[1]。5-氟尿嘧啶(5-FU)一直是中晚期CRC 的化疗用药,但肿瘤细胞耐药和不良反应在一定程度上限制了5-FU 应用。肿瘤坏死因子相关凋亡诱导配体(TRAIL)通过与死亡受体结合选择性诱导肿瘤细胞凋亡,而对正常组织和细胞无明显毒性[2]。但系统注射后,TRAIL 的半衰期过短[3]。此外,约50%的肿瘤细胞株对TRAIL不敏感,从而限制了TRAIL 的临床应用。重组变构人TRAIL(mhTRAIL)是由野生型TRAIL变构优化而来,其性能更优[4]。我们课题组前期研究结果显示,rmhTRAIL 与5-FU联合在CRC中显示出良好抗肿瘤作用,5-FU 能够通过上调HCT116 细胞表面死亡受体5(DR5)表达增强rmhTRAIL 的敏感性[5]。TRAIL受体包括DR4、DR5、诱骗受体1(DcR1)、DcR2 和一个被称为骨保护素(OPG)的可溶性受体[5],DR5 作为TRAIL 的特异性受体之一,具有传导凋亡信号引起细胞凋亡的功能。为了明确DR5 对rmhTRAIL 以及其与5-FU 联合抗肿瘤的重要性,本研究选用人CRC细胞HCT116,观察敲低DR5表达后,rmhTRAIL单药及其与5-FU 联用对细胞增殖及凋亡的影响,以及对凋亡信号通路中相关蛋白表达的影响,进一步阐明其抗结直肠癌作用的机制。
1 材料与方法
1.1 材料 rmhTRAIL由北京沙东生物技术有限公司馈赠;5-FU 购自上海旭东海普药业有限公司;人CRC 细胞HCT116 由美国哥伦比亚大学惠赠;流式细胞Annexin VFITC/PI 双染凋亡检测试剂盒(联科生物技术股份有限公司);MTS(美国Promega公司);鼠抗Caspase-3 单克隆抗体、鼠抗Caspase-8 单克隆抗体、兔抗DR5 抗体、兔抗Caspase-9 抗体、鼠抗βactin 抗体(美国CST 公司);辣根过氧化物酶标记的羊抗兔IgG、辣根过氧化物酶标记的羊抗鼠IgG(美国Proteintech Group 公司);BCA蛋白定量试剂盒(美国Pierces 公司);1640 培养液(Gibco)、PBS 缓冲液(HyClone);FBS(胎牛血清,Gibco)、0.25%含EDTA胰酶(Sigma)。DR5 shRNA 质粒、Control shRNA 质粒(美国Santa Cruz公司);嘌呤霉素(美国Santa Cruz公司)。
1.2 细胞培养 人CRC 细胞HCT116,为单层贴壁生长细胞,用完全1640 培养基培养。将HCT116 细胞置于37 ℃、5% CO2恒温培养箱内进行培养,隔2~3 d传代1次,细胞消化液为含EDTA的0.25%胰酶溶液。
1.3 质粒转染 选取处于对数期生长的HCT116细胞,按浓度2×105/mL 接种于35 mm 培养皿中,分为空白对照组、Control shRNA 组和DR5 shRNA 组,按照转染试剂说明书进行转染,转染48 h后,用含不同浓度嘌呤霉素的新鲜培养基进行抗性筛选,最终选取2µg/mL嘌呤霉素作为稳定转染细胞的筛选浓度。当转染细胞融合度达80%时,将细胞消化转入培养瓶中进行扩大培养,将稳定转染的细胞分别命名为HCT116/Control shRNA(HCT116/Con)细胞和HCT116/DR5 shRNA(HCT116/KD)细胞。Western blotting法验证敲低效果。
1.4 细胞增殖检测 采用MTS 法。①rmhTRAIL或5-FU 单药对细胞增殖的影响:将处于对数生长期的HCT116/Con 细胞和HCT116/KD 细胞,用胰酶消化后制成单细胞悬液,分别按5 000/孔接种于96 孔板,置于37 ℃、5%CO2培养箱中培养。5-FU 的作用浓度分别为1.25、2.5、5、10、20、50、100 µg/mL;rmhTRAIL 的作用浓度分别为1.25、2.5、5、10、50、100 ng/mL,每个浓度均设3 个复孔。作用48 h 后,吸除孔内原培养液,避光条件下加入配制好的MTS溶液,120µL/孔,然后将细胞放入恒温培养箱中继续避光培养3 h,利用酶标仪检测490 nm 波长处各孔的OD 值。根据细胞的生长抑制率分别计算rmhTRAIL 和5-FU 单药处理细胞48 h 时的半数抑制浓度(IC50)。②rmhTRAIL 联合5-FU 对细胞增殖的影响:将HCT116/Con 和HCT116/KD 细胞经胰酶消化后接种于35 mm培养皿中,过夜贴壁后,分为对照组、5-FU 组、rmhTRAIL 组、rmhTRAIL+5-FU 组,根据IC50 值选取5-FU 的浓度为5 µg/mL,rmhTRAIL 的浓度为10 ng/mL,药物处理细胞48 h,MTS法检测细胞增殖情况,方法同上。细胞生长抑制率(%)=(对照组OD 值-实验组OD 值)/对照组OD 值×100%。实验重复3次。
1.5 细胞凋亡检测 将HCT116/Con和HCT116/KD细胞经胰酶消化后接种于35 mm 培养皿中,过夜贴壁后,分为对照组、5-FU 组、rmhTRAIL 组、rmhTRAIL+5-FU 组,5-FU 的浓度为5 µg/mL,rmhTRAIL的浓度为10 ng/mL,药物处理48 h。按照Annexin V-PFITC/PI 双染流式细胞凋亡检测试剂盒说明书对各组细胞处理后染色,流式细胞仪(BD FACSCalibur)测算各组细胞凋亡率,实验重复3 次统计结果。
1.6 凋亡通路相关蛋白表达检测 采用Western blotting 法。将HCT116/KD 细胞分为对照组、5-FU组、rmhTRAIL 组、rmhTRAIL+5-FU 组,药物作用48 h后,PBS 清洗,加入RIPA 裂解液(美国Thermo 公司)充分反应,冰上收取裂解液,12 000 r/min 离心20 min(离心半径10 cm),小心吸取上清,按照BCA蛋白定量试剂盒(中国索莱宝科技有限公司)步骤进行定量,计算总蛋白浓度,加入Loding蛋白变性后进行垂直凝胶电泳,转膜,封闭,4 ℃湿盒内一抗孵育过夜(一抗的稀释浓度:DR5、Caspase-3、Caspase-8、Caspase-9和PARP按1∶1 000稀释,β-actin按1∶2 000稀释),第2 天加二抗(1∶5 000,中国碧云天生物技术有限公司)室温孵育1.5 h,ECL 发光显影,用全自动化学发光成像分析系统曝光扫描,应用Image J软件对蛋白条带进行分析、测量灰度值,实验重复3 次。
1.7 统计学方法 采用SPSS21.0 统计软件。符合正态分布计量资料以-x±s表示,两组间比较采用两样本均数t检验,多组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 DR5蛋白在稳定转染细胞株中的表达 HCT116、HCT116/Con、HCT116/KD 细胞中DR5 的相对表达量分别为1.01 ± 0.16、0.86 ± 0.17、0.04 ± 0.00,HCT116/KD 细胞中DR5 表达低于HCT116 亲本株和HCT116/Con 细胞,且敲低效果达90%以上,差异有统计学意义(P均<0.05)。证实敲低DR5 表达的稳定转染细胞株构建成功。
2.2 敲低DR5 表达对CRC 细胞药物敏感性的影响
2.2.1 敲低DR5 表达后rmhTRAIL 及5-FU 单药对CRC 细胞增殖的影响 不同浓度的rmhTRAIL 作用于细胞时,在各浓度组,HCT116/KD细胞的生长抑制率低于HCT116/Con 细胞,差异均有统计学意义(P均<0.05),随着药物浓度升高,细胞生长抑制率增加趋势不如HCT116/Con细胞明显;而单用不同浓度的5-FU 作用于细胞时,在各浓度组,HCT116/KD 细胞与HCT116/Con 细胞的生长抑制率无统计学差异(P均>0.05)。单药rmhTRAIL 对HCT116/KD 细胞的IC50值高于HCT116/Con 细胞,分别为(65.76 ±4.65)、(5.16±0.12)ng/mL,差异有统计学意义(P<0.05);而单药5-FU 对HCT116/KD 细胞和HCT116/Con细胞的IC50值相比差异无统计学意义(P>0.05),分别为(6.09±0.12)、(6.13±0.63)ng/mL。见表1、2。
表1 敲低DR5表达后不同浓度5-FU作用于细胞的抑制率比较(%,±s)
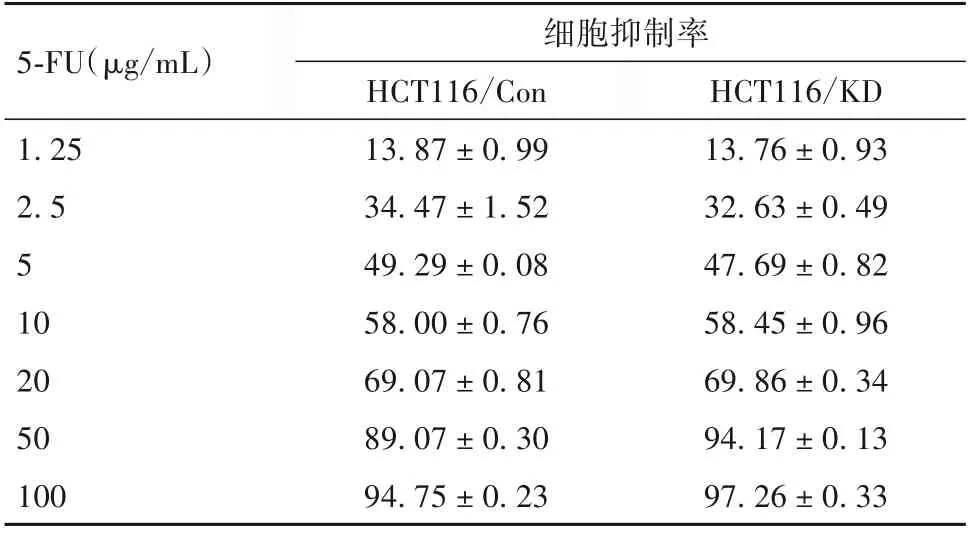
表1 敲低DR5表达后不同浓度5-FU作用于细胞的抑制率比较(%,±s)
5-FU(µg/mL)1.25 2.5 5 10 20 50 100细胞抑制率HCT116/Con 13.87±0.99 34.47±1.52 49.29±0.08 58.00±0.76 69.07±0.81 89.07±0.30 94.75±0.23 HCT116/KD 13.76±0.93 32.63±0.49 47.69±0.82 58.45±0.96 69.86±0.34 94.17±0.13 97.26±0.33
2.2.2 rmhTRAIL与5-FU联合作用于CRC HCT116细胞,MTS 结果显示,rmhTRAIL 与5-FU 联合作用于HCT116/KD 细胞的增殖抑制率为(56.70 ±1.33)%,低于HCT116/Con细胞的(78.67±0.94)%,差异有统计学意义(t=23.338,P<0.01)。
表2 敲低DR5表达后不同浓度rmhTRAIL作用于细胞的抑制率比较(%,±s)
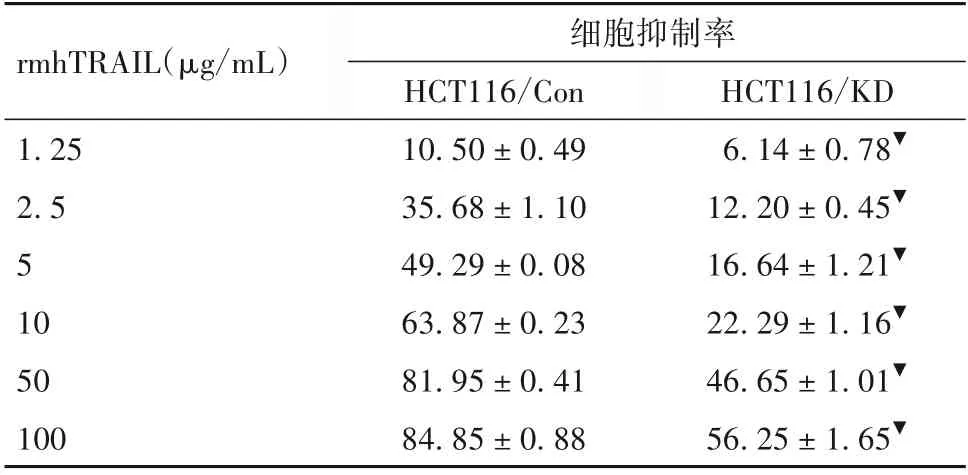
表2 敲低DR5表达后不同浓度rmhTRAIL作用于细胞的抑制率比较(%,±s)
注:与HCT116/Con相比,▼P<0.01。
rmhTRAIL(µg/mL)1.25 2.5 5 10 50 100细胞抑制率HCT116/Con 10.50±0.49 35.68±1.10 49.29±0.08 63.87±0.23 81.95±0.41 84.85±0.88 HCT116/KD 6.14±0.78▼12.20±0.45▼16.64±1.21▼22.29±1.16▼46.65±1.01▼56.25±1.65▼
2.3 敲低DR5 表达对CRC 细胞凋亡的影响rmhTRAIL 单药分别作用于HCT116/Con 细胞和HCT116/KD 细胞,凋亡率分别为(62.12 ± 0.32)%和(10.48 ± 1.16)%,差异有统计学意义(t=74.23,P<0.01);rmhTRAIL 联合5-FU 分别作用于HCT116/Con细胞和HCT116/KD细胞,凋亡率分别为(85.80±0.0.40)%和(13.33±0.13)%,差异有统计学意义(t=296.379,P<0.01)。
2.4 敲低DR5 表达对凋亡通路相关蛋白表达的影响 敲低DR5 后,无论是rmhTRAIL 单药,还是rmhTRAIL 与5-FU 联用,HCT116/KD 细胞中Caspase-3、Caspase-9、PARP 蛋白表达无明显下降(P均>0.05),rmhTRAIL 与5-FU 联合导致Caspase-8 表达略有下降,与对照组比较,差异有统计学意义(P<0.05);PARP 蛋白裂解片段表达有所上升,与对照组比较,差异有统计学意义(P<0.05)。见表3。
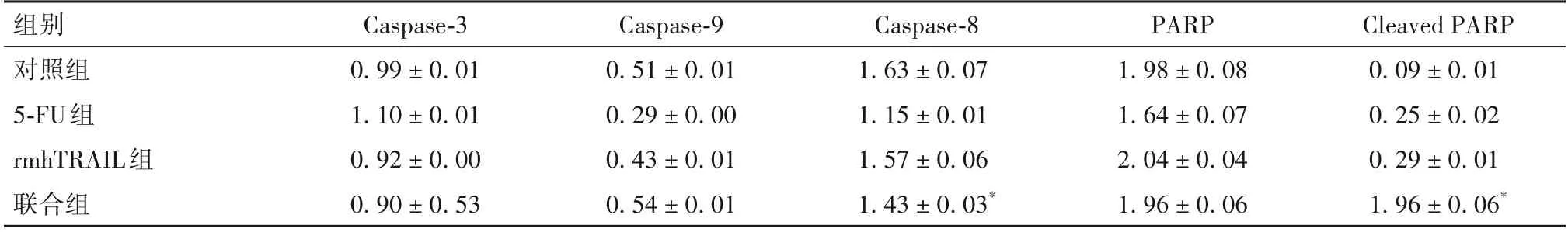
表3 各组稳定转染细胞系中凋亡通路蛋白相对表达量比较(-x±s)
3 讨论
2020 年全球癌症统计数据显示,CRC 的发病率占所有恶性肿瘤发病的第3 位,病死率占第2 位[6]。手术结合放化疗的综合治疗使非转移性CRC 患者的生存获得了稳定改善,尽管如此,仍有超过40%的患者会发生远处转移[7]。抑制肿瘤血管生成在恶性肿瘤的治疗中取得了较好疗效,但是在CRC 中却进展缓慢。近几年,免疫治疗开启了恶性肿瘤治疗的新篇章,在有MSI-H/dMMR 的转移性CRC(mCRC)中,免疫治疗的疗效较化疗或化疗联合靶向治疗显著提高[8],然而,仅有约5%的mCRC 患者表现为MSI-H/dMMR,而不伴有MSI-H/dMMR的mCRC 对免疫治疗反应性仍较差,因此,寻找新的有效治疗CRC药物或策略迫在眉睫。
mhTRAIL 是北京沙东生物公司开发并具有独立知识产权的新型制剂,属于Ⅰ类新生物制品,其在溶解性、稳定性、半衰期及安全性方面均优于野生型TRAIL,在基础以及临床试验中均显示出较好抗肿瘤效果[9-10]。目前认为,在哺乳动物中主要存在两条凋亡途径,外源性凋亡途径和内源性凋亡途径,TRAIL 主要通过与其特异性受体DR4 和/或DR5 结合激活外源性凋亡途径而诱导细胞凋亡[11]。在Ⅱ型细胞,外源性凋亡途径激活的Caspase-8可进一步启动内源性凋亡途径来增强TRAIL 诱导细胞凋亡的能力[11-12]。本课题组前期研究结果表明,rmhTRAIL 通过与死亡受体结合导致CRC 细胞发生了Caspase 依赖性凋亡,在HCT116 细胞,5-FU 通过上调DR4 和DR5 的表达增强了rmhTRAIL 诱导细胞凋亡的能力。
DR5 是Ⅰ型跨膜蛋白,具有传导凋亡信号并引起细胞凋亡的功能[13]。有研究显示,在肾癌、肺癌、乳腺癌、前列腺癌及胃癌中,DR5在TRAIL诱导细胞凋亡中发挥了关键作用[14-16]。为了明确DR5 在rmhTRAIL 诱导CRC 细胞凋亡中是否同样发挥关键作用,本研究应用DR5 shRNA 质粒稳定转染CRC HCT116 细胞,Western blotting 实验验证敲低效果,结果显示成功构建了敲低DR5 的稳定转染细胞株HCT116/KD,转染效率在90%以上。
我们前期实验结果显示,rmhTRAIL单药及其与5-FU 联用能明显抑制亲本株HCT116细胞增殖并诱导其凋亡。本研究敲低DR5表达后,MTS结果显示,rmhTRAIL抑制细胞增殖的作用明显减弱,差异有统计学意义;当rmhTRAIL 联合5-FU作用于细胞时,对HCT116/KD 细胞的生长抑制作用低于HCT116/Con细胞,差异有统计学意义。本研究中流式细胞术结果显示,DR5被敲低后,rmhTRAIL单药或者rmhTRAIL联合5-FU 诱导的细胞凋亡减少,与HCT116/Con 组细胞比较差异有统计学意义。以上结果均表明DR5是rmhTRAIL 抑制HCT116 细胞增殖的基础,且DR5 是rmhTRAIL诱导细胞凋亡的关键蛋白。
Caspase 家族蛋白酶在细胞凋亡过程中发挥了关键作用,是细胞凋亡的中心环节,其参与了凋亡启动、信号传导及刺激凋亡效应的发生等过程[17]。因此本研究采用Western blotting 法检测了凋亡通路中相关蛋白表达变化,试图从分子机制上说明DR5 表达的重要性。结果显示,DR5 被敲低后,无论是rmhTRAIL 单药组还是rmhTRAIL 与5-FU 联用,细胞中Caspase-8、Caspase-3、Caspase-9 及PARP蛋白表达无下降或下降不明显,PARP 蛋白裂解片段表达较对照组表达有所升高,差异有统计学意义,而本课题组前期已发表的实验结果显示,在未敲低DR5 的亲本株HCT116 细胞,rmhTRAIL 单药或rmhTRAIL与5-FU联用均导致Caspase-8、Caspase-3、Caspase-9 及PARP 蛋白表达明显下降,PARP 蛋白裂解片段表达显著上升[5]。表明敲低DR5 表达导致凋亡信号传递受阻,即rmhTRAIL 单药及其与5-FU 联用诱导CRC HCT116 细胞凋亡有赖于DR5表达。
综上所述,本研究采用DR5 shRNA 稳定转染CRC 细胞,成功构建稳定转染细胞系,从细胞水平及分子水平证实,DR5 是rmhTRAIL 单药及其与5-FU 联用诱导细胞凋亡的基础。敲低DR5 表达后rmhTRAIL 单药及其联合5-FU 干预HCT116细胞,细胞增殖受抑减弱,凋亡减少。

