JAK2V617F突变真性红细胞增多症及真性红细胞增多症后骨髓纤维化临床特点
李 琳,彭雪扬,李 威,姜中兴
(郑州大学第一附属医院血液科,河南 郑州 450052)
真性红细胞增多症(polycythemia vera, PV)是ph染色体阴性骨髓增殖性疾病[1]中的一种,以骨髓中的红系异常增生为主,临床表现主要为增多的红细胞,伴或不伴白细胞(white blood cell,WBC)及血小板(platelet,PLT)增高,并常有静脉血栓及脾大的发生,发病率为0.67/100 000,中位存活率约为14 a[2-3]。PV患者虽预后较好,但仍有向骨髓纤维化(myelofibrosis, MF)和急性髓系白血病转化的风险,PV患者10 a MF转化率约为4.9%~6%,15 a约为6%~14%,其中MF的转化危险因素主要是>50%的JAK2V617F基因负荷,急性髓系白血病的相关危险因素为高龄、白细胞增多和核型异常[4-6]。与PV相关的最主要基因为JAK2基因,其突变频率在PV中约为95%[2]。在本研究中,我们通过回顾性分析2017年1月至2020年9月郑州大学第一附属医院血液内科收治的92例PV患者的临床资料,探讨JAK2V617F突变与否患者的临床特点差异、预后及治疗,以及真性红细胞增多症后骨髓纤维化(post-polycythemia vera myelofibrosis,post-PV MF)的临床特点。
1 资料与方法
1.1 病例资料将2017年1月至2020年9月郑州大学第一附属医院血液科收治的92例不同年龄段的PV患者纳入本回顾性研究,所有患者均符合2014年国内标准。主要标准:1)男性血红蛋白(haemoglobin,Hb)>165 g/L、女性Hb>160 g/L,或男性红细胞压积>49%、女性红细胞压积>48%;2)骨髓活检示三系高度增生伴多形性巨核细胞;3)有JAK2突变。次要标准:血清促红细胞生成素水平低于正常参考值水平。诊断需符合3条主要标准或1、2条主要标准和次要标准。排除标准:1)排除感染、应用激素、其他血液系统疾病等带来的异常红细胞增多;2)妊娠、其他恶性肿瘤等;3)病例资料不全。所有患者的检查和治疗均按照中国血液专家共识[7],且符合和通过郑州大学第一附属医院伦理审查。
1.2 方法收集并分析92例患者的临床特点(性别、年龄),既往有无高血压、脑梗死、脑出血、糖尿病、冠心病病史,外周血细胞数、凝血指标、部分生化指标、腹部超声、基因学检查、骨穿结果等资料,所有患者均已完善骨髓增殖性肿瘤基因检查。并分析血栓事件与患者临床特点的关系,血栓事件包括脑血栓、双下肢动静脉血栓、胸腹主动脉血栓等,冠心病不纳入血栓事件中。
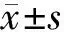
2 结果
2.1 病例特点92例患者中,男44例、女48例,发病年龄21~81岁,中位年龄59.50岁。所有患者中,脑血管病史40例(43.48%),其中脑出血1例、脑血栓或脑梗塞39例;冠心病史12例(13.04%);检测双下肢动静脉血栓的28例,其中静脉血栓的6例(21.43%),静脉血栓患者的中位年龄64.50(55~75)岁,动脉血栓1例(3.57%);完善腹部超声的83例,其中脾大的50例(60.24%)。治疗方法根据不同的患者主要采取了静脉放血、羟基脲、阿司匹林、干扰素及芦可替尼等单纯或联合治疗方式。
2.2 基因突变与年龄、外周血指标、血栓、脾大及预后的关系JAK2V617F阳性患者83例(90.22%)、阴性患者9例(9.78%),不存在CALR及MPL阳性患者。与JAK2V617F阴性组比较,JAK2V617F阳性组患者血小板(platelet,PLT)、中性粒细胞绝对值计数(absolute neutrophil count,ANC)和碱性磷酸酶更高(Z=2.596,P=0.009;Z=2.109,P=0.035;Z=2.167,P=0.030),且年龄更大(χ2=4.434,P=0.035),预后更差(χ2=11.471,P=0.003)。见表1、2。
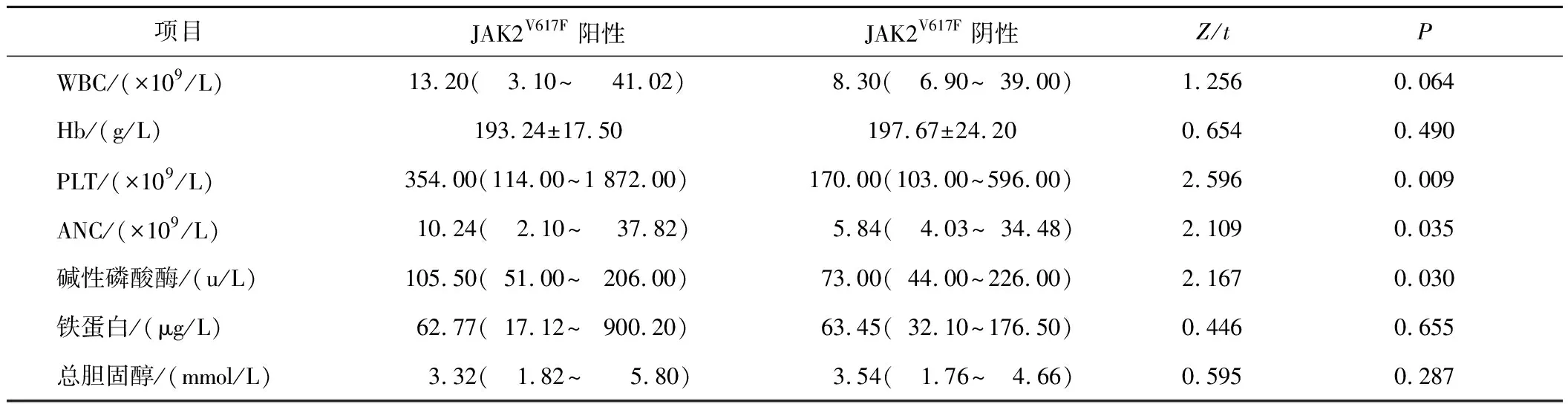
表1 外周血指标和JAK2V617F突变的关系
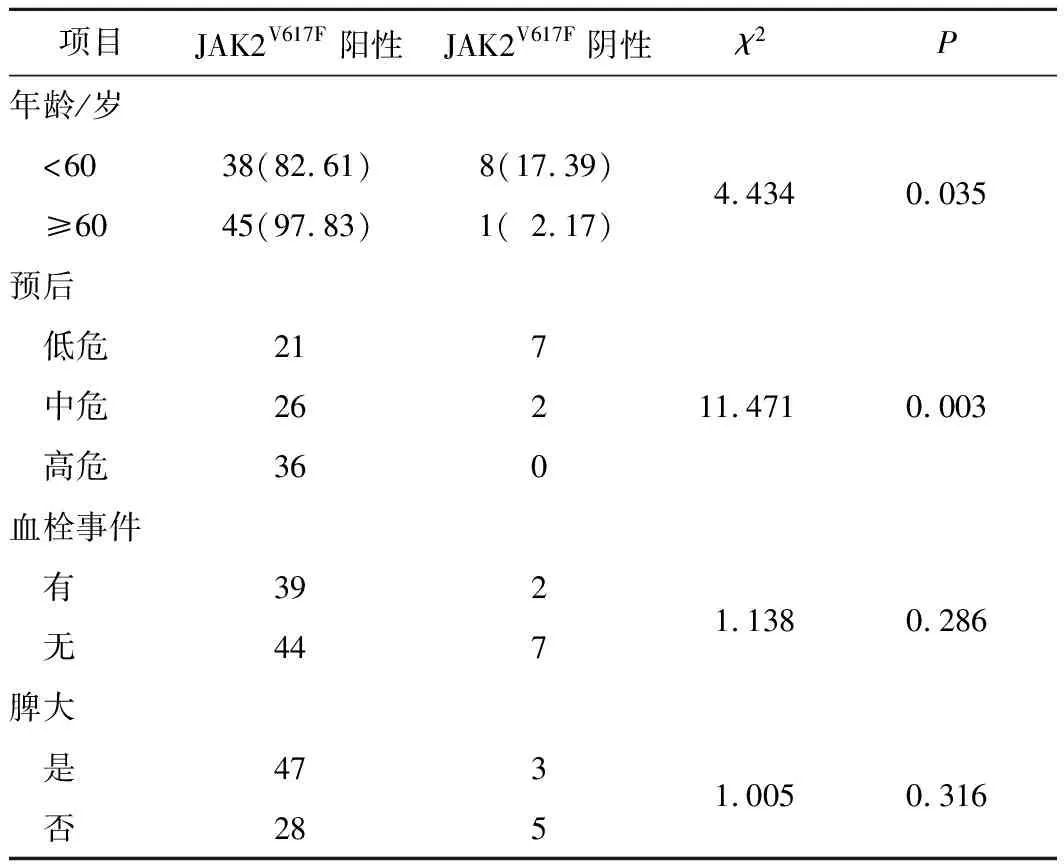
表2 年龄、血栓、脾大、预后和JAK2V617F突变的关系 n(%)
2.3 预后危险因素随访发现有15例患者出现了新的血栓,将性别、既往病史(冠心病、脑血管事件、其他血栓事件)及年龄、WBC计数等纳入Logistic回归分析后,发现只有高WBC、高龄及既往冠心病史均为危险因素(OR=1.242,P<0.001;OR=1.075,P=0.037;OR=5.460,P=0.018)。对年龄、WBC计数进行ROC曲线分析发现,WBC计数具有预测价值,曲线下面积为0.89,此时界限值为17.99×109/L,约登指数为0.70,此时敏感性为80.00%,特异性为89.60%。见图1、表3。
2.4 post-PV MF外周血及骨髓特征92例PV患者中,诊断时即发现post-PV MF的共有10例,其中JAK2V617F阳性患者9例(10.84%),阴性患者1例(11.11%),差异无统计学意义(χ2=1.138,P=0.980)。PLT、血小板分布宽度和甘油三酯用于诊断的曲线下面积分别为0.70、0.80、0.62,能够用来预测post-PV MF,其界限值分别为396×109/L、18.25×109/L及1.64 mmol/L,约登指数分别为0.44、0.52、0.24,敏感性分别为80.00%、60.00%、50.00%,特异性分别为64.10%、92.30%、74.40%。骨髓活检的77例患者中,post-PV MF患者较未发生MF的患者的骨髓活检组织中有更多的造血组织、巨核细胞、更少的脂肪组织及更多的网织纤维(t=1.991,P=0.046;t=2.923,P=0.003;t=2.075,P=0.038;χ2=37.594,P<0.001),可能有助于发现早期的post-PV MF。见图2、表4。
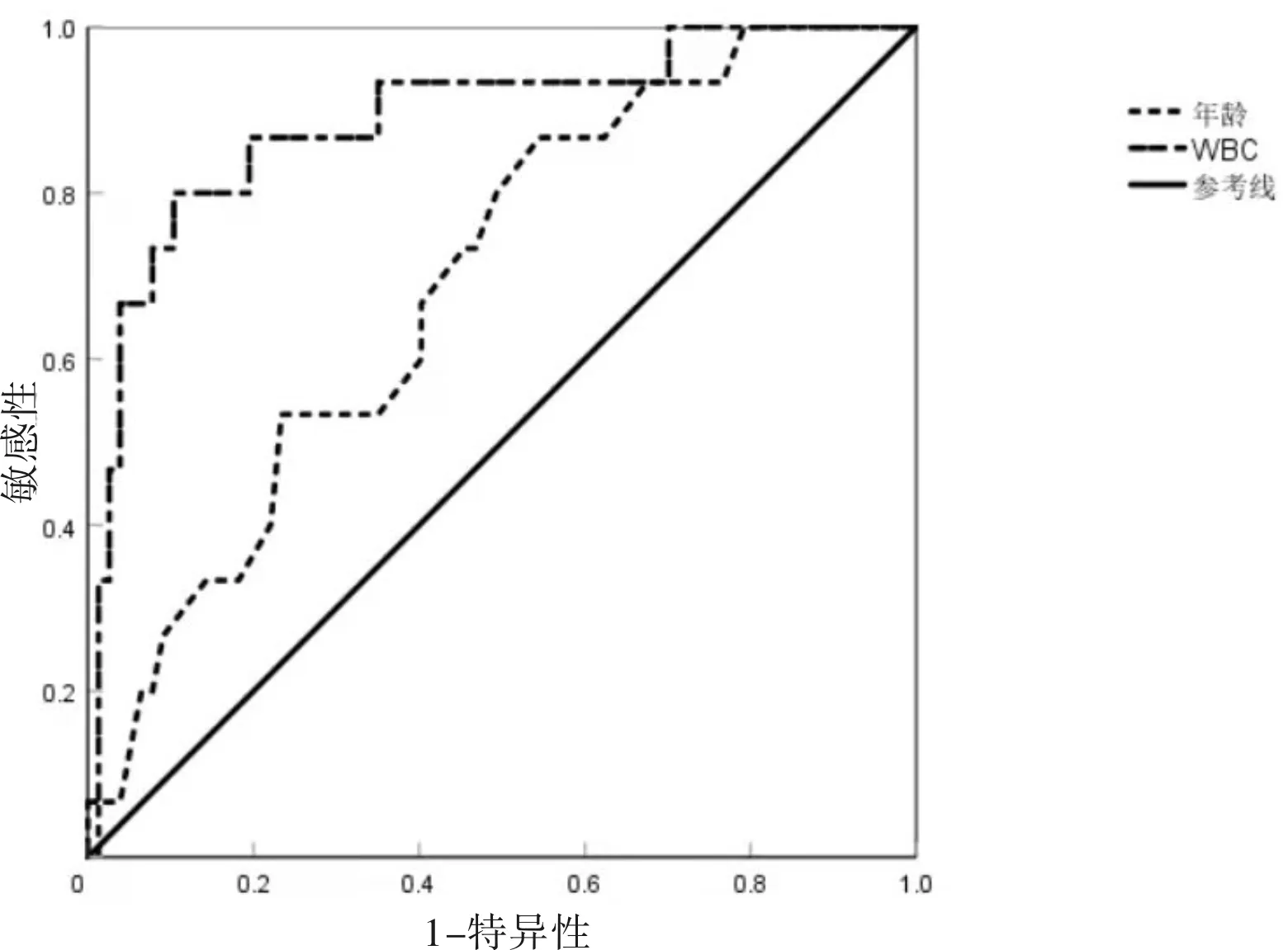
图1 再发血栓事件的ROC曲线

表3 再发血栓事件相关危险因素

图2 post-PV MF患者ROC曲线

表4 post-PV MF患者临床特点及骨髓特点
3 讨论
JAK2基因与关键造血细胞因子受体的细胞质部分密切相关,如促红细胞生成素[8]、血小板生成素和粒细胞集落刺激因子,正常JAK2功能性激活配体结合后的细胞内信号通路。JAK2V617F是第1个被发现的突变基因,是14外显子1849核苷酸G到T体细胞的激活突变导致617密码子处缬氨酸被苯丙氨酸所取代,导致JH2结构域在JH1结构域上正常抑制功能的丧失[9],从而使骨髓细胞过度增殖和活化,后来在JAK/STAT家族又发现了JAK2 exon12的突变,通常与原发性血小板增多症和原发性MF无关,但可进展为MF[10]。JAK2突变在PV中最常见,约为95%,在原发性血小板增多症和原发性MF中的频率约为50%~60%[2],我们的研究中JAK2V617F阳性率与相关文献报道的95%突变率较为接近。
对于JAK2V617F阳性的患者来说,其发生血栓事件的风险较阴性患者更高,且预后更差,这一论点已经在一项对我国1 537例JAK2V617F阳性骨髓增殖性肿瘤患者的血栓形成分析中得到了证实:PV患者血栓形成的风险明显高于原发性血小板增多症或骨髓纤维化患者,并且在伴有JAK2V617F变异等位基因频率≥50%的PV患者中血栓形成的发生率是<50%患者的4.6倍[11]。关于其发生的相关机制主要有两种说法:一是由于克隆造血细胞增殖引起白细胞、红细胞和血小板的异常,使彼此之间发生更频繁的相互作用并激活凝血途径,导致凝血级联的慢性激活;二是涉及骨髓增殖性肿瘤的慢性炎症状态,有研究表明炎症细胞因子可以交叉激活凝血因子并抑制纤维蛋白溶解途径,还可以导致血管损伤从而增加凝血趋势[12]。对于出血事件,其发生率往往低于血栓事件的发生率,大多与获得性血管性血友病综合征、血小板减少症、骨髓增殖性肿瘤相关血栓病和抗血栓药物的使用有关[13-14]。同时有研究发现JAK2V617F阳性组有着更高的WBC、Hb及PLT水平,而铁蛋白、胆固醇水平较低[15],关于血细胞较高我们考虑是由于JAK2基因突变引起的骨髓增殖,而至于铁蛋白和胆固醇在阳性组中更低,可能是由于PV患者中存在慢性炎症,而慢性炎症又是导致持续缺铁的复杂机制的重要部分[16],至于胆固醇可能是由于其促进肿瘤细胞生长,从而导致了血浆胆固醇减少[17];而在我们的研究中,发现JAK2V617F基因突变的患者有着更高的PLT计数和更差的预后分层,符合已知文献描述,可以对PV患者预后进行预测,但在WBC、Hb、铁蛋白、总胆固醇及血栓方面并未得出显著差异,考虑可能是由于年轻患者较多,而年轻患者较老年患者各项指标较好,JAK2基因阳性率又较低,从而导致整体数据出现差异。
PV患者预后的危险因素被定义为年龄较大、WBC增多、既往血栓形成和多基因突变[18],在这里我们对除JAK2以外的基因不做讨论。在最近的一项研究中,发现年龄≥60岁被确定为静脉血栓形成的主要危险因素[19],同时有研究发现PV患者中WBC增多与动脉血栓形成的联系[20]。而另一项研究则表明,在PV患者中,WBC计数的持续增高与血栓形成之间没有明显关系,但与疾病演化的危险性显著相关,并同时证明了血红蛋白及血小板与血栓形成或疾病进化的危险性没有显著关系[21]。此外,心血管风险因素与PV预后相关也得到了证明[22]。在本研究中,我们的数据显示高龄及高WBC(我们预测当WBC超过17.99 109/L时)及既往冠心病史为预后再发血栓的危险因素,但在Hb及PLT是否有危险性上尚不能判断,而包括高血压、糖尿病史等在内的心血管危险因素也并没有得到相关性证明,考虑是由于该类病史未得到患者重视有所遗漏造成。由于本研究的样本量较小,所以结果可能不够严谨,但考虑到该类患者数量较少,且结果具有一定可解释性,仍然在此进行说明,但该结果的可靠性仍需进一步扩大样本进行验证。
根据相关文献,我们知道高龄(≥60岁)和高WBC同样也是post PV-MF的危险因素,还有其他危险因素,如JAK2V617F等位基因负荷、脾肿大、PLT减少和贫血[3,18,23-25],且一旦转化为post PV-MF,中位生存期显著缩短至5.7 a[3],而在骨髓活检中,骨髓网硬蛋白纤维则为主要危险因素[26],常伴随红系、粒系、巨核组织增多[27]。在一项对中国272例PV患者MF转化的研究中发现,脾大的患者可能更容易发生post PV-MF[28]。我们都知道,由于JAK-STAT通路激活,骨髓细胞过度增殖从而导致髓外浸润的出现,即伴随脾肿大发生,并且该通路的异常活化可以通过调节血小板生长因子、成纤维细胞生长因子等促进血管平滑肌细胞和成纤维细胞增殖、迁移,也可以使粒细胞和巨核细胞增生,改变骨髓微环境中造血细胞和基质细胞之间的相互作用进而引起MF的发生、发展[29-30]。也就是说,由于JAK-STAT通路的作用,发生脾大的PV患者转化为MF的可能性更高。
我们的研究发现,发生MF的患者较未发生的患者有着更高的PLT、PDW及甘油三酯,并且可以用来预测post-PV MF;发生MF的患者骨髓活检组织中有更多的造血组织、巨核细胞及更少的脂肪组织,并且网硬蛋白纤维程度也与之相关,这个发现可能也可以用来评估患者的预后。与之前报道不一致的是,我们发现JAK2基因是否突变与脾大没有关系,分析原因,可能是本研究post-PV MF患者数量较少,未来我们将进一步进行随访,扩大样本量从而完善相关分析验证以上结果,同时也有必要多中心回顾性分析去验证JAK2突变与脾大的关系。
综上所述,在研究JAK2V617F基因对PV患者的影响时,我们得出基因突变的患者可能有着更高的PLT计数、ANC及碱性磷酸酶,且年龄更大,预后较阴性患者更差;预后再发血栓事件中,高WBC、高龄及既往冠心病史均为危险因素;post-PV MF患者有更高的PLT、PDW及甘油三酯,界限值分别为396×109/L、18.25×109/L及1.64 mmol/L,但WBC、Hb、PLT等其他外周血指标则没有意义,且活检组织中有更多的造血组织、巨核细胞及更少的脂肪组织。临床特征及骨髓穿刺结果可能在一定程度上可以预测PV患者的预后及进展,因此我们应当重视患者的详细检查并在治疗中对骨髓的缓解有更多的关注,尽管我们的结果并不那么完美,但依然可以使我们在今后的临床工作中有更多新的思考。

