利用MiSeq技术研究调味面制食品中优势菌群及细菌多样性分析
谭艳妮,施法,李欣蔚,李勇,张健,孙佳星,韩世宁,刘宏生
(1.辽宁大学 生命科学院,沈阳 110036;2.沈阳市市场监管事务服务与行政执法中心,沈阳食品药品检验所,沈阳 110136;3.辽宁省粮食科学研究所,沈阳 110032;4.辽宁省生物大分子模拟计算与信息处理工程研究中心,沈阳 110036)
调味面制食品,俗称“辣条”、“面筋”、“素牛筋”,主要消费群体是青少年儿童,特别是中小学生[1],年销售额可高达500亿元。它的主要原料是小麦粉,经配料食盐、食糖、麻辣香辛料以及食品添加剂,通过食品加工机械挤压、膨胀、蒸煮、成型、调味、包装等工艺后制成的一种常见的即食方便食品[2-3]。据悉,2015年5月国家食药监总局发布了关于严格加强调味面制品等休闲食品监管工作的通知。总局通过组织专项监测发现,调味面制品普遍存在食品添加剂超范围、超限量使用,微生物指示菌菌落总数也极易超高超标[4-5]。
长期以来,传统的微生物菌群多样性研究主要面临耗时长、分离鉴定工作量较大等问题[6-8],还有某些特定种群的微生物无法通过传统的手段分离纯化并培养出来[9],令研究成果产生较大的偏差。
高通量宏基因组测序技术,是研究微生物菌群结构多样性的革命性技术,通过直接对样品中微生物总的DNA进行提取测序,客观地反映样品中低丰度和不可培养的微生物。检测样品类别包括食品[10]、医药[11]、环境[12]、土壤样品[13]、含菌空气、植物果实、动物粪便[14-18]等,检测结果准确快速。其中二代测序以Illumina MiSeq平台应用最为广泛[19],微生物菌群结构多样性分析主要选择合适的测序平台和测序区域。16S rDNA被认为是细菌分类研究和鉴定的指标,通常作为“分子钟”,16S rDNA 扩增子测序是对高变区进行测序分析和菌种鉴定,其序列包含9个可变区(variable region)和10个保守区(constant region)。可变区因微生物而异,不同的可变区域,分析微生物的能力也不同。目前已涉及一个可变区(V3、V4、V6),两个可变区(V1-V2、V3-V4、V4-V5),以及3个可变区(V1-V3、V3-V5、V4-V6)。因此,可根据研究选择特定的可变区域进行PCR扩增,通过检测目的区域的序列变异和丰度,对特定样本中微生物种群结构多样性等方面进行分析比较和研究。
本文采用目前国标方法中的均质拍击取样法,选择Illumina MiSeq测序平台以及可变区域V3-V4进行测序,分析调味面制品中细菌多样性,以及对未来改进加工工艺和控制微生物污染以及调味面制食品新国标的拟定提供基础数据信息。
1 材料与方法
1.1 试验材料
采用随机抽样方式,于沈阳市学校周边小食店选购调味面制食品1(样品规格28 g,产地沈阳市)、2(样品规格26 g,产地重庆市)、4(样品规格30 g,产地广州市)。均为预包装食品,来自不同产地相同的流通环节,并且存放条件相同。由于调味面制品国标缺失,样品均执行企业标准,购买后保证样品存储条件符合要求,并在保质期内对样品进行检验。
1.2 仪器与设备
拍击式均质机;恒温水浴锅;涡旋振荡器;Eppendorf 5417R冷冻台式高速离心机、BioPhotometer Plus核酸蛋白测定仪 德国艾本德公司;Model 200/2.0 Power Supply水平电泳仪、Bio-Rad S1000聚合酶链式反应仪、Versa Doc凝胶成像仪 美国Bio-Rad公司。
1.3 试验方法
1.3.1 样品预处理
称取25 g样品置于盛有225 mL生理盐水的无菌均质袋内,使用拍击式均质拍打1 min,制成1∶10的样品匀液。静置后,吸取上清液40 mL于离心管内,2000 r/min离心10 min,去样品杂质沉淀;再吸取上清液20 mL,12000 r/min离心5 min,缓慢弃去上清,获得菌体沉淀。每个样品均设3个平行,样品编号分别为1号、2号和4号。
1.3.2 提取样品基因组DNA
使用细菌基因组DNA快速提取试剂盒(Bacterial DNA Kit,Omega Bio-Tek公司),根据说明书进行细菌总基因组DNA的提取。提取后,检测DNA提取的浓度,并利用1%琼脂糖凝胶电泳检测菌体DNA的完整性。
1.3.3 MiSeq高通量测序
9. D词义辨析。A.副词,太,也。B. 副词,如此的;连词,因此。C. 副词,非常,很;形容词,恰好是,十足的。D. 形容词,如此的。结合语境可知此处指的是,你是如此了不起的一位父亲,故选D。
在大量数据分析中16S rDNA包含高度保守、中度保守和高度变化的序列区域,大小适中,与全长序列测序相比较足以体现不同菌属之间的差异,同时可降低成本,提高效率。故采用细菌16S rDNA可变区域V3-V4通用引物:
正向引物为341F(5′-CCTACGGGNGGCWGCAG-3′),
反向引物为805R(5′-GACTACHVGGGTATCTAATCC-3′)。
PCR反应体系:15 μL 2×Taq Master Mix,1 μL Primer F,1 μL Primer R,20 ng DNA模版,加入ddH2O至30 μL。PCR反应条件:94 ℃预变性3 min,94 ℃变性20 s,55 ℃延伸20 s,72 ℃退火30 s,25个循环,72 ℃延伸5 min。
1%琼脂糖凝胶电泳检测PCR产物,等浓度混样,使用胶回收试剂盒回收纯化产物,用于Illumina MiSeq PE250上机测序。
1.3.4 数据分析
为了更加准确地分析测序得到的数据,去除干扰数据,首先根据Barcode将下机数据(raw data)拆分为不同样品数据,并截去Barcode序列和PCR扩增引物序列,利用Flash软件进行过滤拼接,得到高质量的有效数据[20-23]。并对上述数据也就是Effective Tags进行操作分类单元(operational taxonomic units,OTUs)聚类分析(相似性97%)[24]。
本次研究中主要针对的是细菌分析,将OTUs代表序列用RDP Classifier(Version 2.2,http://sourceforge.net/projects/rdp-classifier/)[25]与Greengene 数据库 (http://greengenes.lbl.gov/)[26]进行物种注释分析,得到相应的物种及物种丰度信息。
同时计算Chao1指数、ACE指数、Shannon指数、Simpson指数以评估α-多样性(Alpha diversity),用丰度分布曲线(OTU rank curve)评价丰度及均度,用Venn图展示不同样品间特有以及共有OTUs,绘制微生物菌群分布图和样品聚类图[27]。
2 结果与分析
2.1 测序结果及多样性分析
本试验将3个产地的调味面制品进行了16S rDNA测序,结果见表1。
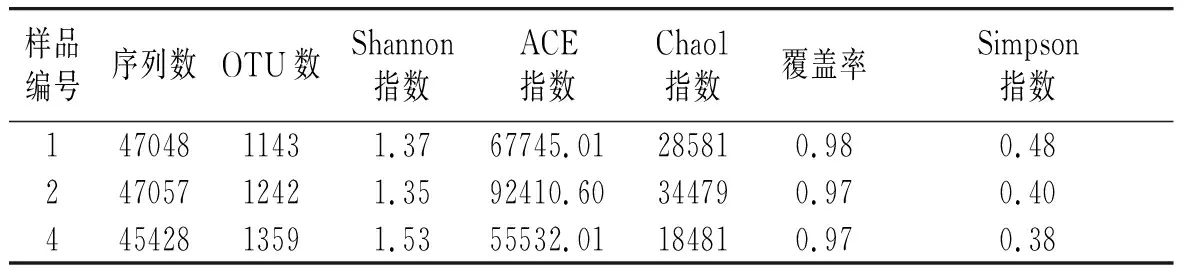
表1 调味面制品样品16S rDNA测序情况Table 1 16S rDNA sequencing situation of flavored flour foods
经拼接、过滤[28]等处理,本次试验采集的3个调味面制品样品总共获得139533条细菌序列,在97%相似度条件下进行划分后,共得到3744个OTUs,每个样品平均为1248个。由表1可知,2号样品的Chao1指数为34479,即含有最多细菌物种种类,物种丰度最高。而1号样品的Simpson指数为0.48,即物种均匀度最好。本次试验覆盖率(coverage)均在0.97~0.98之间,基本涵盖样品中绝大多数菌群,测序数据量满足分析的需要。
将数据做成指数箱型图(见图1)更可直观看出,这3个样品的Chao1指数和ACE指数均较高,而Shannon指数和Simpson指数则较低。因此,这3个样品中的细菌丰度高,而多样性低。
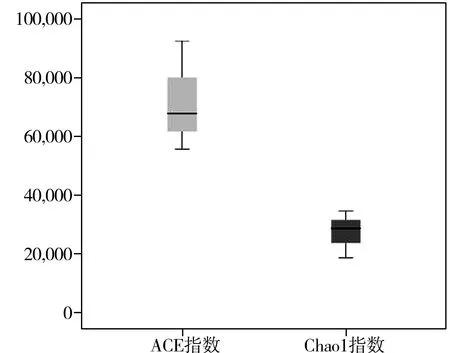

图1 多样性指数箱型图Fig.1 The boxplots of diversity indexes
由图2可知,来自广州市的4号样品物种丰度较高,并且它的物种组成也较为均匀。

图2 丰度分布曲线Fig.2 OTU rank curve
2.2 样品中核心细菌菌群及相对含量分析
本试验测序经过优化平均序列读长为429 bp,将所得到的全部OTU比对数据库,共得到10门、14纲、23目、29科、56属。本试验中平均相对含量大于1%的细菌属为芽孢杆菌属(Bacillus)、明串珠菌属(Leuconostoc)、铜绿假单胞菌属(Pseudomonas)、泛菌属(Pantoea)、布特菌属(Buttiauxella)、勒克菌属(Leclercia)。3个样品中,1号样品与2号样品中芽孢杆菌属(Bacillus)的相对含量均较高,分别为88.08%和50.64%。由图3可知,调味面制品样品初始菌群结构中的优势细菌为芽孢杆菌属和铜绿假单胞菌属。

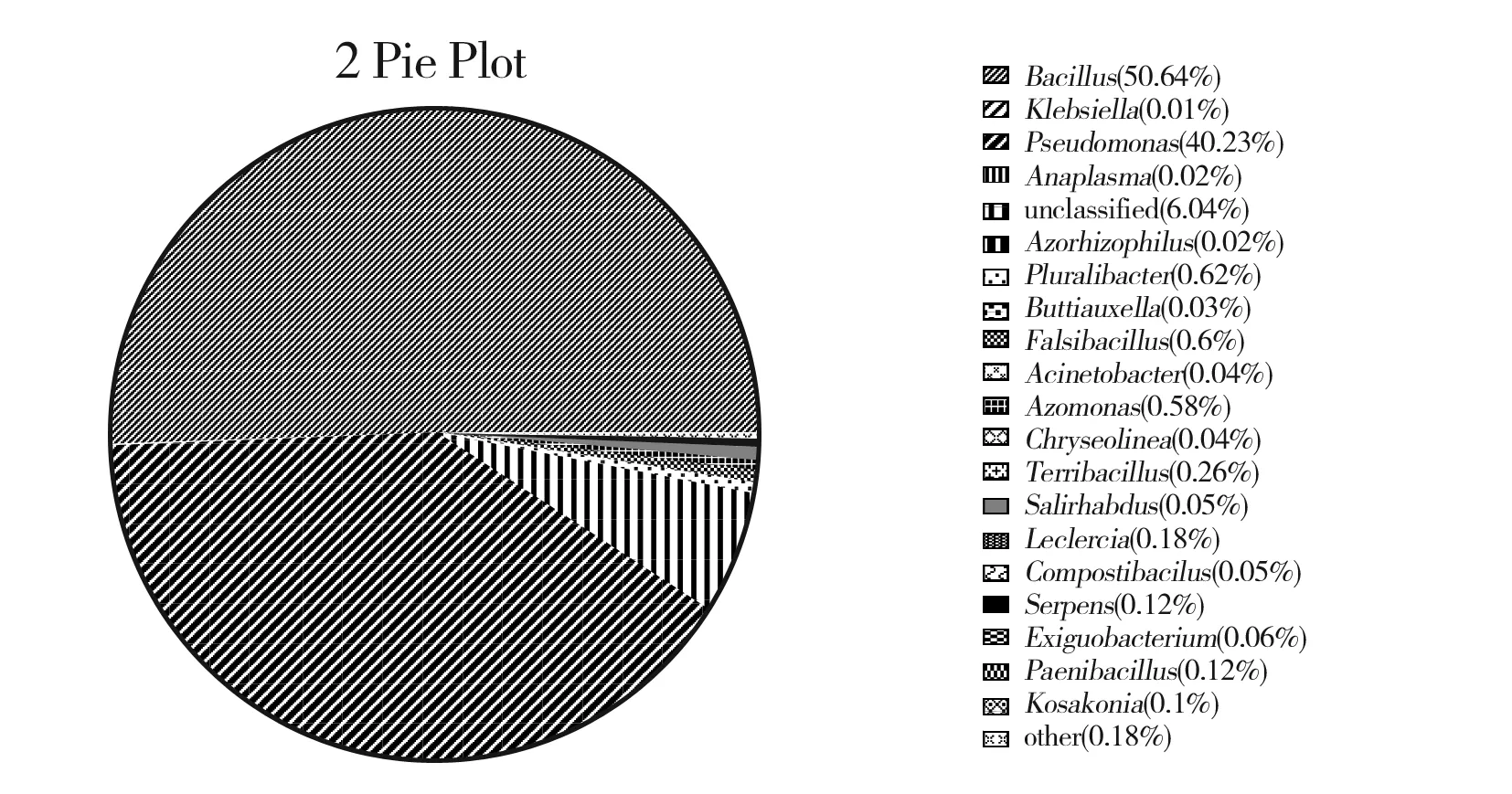

图3 属水平所有样品菌群结构分布图Fig.3 The distribution of microflora structure of all samples at genus level
2.3 Venn图分析
在相似度为97%的条件下,进一步统计了3个样品中OTU出现的次数,利用Venn图直观展示了样品间OTU的重叠情况。结合它所代表的物种,就可以发现不同产地样品中的核心微生物。
由图4可知,出现1次和2次的OTU数为3621个和54个,分别占OTU总数的96.71%和1.44%,3组样品的核心OTU数为15个,占OTU总数的0.40%。1号样品与2号样品共有26个OTU数;2号样品与4号样品共有34个OTU数;1号样品与4号样品共有24个OTU数,由此可见,不同产地样品之间细菌的多样性具有很大差异,但是又存在共同的OTU数,并且核心微生物大致相同,可见在加工工艺以及加工过程中存在相似的微生物污染风险。

图4 OTU样本分布韦恩图Fig.4 OTU sample distribution Venn diagram
2.4 样品中菌群在属水平上的分类组成
本试验自定义相对丰度≥10%的菌群为优势菌群。从属的水平描述调味面制食品中微生物菌群结构变化,包括59个菌属:芽孢杆菌属(Bacillus)、铜绿假单胞菌属(Pseudomonas)、明串珠菌属(Leuconostoc)、泛菌属(Pantoea)、布特菌属(Buttiauxella)、勒克菌属(Leclercia)、假芽孢杆菌属(Falsibacillus)、氮单胞菌属(Azomonas)、Pluralibacter、微小杆菌属(Exiguobacterium)、特布尔布尔西菌属(Trabulsiella)、不动杆菌属(Acinetobacter)、拮抗菌(Terribacillus)、冷杆菌属(Psychrobacter)、克吕沃尔菌属(Kluyvera)、类芽孢杆菌属(Paenibacillus)、Serpens、沙门氏菌(Salmonella)、阴沟肠杆菌(Enterobacter)、Kosakonia、Salirhabdus、Allobacillus、嗜氮根瘤菌属(Azorhizophilus)、堆肥芽孢杆菌属(Compostibacillus)、短小芽孢杆菌(Lysinibacillus)、肠球菌属(Enterococcus)、克雷伯氏杆菌(Klebsiella)、Chryseolinea、少盐芽孢杆菌属(Paucisalibacillus)、无形体属(Anaplasma)、Ornithinibacillus、约克氏菌(Yokenella)、索氏菌属(Thauera)、支原菌属(Mycoplasma)、中华芽孢杆菌属(Sinibacillus)、Lelliottia、Siccibacter、枝芽孢杆菌(Viridibacillus)、康氏盐渍芽孢杆菌(Salinibacillus)、太平洋海洋杆菌(Oceanobacillus)、Phenylobacterium、糖芽孢杆菌属(Saccharibacillus)、弗氏柠檬酸杆菌属(Citrobacter)、Samsonia、新衣原体属(Neochlamydia)、海洋红树林菌属(Mangrovibacterium)、弓形杆菌(Arcobacter)、鞘氨醇单胞菌属(Sphingomonas)、乳球菌属(Lactococcus)、Thiopseudomonas、Halalkalibacillus、马赛菌属(Massilia)、双歧杆菌属(Bifidobacterium)、Fontibacillus、奇异单胞菌(Allomonas)、生丝微菌属(Hyphomicrobium)、根瘤菌属(Mesorhizobium)、嗜麦芽窄食单胞菌属(Stenotrophomonas)、Endozoicomonas。进化关系见图5。

图5 属水平所有样品群落结构分布图Fig.5 The distribution of microflora structure of all samples at genus level
而利用传统的微生物培养法检验调味面制品,仅发现假单胞菌属1个优势菌属,包括粪嗜冷杆菌(Psychrobacterfaecalis)以及黄褐假单胞菌(Pseudomonasfulva)2株菌,虽然调味面制品产地不同,但是它们的优势菌中均包括假单胞菌属,本次试验共检出50余种菌,由此可见,传统的微生物培养法无法反映出样本中低丰度物种,可能存在对样本微生物的菌群及优势菌片面的分析和判断[29]。
3 讨论
本次试验样品均购于同一超市,流通环节以及存放方式相同,但产地不同。由图5可知,各样品之间的主要菌群结构和比例不尽相同。很可能由于不同样品的加工工艺以及产地环境各不相同。从门的水平上,3种调味面制食品中的微生物菌群主要为厚壁菌门(Firmicutes)与变形菌门(Proteobacteria),占总菌数的50%~90%,此外还存在少量的拟杆菌门(Bacteroidetes)和螺旋体门(Spirochaetes)。3种调味面制食品在属的水平上表现出一定的差异,图3展示了样品中物种丰度较高的前50个属水平序列信息。在这些物种丰度较高的50个序列中,选取的3种调味面制食品样品在菌群结构上存在一定的相似性,3种均包含芽孢杆菌属(Bacillus)、铜绿假单胞菌属(Pseudomonas)、布特菌属(Buttiauxella)、微小杆菌属(Exiguobacterium)、不动杆菌属(Acinetobacter)、类芽孢杆菌属(Paenibacillus)。芽孢杆菌属、泛菌属、不动杆菌属广泛分布于自然界,而乳球菌属和双歧杆菌属为益生菌,常用于乳制品发酵。值得注意的是,其中铜绿假单胞菌属、沙门氏菌属为致病菌,在调味面制食品中发现矿泉水中常见的致病菌——铜绿假单胞菌属,极有可能是生产加工环节产生了交叉污染、用水不卫生等。可见,为保证产品的卫生质量,加强生产规范化,管理标准化,有效监控微生物风险尤为重要。还有某些菌属可能处于“活的不可培养状态(viable but nonculturable state, VBNC)” ,即丧失细菌可培养的特征,但是细胞膜完整,有一定的代谢活力,遇到适宜条件,可恢复到可培养的状态,例如生长温度在37 ℃的泛菌属、明串珠菌属和不动杆菌属。
高通量测序技术可以跳过传统微生物耗时较长的培养步骤,直接提取多个样品中微生物基因组信息,更全面客观地反映样品中微生物菌群结构和多样性,具有高效、准确、低成本的优势,但它同时具有相对的局限性。首先,高通量测序过程中产生海量的数据信息,要将这些数据加以总结归类,建立微生物多样性的模型,需要生物信息学的专业背景;其次,高通量测序技术虽然可以检测出样品中不可培养的微生物,但是并不能确定此微生物是否存活,需要结合传统培养方法进行比较。
本文采用均质拍击法提取食品样品的微生物基因组,利用高通量测序技术(MiSeq)对可变区域V3-V4区进行测序,为后续食品中微生物研究提供了新思路和方法。
研究表明,调味面制食品中微生物多样性较低,3种调味面制食品中微生物菌群结构具有一定相似性,其中值得引起重视的是致病菌铜绿假单胞菌属的发现,由于此次未对真菌类进行测序,但仍有部分未确定的菌株,需要进一步研究,在食品安全问题可能发生之前,采取有效的预防措施,将危害系数降到最低。同时加强食品生产工艺流程卫生标准化,保证食品质量安全。

