4株基因C型鸭甲肝病毒的分离鉴定与VP1基因序列分析
曹维伟,魏中锋,李 娇,刘 博,王文秀
(1.寿光市农业农村局畜牧业发展中心,寿光 262700;2.山东省菏泽市动物疫病预防控制中心,菏泽 274000;3.山东绿都生物科技有限公司,滨州 256600;4.山东省滨州畜牧兽医研究院,滨州 256600)
鸭病毒性肝炎(duck viral hepatitis, DVH)是雏鸭的一种急性、致死性传染病,传播迅速,一周龄以内的雏鸭非常易感,死前呈“角弓反张”姿势,病死雏鸭剖检主要表现为肝脏病变和出血,是当前危害全球养鸭业最为严重的传染病之一[1-4]。DVH的致病源主要有鸭甲肝病毒(Duck hepatitis A virus, DHAV)、鸭星状病毒1型(Duck astrovirus 1, DAstV-1)和鸭星状病毒2型(Duck astrovirus 2,DAstV-2),其中以鸭甲肝病毒的感染最为普遍,危害也最为严重[5-7]。DHAV为小RNA病毒科禽肝病毒属成员,病毒基因组为单股正链RNA病毒,具有三种血清型(Ⅰ型、Ⅱ型和Ⅲ型)和三种基因型(A型、B型和C型),血清Ⅰ型(传统Ⅰ型)、血清Ⅱ型(台湾新型)和血清Ⅲ型(韩国新型)分别对应基因A型、基因B型和基因C型,目前我国主要流行DHAV-A和DHAV-C,我国内陆地区尚未发现DHAV-B的流行[8-10]。山东寿光地区因具有饲料来源丰厚、饲养传统良好、气候适宜等优势,肉鸭养殖产业一直比较发达,但近年来随着寿光地区肉鸭养殖产业的规模化快速发展,鸭苗异地流通加剧,DHAV的发生率逐步提高,DHAV的流行已严重阻碍寿光养鸭产业的高质量发展。本研究对2019-2021年采集于山东寿光地区规模化鸭场疑似DHAV感染的临床病料样品进行了RT-PCR检测、病毒分离鉴定及VP1基因序列分析,阐明了寿光地区DHAV的感染和流行情况,为我国DHAV的综合防控提供参考依据。
1 材料与方法
1.1 试验动物 无DHAV母源抗体的10日龄鸭胚、1日龄健康樱桃谷鸭,均购自寿光天辉种禽场。
1.2 主要试剂与疫苗 病毒基因组RNA提取试剂盒购自北京百泰克生物科技有限公司;一步法RT-PCR扩增试剂盒、DL-2000 DNA marker、pMD18-T载体均购自宝生物工程(大连)有限公司。
1.3 病料样品的采集与处理 于2019-2021年采集于山东寿光地区规模化鸭场疑似患有DHAV感染的雏鸭病料样品共计8份,8份临床病例的雏鸭发病日龄均在3~21日龄,剖检病死雏鸭可见肝脏均有点状出血,取病死雏鸭的肝脏样品按1∶5比例加入灭菌生理盐水研磨处理,研磨后的组织匀浆经12 000 ×g离心15 min,吸取上清液用于PCR检测和病毒分离。
1.4 临床病料的RT-PCR检测
1.4.1 引物设计与合成 根据参考文献[11]设计DHAV-A和DHAV-C的双重RT-PCR鉴别检测引物(表1),引物由宝生物工程(大连)有限公司合成。

表1 本研究使用引物Table 1 Primers used in this study
1.4.2 一步法RT-PCR检测 按照病毒基因组RNA提取试剂盒的使用说明书依次提取8份病料样品的基因组RNA,按照参考文献[11]中的一步法RT-PCR扩增程序进行PCR扩增,PCR扩增产物经1%琼脂糖凝胶电泳观察结果。
1.5 病毒分离 将PCR扩增为阳性的组织病料样品进行病毒分离,取离心后的临床病料样品上清液2.0 mL,用0.45 μm滤器过滤除菌,每份组织病料样品接种10日龄鸭胚10枚,0.1 mL/胚,接种后24 h内的死亡鸭胚弃去,观察至120 h,死胚随时放置4℃冰箱冷藏保存,120 h后收集所有死亡鸭胚尿囊液,并观察鸭胚的病变情况。用上述同样的试验方法在鸭胚上连续传三代。
1.6 分离毒株病毒含量测定 取分离毒株的第三代鸭胚尿囊液,利用灭菌生理盐水进行10倍系列稀释,每一个稀释度接种5枚10日龄鸭胚,0.1 mL/胚,孵育观察至接种后144 h,记录各稀释度鸭胚死亡情况,按照Reed-Mench方法计算分离毒株对鸭胚的半数致死量(embryo median lethal dose, ELD50)。
1.7 分离毒株致病性试验 将50只1日龄健康樱桃谷鸭随机分为5组,每组10只雏鸭,试验1组~4组分别接种分离毒株0.1 mL(含100 ELD50);试验5组为对照组,接种灭菌生理盐水0.1 mL。接种后观察14 d,记录各组雏鸭的发病和死亡情况。
1.8 分离毒株VP1基因序列分析
1.8.1 VP1基因引物设计与合成 根据DHAV-C VP1基因序列设计扩增包含整个VP1基因的特异性引物(VP1F3:5'-GGTGATTCCAATCAGC-3',VP1R3:5'-TTCAATTTCCAAATGG-3'),预期扩增片段大小为720 bp,引物由宝生物工程(大连)有限公司合成。
1.8.2 VP1基因PCR扩增 分别提取分离毒株的病毒基因组RNA,利用一步法RT-PCR试剂盒扩增VP1基因,一步RT-PCR反应体系为:2×Buffer 12.5 μL,上、下游引物(20 μmol/L)各0.5 μL,酶0.5 μL,RNA 4 μL,总体系补充至25 μL。一步RT-PCR反应程序为:50℃ 40 min;95℃预变性5 min;94℃变性45 s,54℃退火45 s,72℃延伸45 s,30个循环;72℃延伸10 min。RT-PCR扩增结束后回收VP1基因片段,连接到pMD-18T载体上,送宝生物工程(大连)有限公司进行测序鉴定。
1.8.3 VP1基因遗传进化树分析 从GenBank网站下载部分DHAV-C毒株序列,利用DNAStar生物学软件将扩增的VP1基因序列与GenBank中登录的几株DHAV-C基因序列分别进行核苷酸同源性比较分析,并构建系统进化树。
2 结果
2.1 临床病料的RT-PCR检测结果 如图1所示,8份临床病料样品经DHAV-A和DHAV-C双重一步法RT-PCR检测,共扩增DHAV-C阳性病料4份,未扩增出DHAV-A阳性病料。

图1 临床病料的RT-PCR扩增结果Fig.1 RT-PCR amplification results of clinical materials
2.2 病毒分离结果 4份DHAV-C阳性病料样品接种10日龄鸭胚后均出现规律性死亡,死亡时间集中在接种后48~72 h,剖检死亡鸭胚可见胚体出血,鸭胚肝脏表面有点状出血点。依次无菌收集第三代鸭胚尿囊液,分别命名为SG1、SG2、SG3、SG4。
2.3 分离毒株病毒含量测定结果 按Reed-Muench法测定SG1、SG2、SG3、SG4分离毒株对鸭胚的ELD50分别为10-6.83/0.1 mL、10-6.50/0.1 mL、10-6.32/0.1 mL、10-6.83/0.1 mL。
2.4 分离毒株致病性试验结果 各处理组的雏鸭发病和死亡情况如表2所示,4株分离毒株攻击的试验雏鸭在攻毒后24 h开始出现精神萎靡不振、嗜睡等临床表现,随后陆续开始出现死亡,死亡主要发生在攻毒后48~96 h,死亡的雏鸭呈现“角弓反张”姿势,剖检死亡雏鸭可见肝脏出血明显。至攻毒后168 h,未死亡的发病雏鸭精神状态逐步开始恢复,但生长缓慢。SG1、SG2、SG3、SG4分离毒株攻击雏鸭的死亡率分别为70%、70%、60%、80%。表明SG1、SG2、SG3、SG4分离毒株均为高致病性毒株,以SG4分离毒株对雏鸭的致病性最强。

表2 试验雏鸭发病和死亡情况Table 2 Morbidity and mortality of experimental ducklings
2.5 分离毒株VP1基因序列分析结果 如图2所示,SG1、SG2、SG3、SG4分离毒株的VP1基因PCR扩增产物在720 bp处均有特异性扩增条带,片段大小均与试验预期结果一致。根据SG1、SG2、SG3、SG4毒株的VP1基因测序结果,结合GenBank中登录的部分DHAV-CVP1基因序列,利用DNAStar生物学软件进行核苷酸同源性比较和系统进化树分析,结果可知,SG1、SG2、SG3、SG4分离毒株与GenBank中登录的DHAV-C核苷酸同源性为91.9%~99.6%,与序列号为KC191693.1、GQ485311、KC191690.1、KC191694.1、EU877916的DHAV亲缘关系较近,处于进化树的同一个分支(图3、图4)。
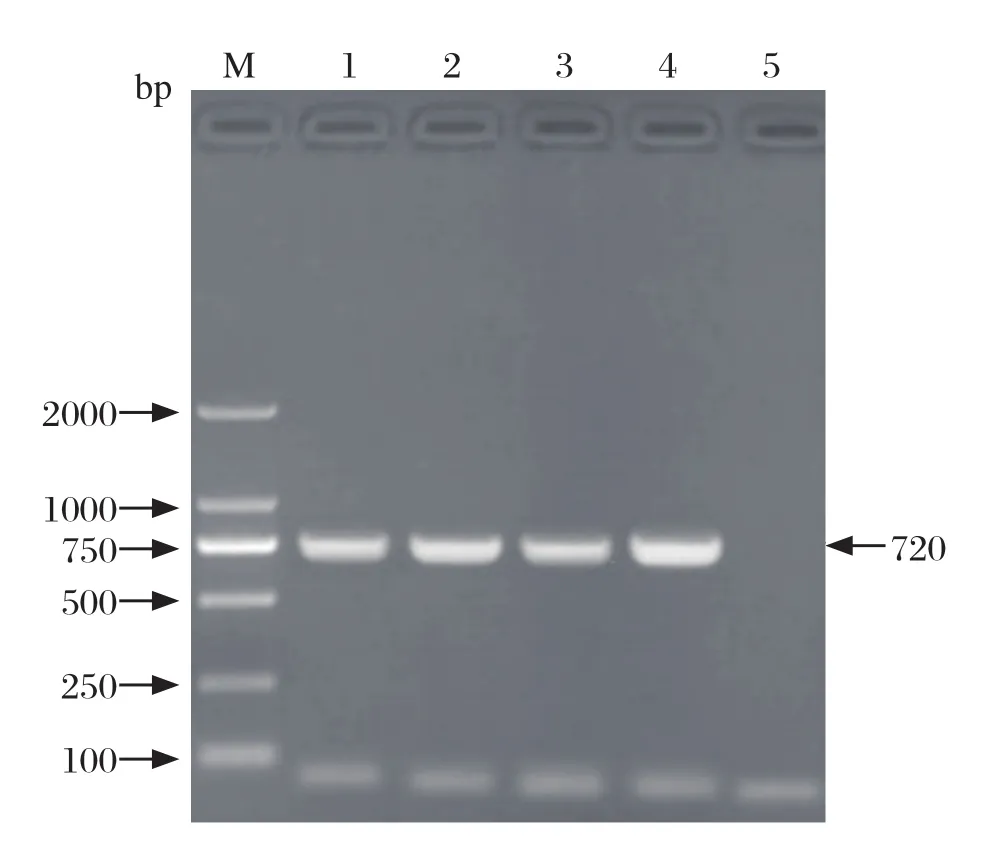
图2 分离毒株VP1基因的RT-PCR扩增结果Fig.2 RT-PCR amplification results of VP1 gene of isolated strain
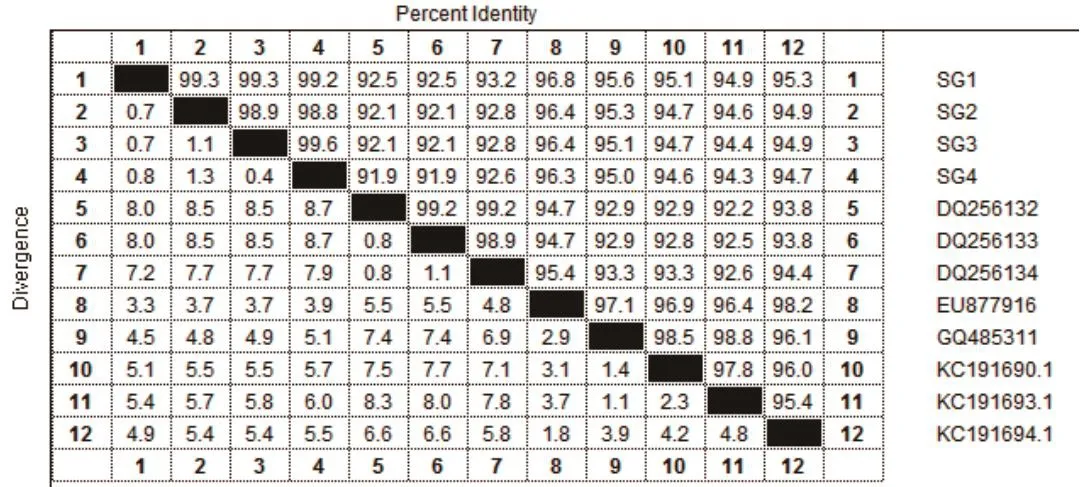
图3 分离毒株VP1基因核苷酸同源性比较Fig.3 Comparison of nucleotide homology of VP1 gene of isolated strains
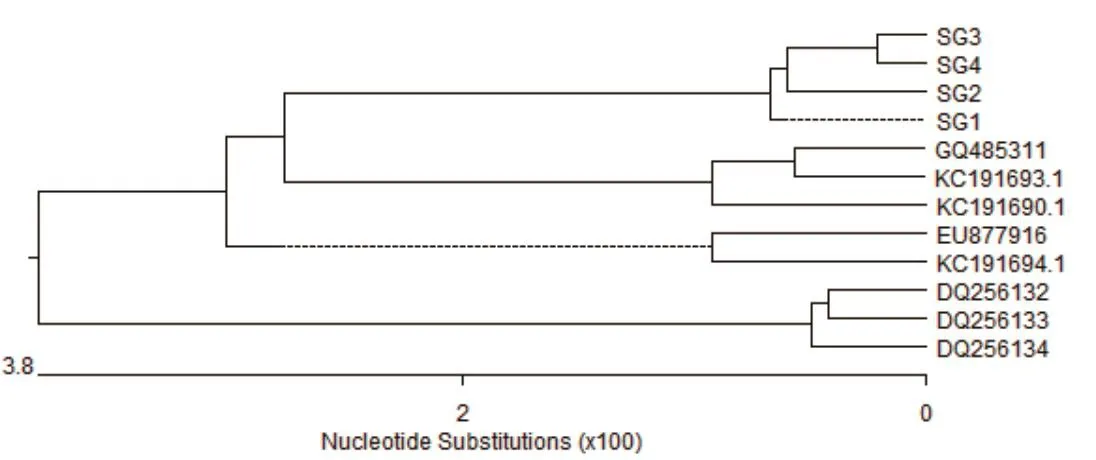
图4 分离毒株VP1基因系统进化树分析Fig.4 phylogenetic tree analysis of VP1 gene of isolated strain
3 讨论
DHAV在我国养鸭密集地区的发生与流行给养殖户造成了巨大的经济损失,DHAV已经成为严重威胁养鸭业的重要病毒性传染病,加强DHAV的流行病学监测和提高综合防控能力已迫在眉睫。2012年之前我国DHAV的主要流行基因型为基因A型,近年来随着DHAV-A疫苗和卵黄抗体的大面积推广应用,DHAV-A的流行逐步得到了控制,发病率逐步降低。但由于DHAV的各基因型之间无交叉保护作用,临床中推广应用DHAV-A疫苗和卵黄抗体无法抵抗DHAV-C的感染,导致近年来DHAV-C的发病率逐步增加,陈琳琳等[12]采用PCR方法对采集于四川省、河南省、山东省、广东省等地区26个鸭群的60份疑似DHAV感染病料样本进行了DHAV-A和DHAV-C的病原学检测,表明基因C型阳性感染率为30%,基因A型阳性感染率仅为18.3%,四川省、河南省、山东省、广东省等地区26个鸭群中以基因C型为主要流行基因型。本研究采用RT-PCR方法对2019-2021年采集于山东寿光地区规模化鸭场疑似患有DHAV感染的8份雏鸭病料样品进行了DHAV-A和DHAV-C的病原学检测,共检出阳性病料4份,其全部为基因C型,说明DHAV-C是山东寿光地区的主要流行基因型,与陈琳琳等[12]的研究结果表现出了一致性。以上流行病学监测表明,基因C型已经替代基因A型成为我国DHAV流行的优势基因型,当前以基因A型为主的DHAV综合防控措施已不能满足临床疫病的防控需要,应加强以基因C型为主的DHAV综合防控措施。
DHAV的全基因组包含5'UTR、3'UTR、一个开放阅读(open reading frame, ORF)和poly(A)尾巴四部分,其中VP1蛋白是ORF酶解产生的结构蛋白,是小RNA病毒的核衣壳蛋白,位于核衣壳蛋白的外部,含有B细胞表位和T细胞表位,具有多种优势抗原表位,能够刺激机体产生中和抗体,是最主要的免疫原性蛋白,VP1基因的突变会导致病毒抗原性的变化,导致病毒发生免疫逃逸,产生新的流行毒株,VP1基因变异规律被广泛认为是研究DHAV遗传变异的重要依据[13-15]。通过对VP1基因进行遗传变异分析,可以掌握分离毒株的流行规律,为制定DHAV的综合防控措施提供科学依据,鉴于此,本研究利用VP1基因序列分析对分离到的4株分离毒株进行了分子水平上的鉴定,结果表明4分离毒株与GenBank中登录的DHAV-C的核苷酸同源性为91.9%~99.6%,与近几年国内流行的DHAV-C亲缘关系较近,从分子水平上证明4株分离毒株均为DHAV-C。所以,应定期进行DHAV的分离鉴定及基因序列分析,了解DHAV流行毒株的变异情况,做好DHAV的流行病学监测,防止潜在的遗传变异导致病毒逃逸而引发疫病的暴发和流行[4],为指导临床生产及疾病防控提供参考从而加强DHAV的综合防控。
本研究通过对临床疑似病例的RT-PCR检测和病毒分离鉴定,成功分离到4株DHAV-C,4株分离毒株与GenBank中登录的DHAV-C VP1基因核苷酸同源性为91.9%~99.6%,与近几年国内流行的DHAV-C亲缘关系较近,为我国DHAV的综合防控措施的制定提供了参考依据。

