塞内卡病毒广西分离株的初步分离与鉴定
牛晨霞,王 豪,农作荣,全东群,曾 悦,任同伟,王玉旭,王景隆,刘 畅,陈 樱,欧阳康,黄伟坚,韦祖樟
(广西大学动物科学技术学院 动物传染病与分子免疫学实验室,南宁 530005)
A型塞内卡病毒(Senecavirus A, SVA)是一种无包膜、单股正链RNA病毒,属于小核糖核酸病毒科(Picornaviridae)塞内卡病毒属,与心病毒属(Cardiovirus)最接近。SVA是一种新发的传染性病原体,可引起猪原发性疱疹病((SIVD)和流行性短暂性新生儿死亡。塞内卡病毒最早于2002年发现于人胚胎视网膜细胞系(PER.C6)的细胞培养污染物中[1],早期的SVV-001表现出对具有神经内分泌特性的肿瘤细胞的快速、有效和选择性杀伤,对正常细胞缺乏毒性,可有效治疗具有神经内分泌特性的转移性肿瘤,例如小细胞肺癌和许多类型的小儿实体癌[2-3]。早期分离的SVA原型毒株对猪并无明显的致病性,但在2007年加拿大运往美国的发生猪水疱病的猪中,以及2012年美国印第安纳州报道的引起6月龄猪群出现相关猪水疱症状的猪中检测到SVA,进而推测SVA感染可能与水疱性疾病相关[4]。2015年,美国多个州暴发猪水疱性疾病,新生仔猪死亡率达30%~70%,通过动物回归实验,证明了易感猪中SVA感染与水疱病之间存在因果关系[5]。截至目前,加拿大、美国、巴西[6]、泰国[7]、中国[8]、哥伦比亚[9]、越南[10]等多个国家均暴发了SVA疫情,且流行范围正在不断扩大。2015年我国广东[11]地区首次报道了SVA疫情,随后湖北省[12]、黑龙江省[13]、河南省和福建省[14]等省的患病猪场相继检出SVA,说明SVA在我国猪场中呈逐渐流行趋势。
SVA所致临床症状与口蹄疫病毒(Foot and mouth disease virus, FMDV)、猪水疱病病毒(Swine vesicular disease virus, SVDV)、水疱性口炎病毒(Vesicular stomatitis virus, VSV)等疾病在临床上难以区分。可根据临床症状进行初步诊断,确诊还需要实验室的进一步检测诊断。目前已经用于诊断SVA的实验室方法包括病毒分离、病毒中和试验、竞争ELISA、常规RT-PCR和实时荧光RT-PCR(rRT-PCR)等方法[15-16]。
2018年1月,广西某规模化猪场猪只发生水疱性疾病,母猪发烧、厌食、口鼻及蹄部出现水疱症状,并伴有产房仔猪猝死,经RT-PCR检测发现口蹄疫病毒、猪水疱病病毒等常见病原均为阴性,而SVA RNA检测为阳性。本研究从发病猪群采集的水泡液病料中分离得到了SVA,采用RT-PCR扩增、基因序列测定、TCID50和间接免疫荧光等方法对其进行了鉴定。本研究为SVA在广西地区的流行病学、诊断方法研究、疫苗的开发和综合防控奠定了基础。
1 材料与方法
1.1 主要实验材料 病料与细胞:临床病料样品为2018年1月采自广西某猪场疑似SVA感染的妊娠母猪和育肥猪的水泡液;猪肾细胞系(PK-15)由广西大学动物科学技术学院动物传染病室保存。高糖 DMEM培养基、胎牛血清、0.25%胰蛋白酶均购自赛默飞世尔有限公司;反转录试剂盒、PCR试剂盒、DNA胶回收试剂盒购自OMEGA公司;pMD-18T、DL2000 DNA marker 购自大连TaKaRa公司;Prep体液病毒DNA / RNA Mini Prep Kit购自百赛生物有限公司。
1.2 病毒的RT-PCR鉴定 取收集的病料样品水泡液按照试剂说明书步骤提取病毒核酸,参考杨彩娟等[17]设计1对检测引物(SVV-2682-F:5′-TTCCACTCCACCGACAACG-3′;SVV-3224-R:5′-GATACCTTCCCACCCTTGC-3′)扩增SVA基因组约542 bp。PCR反应体系(25μL)为:Taq DNA聚合酶12.5 μL,上、下游引物各1 μL,cDNA模板3 μL,ddH2O 7.5 μL。同时,采用RT-PCR方法以同样的反应体系检测FMDV[18]、SVDV[18]、VSV[19]和VESV[20],并设置阴性对照。PCR反应程序:94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸1 min,共32个循环。RT-PCR产物用1%琼脂糖凝胶电泳进行检测。
1.3 病毒的分离及传代培养 将检测结果为阳性的病料样品水泡液以适量的无菌PBS稀释并离心去除沉淀物,取上清液,以0.22 μm的滤器过滤除菌后接种于长势良好的PK-15细胞,在37℃、5%CO2的条件下孵育1 h,弃上清液,加入含2%胎牛血清的DMEM培养基,放置37℃、5%CO2的细胞培养箱中培养,逐日观察细胞病变。待70%细胞发生病变后收取上清液,将收取的上清液接种于新的PK-15细胞,同时设立阴性对照组(即未接毒的正常细胞)每日观察细胞病变。依照上述方法进行盲传及观察。
1.4 病毒基因组的扩增及序列测定 与其他小RNA病毒科成员相似,SVA基因组只有一个开放性阅读框,编码一个多聚蛋白,并在蛋白酶作用下裂解成多个结构蛋白和非结构蛋白,其中VP1是病毒主要的抗原蛋白,也被认为是小RNA病毒科免疫原性最强的蛋白。为了研究本实验所得到的分离株VP1的特点,对连续盲传的各代次的细胞培养液抽取总RNA,采用RT-PCR方法检测SVA。根据NCBI GenBank数据库中的SVV-001(DQ641257)全基因序列设计特异性引物(SVA-VP1-F:5′-cagGTATA Ctccaccgacaacgctgagac-3′;SVA-VP1-R:5′-ctgCC TGCAGGttgcatcagcatcttttgcttg-3′)用于扩增VP1段,获得预期大小约为 812 bp的片段。将扩增的PCR产物克隆至pMD-18T载体后送北京六合华大基因科技有限公司进行测序。
1.5 遗传进化分析 将测序结果在NCBI中进行BLAST搜索比对,与从GenBank中整理的VP1基因序列进行多序列比对分析,应用MEGA 5.10软件进行VP1的系统发育分析,采用邻位相接法(Neighbor-Joining)构建进化树,并以Bootstrap值(1000)来评估进化树的可靠性。
1.6 病毒的TCID50测定 在重组病毒TCID50测定前从液氮中复苏PK-15细胞于T75细胞瓶中,待T75细胞瓶中细胞长至80%时进行细胞传代,将细胞均匀的传代于96孔细胞板中,待细胞长满时,弃掉原有的10% FBS DMEM培养基,使用PBS轻轻洗涤3次,使用2%FBS DMEM对SVAGX02的P4代次病毒液进行连续倍比稀释(10-1~10-8),将稀释好的病毒依次加入96孔板中,每孔100 μL,每个稀释梯度设置8个重复,在阴性对照孔中加入2% FBS DMEM后置于37℃、5% CO2培养箱中培养,每隔12 h观察并记录出现细胞病变的孔,连续观察数天直至不再有新的细胞病变出现,最后统计每个稀释梯度出现病变的孔数,按照Reed-Muench法计算出病毒的TCID50。
1.7 间接免疫荧光试验(immunological fluorescence assay, IFA) 将BHK-21细胞传代至6孔板中,待BHK-21细胞长至80%时,弃去6孔板的培养基,使用PBS将6孔板轻轻洗涤3次,将SVAGX02的P4代上清液50倍稀释后,取300 μL稀释后的细胞上清液接种于6孔板中,置于37℃、5%CO2条件下培养,每12 h观察一次细胞病变,待6孔板的细胞出现典型细胞病变时,收集细胞上清液保存于-80℃,使用PBS轻轻洗涤6孔板3次,之后在每个细胞孔中加入1 mL冰甲醇,将6孔板放置于-20℃ 10 min或4℃ 30 min以固定细胞。固定完成后,弃去6孔板中冰甲醇,使用PBS磷酸缓冲液轻轻洗涤3次,每孔加入500 μL已配制完成的1.0% BSA,放置于室温中孵育30 min。之后用PBS洗涤细胞3次,加入兔源多克隆抗体(1∶500稀释,实验室制备)作为一抗,37℃孵育2 h,以FITC标记的山羊抗兔IgG作为为二抗37℃孵育0.5 h,PBS洗涤细胞3次,在荧光显微镜下进行间接免疫荧光检测。
2 结果
2.1 SVA病料样品的RT-PCR鉴定 从病料样品的囊泡液中提取病毒核酸,采用RT-PCR方法,利用检测引物SVV-2682-F/ SVV-3224-R扩增片段约为542 bp,大小与预期相符(图1),而其他水疱病原及阴性对照未见到扩增条带。
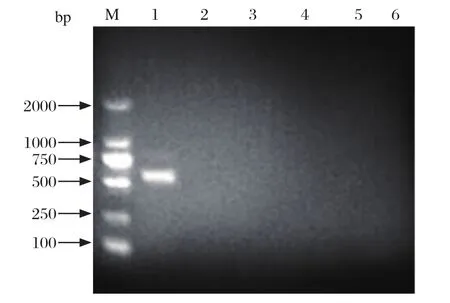
图1 RT-PCR 检测病料样品中的SVAFig.1 Detection of SVA in tissue sample by RT-PCR
2.2 SVA的分离及传代培养 将PCR检测为阳性的病料样品囊泡液过滤除菌后接种PK-15细胞,盲传至第6代,培养48 h后开始出现明显细胞病变,表现为细胞变圆,细胞面粗糙,死细胞浮在表面,而对照组细胞长势良好,未出现任何病变(图2)。
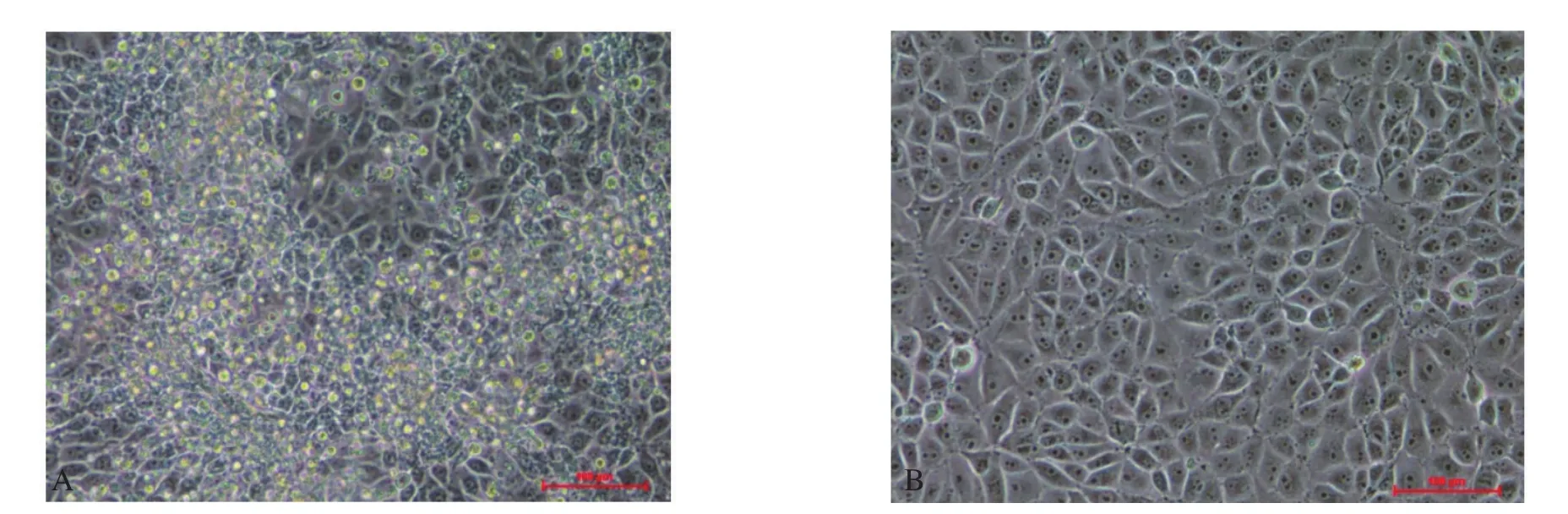
图2 分离株感染PK-15细胞的细胞病变Fig.2 Cytopathic effect of PK-15 cells infected with SVAGX02 isolate
2.3 SVA VP1基因组的扩增及测定分析 从盲传的细胞培养液中提取病毒RNA,采用 RT-PCR方法,利用特异性引物SVA-VP1-F/SVA-VP1-R扩增片段约812 bp的目的片段(图3)。
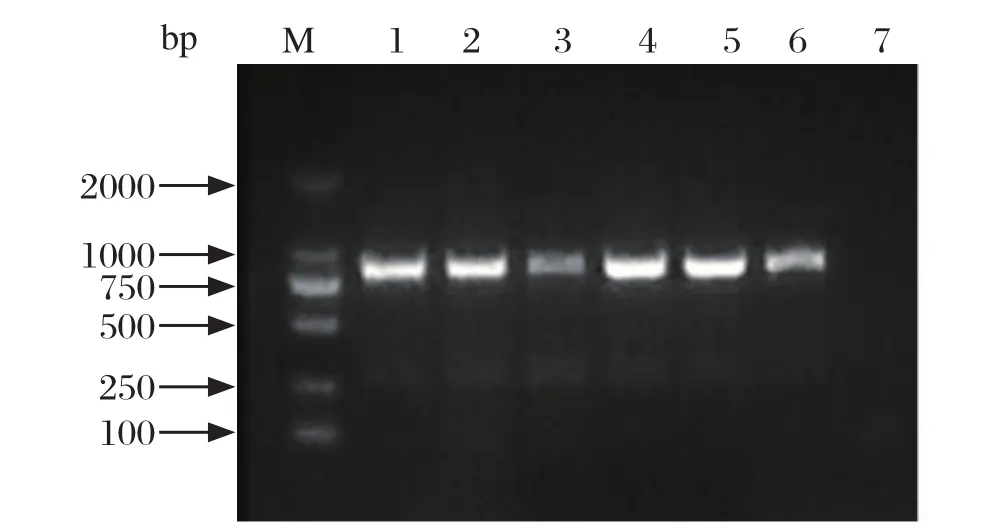
图3 RT-PCR 扩增细胞培养液中的SVA VP1基因Fig.3 Detection of SVA VP1 gene in cell culture fluid by RT-PCR
将PCR产物克隆进入pMD-18T载体后送华大基因测序,得到VP1基因测序结果(792 bp)。将测序结果在NCBI中进行BLAST搜索,得到与其高度相似的其他SVA VP1序列。将测序结果与从GenBank中整理的35条基因序列进行比对,构建系统进化树。从进化树可看出,分离株与传统毒株SVV-001距离最远,处于两个完全不同的分组,而与2017年广东分离株处于较近的分支。因此,推测本研究所得分离株可能是由广东分离株演变而来,也进一步说明了导致各地暴发水泡疫情的SVA在不断地演变。
2.4 病毒的TCID50检测结果 根据Reed-Muench法及病毒液在PK-15细胞的病变情况,计算病毒液的TCID50,得到SVAGX02 P4代次的TCID50为10-6.75/mL,说明病毒在细胞内复制良好。
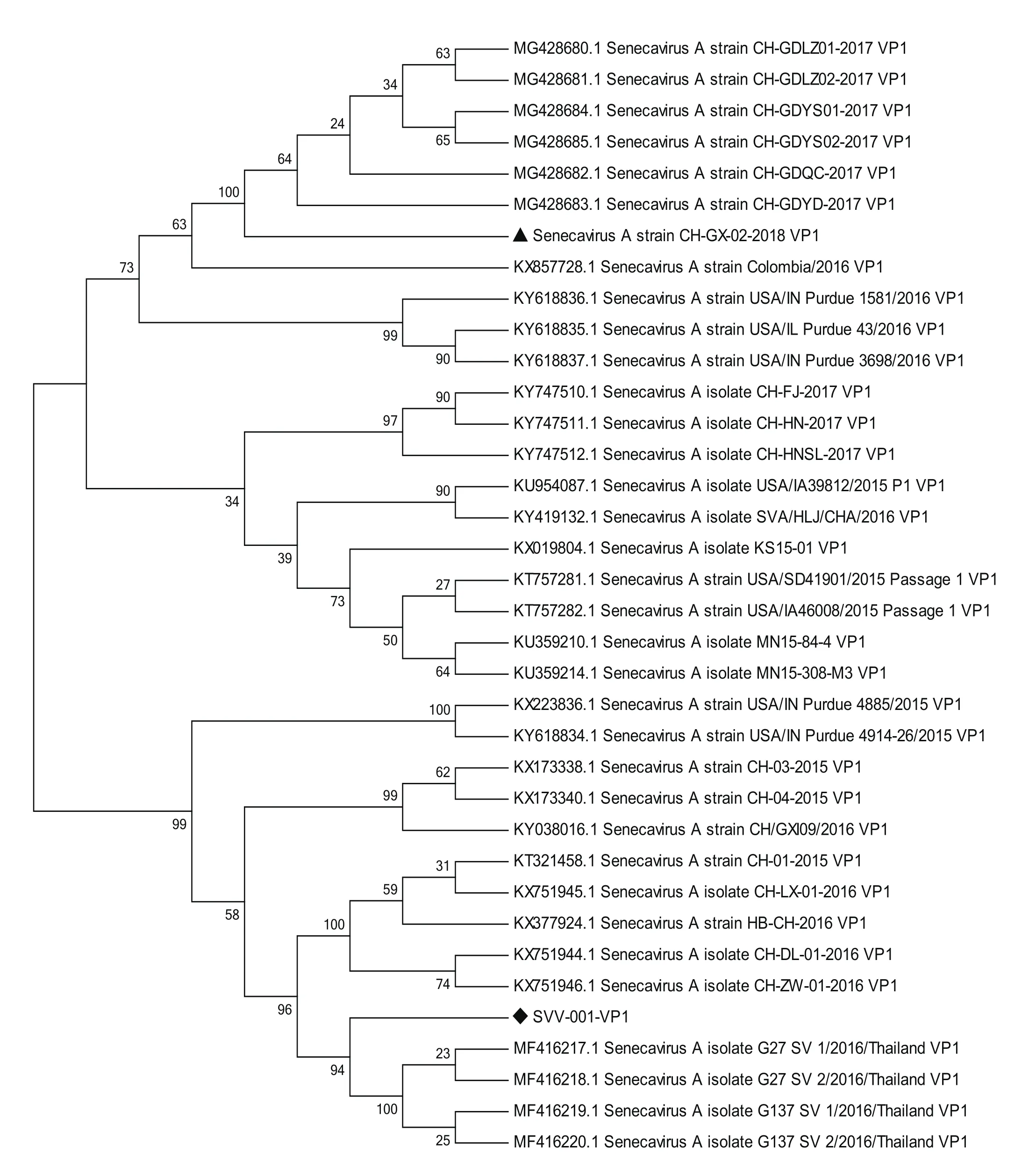
图4 SVAGX02 的 VP1 基因核酸序列系统进化树Fig.4 Phylogenetic tree based on SVA VP1 gene
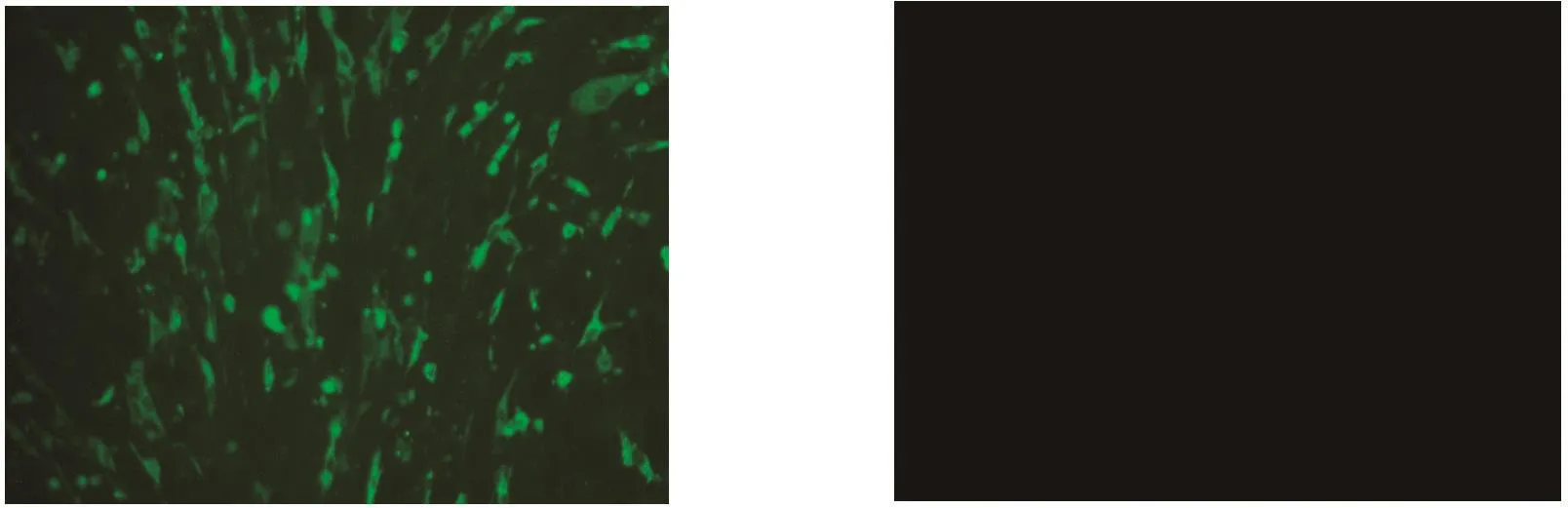
图5 SVAGX02间接免疫荧光鉴定结果Fig.5 IFA identification of SVAGX02 strain infected BHK-21 cells
2.5 间接免疫荧光鉴定结果(IFA) 将P4代次SVAGX02的病毒液接种BHK-21细胞,用实验室制备的多克隆抗体和FITC山羊抗兔IgG二抗进行间接免疫荧光试验。结果显示接种P4代次细胞培养物的BHK-21细胞出现明显的绿色特异性荧光,而对照组正常的BHK-21细胞在荧光显微镜下未观察到荧光。
3 讨论
自20世纪80年代起,塞内卡病毒一直在美国的猪群中流行,直到2007年SVV被证实是加拿大运往美国的猪发生猪原发性水疱病的致病病原引起,以及2012年美国印第安纳州报道的引起6月龄猪群出现相关猪水疱症状的病原,自此,SVA引起广泛的关注。SVA潜伏期为4~5 d,发病率和死亡率受猪群年龄、来源和地理分布等因素影响存在一定的差异。本病发生无明显的季节性,但春秋两季发病率偏高。目前尚无感染了SVA的猪场再次暴发猪水疱病的报道。在传播媒介上,据Joshi等[21]的调查,鼠、苍蝇等均检测到了SVA,其可能在SVA传播中起重要作用。目前,SVA感染已在广东省、湖北省、福建省、河南省、黑龙江省和广西壮族自治区出现,所造成的经济危害并不十分严重,但是随着时间的推移,不排除其在我国猪群中呈流行趋势,给养殖业带来较大损害的可能。从本研究中的VP1基因的分析结果可以看出,分离得到的SVA毒株与已报道的2017年从广东省分离的SVA毒株处于较近的进化分支,这表明相近的时间点和较近地理位置在SVA株的流行上具有一定的相关性。本研究中SVA的成功分离和鉴定对广西壮族自治区地区流行病学研究、诊断试剂开发和疫苗研制具有重要的意义。

