幽门螺杆菌感染对人胃黏膜和胃癌细胞热休克蛋白70 表达的影响
陶虹锦,张少杰,王炳智,薛丽燕,刘 静,王刚石
1 解放军医学院,北京 100853;2 解放军总医院第二医学中心 消化科,国家老年疾病临床医学研究中心,北京 100853;3 中国医学科学院肿瘤医院 病理科,北京 100021;4 解放军总医院第二医学中心 老年医学研究所,衰老及相关疾病研究北京市重点实验室,北京 100853
幽门螺杆菌(Helicobacter pylori,Hp)是人类最常见的病原菌之一,在全球的自然人群中感染率超过50%[1]。Hp 感染可引起多种胃肠道疾病,1%~2%的Hp 感染者可发生胃恶性肿瘤[2]。Hp经口进入胃内后,如何在高酸性环境下定植生存并进一步损伤胃黏膜而致病,其错综复杂的机制远未阐明。热休克蛋白(heat shock proteins,HSPs)是一类广泛存在于自然界的结构高度保守的蛋白质家族[3]。根据分子量的大小分为HSP110、HSP90、HSP70、HSP60 和小分子热休克蛋白,其中HSP70在生物细胞中含量最高,在环境压力譬如热应激、缺血、乙醇、细菌和病毒感染下产生,不仅能帮助蛋白折叠、增强细胞耐受,也具有抗凋亡、抗氧化和免疫的作用[4-5]。有研究证明HSP70在人类肿瘤细胞中也有广泛的表达,以对抗化疗药物并促进肿瘤的发生[3,6-9]。已知很多细菌感染可以增加宿主HSPs 的表达[10-12]。然而有研究发现Hp 在感染胃上皮细胞时具有下调宿主细胞HSPs表达的能力[13]。HSP70 的下调会进一步加剧Hp感染引起的胃上皮细胞生长停滞并诱导细胞凋亡,无法拮抗Hp 感染诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,减弱了机体对细菌感染的免疫和耐受能力,有利于Hp 定植与致病[14-15]。研究Hp 感染下调宿主细胞HSPs 的规律,阐明其潜在机制,不仅有助于我们深入了解Hp 与宿主胃黏膜上皮细胞之间的互动,为干预Hp 感染提供新的方法,还可以探索抑制HSPs 通路的新路径,进而为肿瘤治疗提供新的策略。笔者通过对人胃黏膜细胞和组织中HSP70 的研究,探讨HSP70 蛋白在人胃黏膜细胞和腺体中的表达特征,为今后探索Hp 感染所导致的细菌-宿主间互动以及寻找抗Hp 治疗新靶点提供基础数据。
材料与方法
1 主要实验材料与试剂 幽门螺杆菌标准菌株ATCC 26695 由北京大学第一医院提供;人胃黏膜细胞Ges-1 和人胃癌细胞BGC-823 由本实验室保存。人胃癌组织芯片由中国医学科学院肿瘤医院病理科提供,组织芯片中包含正常胃黏膜组织14 个、Hp 感染的胃黏膜组织3 个以及胃癌组织51 个。弯曲杆菌琼脂基础购于美国OXOID 公司,微需氧产气袋购于法国梅里埃公司,HSP70、GAPDH 抗体购于英国Abcam 公司,细胞培养相关试剂购于北京索莱宝公司,Western-blot 其余相关试剂购于碧云天公司,RNA 提取、反转录及qPCR 试剂购于南京诺唯赞公司。
2 实验分组 1)体外细胞学实验。对照组:①人胃黏膜细胞Ges-1 正常生长24 h (n=3);②人胃癌细胞BGC-823 正常生长24 h (n=3)。实验组:①人胃黏膜细胞Ges-1 与Hp 共培养12 h 组、24 h 组、48 h 组(n=3);②人胃癌细胞BGC-823 与Hp 共培养12 h 组、24 h 组、48 h 组(n=3)。2)组织病理学实验。对照组:人正常胃黏膜组织。实验组:①Hp 感染的胃黏膜组织;②胃癌组织。连续切片的组织芯片分别进行Hp 和HSP70 的免疫组织化学(IHC)染色。
3 细胞与细菌共培养 Hp 培养在37℃、微需氧环境(5% O2、10% CO2、85% N2)下生长3~4 d。人胃黏膜细胞Ges-1 及胃癌细胞BGC-823 培养条件为37℃、5% CO2,一般生长2 d。实验所用细菌和细胞均自复苏后传代3 次。收集对数生长期细胞,用不含抗生素的培养基将细胞重悬,以1×105/孔接种于6 孔板中,培养12 h 使细胞贴壁完成。收集对数生长期的Hp 菌株,调整菌液浓度为1 OD600(1×108CFU/mL),加入200 µL 菌液至细胞6 孔板中,使细菌与细胞培养比例为200∶1,对照组加入等体积培养基。细菌感染时间设定为12 h、24 h 和48 h,每组设置3 个重复孔。
4 Western-blot 检测HSP70蛋白 表达 Hp 感 染的Ges-1 和BGC-823 细胞按照分组提取总蛋白。采用BCA 法蛋白定量并加热变性。SDS-PAGE 凝胶电泳,使用湿转法转至PVDF 膜。5%脱脂奶粉室温封闭2 h,一抗在4℃孵育过夜,稀释倍数Anti-HSP70 (Abcam,ab181606)为1∶3 000,Anti-GAPDH(Abcam,ab8245)为1∶2 000。次日用TBST洗膜15 min×3 次;二抗在常温下孵育2 h,TBST洗膜10 min×3 次。HRP 化学发光法显色。Image J软件定量各条带灰度值。
5 RT-PCR和qPCR 检测HSP70 基因mRNA 表达 Hp 感染的Ges-1 和BGC-823 细胞按照分组提取总RNA,并用琼脂凝胶电泳和核酸检测仪测定RNA 完整性、浓度和纯度,并反转录为cDNA,作为后续PCR 和qPCR 的扩增模板。PCR 和qPCR 使用的引物由上海生工设计合成,HSP70蛋白的引物序列如下:HSPA1A-F:5’-ACTTTG ACAACAGGCTGGTGAACC-3’;HSPA1A-R:5’-TCGGAACAGGTCGGAGCACAG-3’。以人GAPDH作为内参,引物序列如下:GAPDH-F:5’-AGA AGGTGGTGAAGCAGGCGTCG-3 ’ ;GAPDH-R:5’-CCTTGGAGGCCATGTGGGCC-3’。PCR 反应条件如下:HSP70:95℃ 10 min;95℃ 30 s,53℃30s,72℃ 30s,27 个 循 环;72℃ 5min。GAPDH:95℃ 10min;95℃ 30s,60℃ 30s,72℃ 30 s,27 个循环;72℃ 5 min。扩增产物用琼脂凝胶电泳观察反应终点时PCR 产物量。Image Lable 软件定量各条带灰度值。qPCR 反应使用Biorad CFX96 完成,反应条件如下:95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,40 个循环;熔解曲线设置0.5℃/s 缓慢升温至95℃。
6 免疫组织化学(IHC)染色 将组织芯片常规脱蜡水化,高压修复抗原。加内源性过氧化物酶阻滞剂,室温孵育10 min。加适量稀释好的一抗工作液,37℃孵育3 h。加酶标二抗工作液,室温孵育20 min。滴加DAB 显色,清水中终止显色,苏木素染液中复染2 min,1%盐酸乙醇中分化。常规脱水、透明、封片。染色的观察用颜色深浅表示表达强度:浅黄色为低度表达,深黄色为中度表达,棕黄色为高度表达。
7 统计学分析 应用SPSS22.0 软件进行分析。实验所测数据以±s表示,各组间采用单因素方差分析比较,两两比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
结果
1 Hp 感染人胃黏膜细胞和胃癌细胞的HSP70 蛋白表达 Hp ATCC 26695 分别与人胃黏膜细胞Ges-1、胃癌细胞BGC-823共培养12h、24h、48 h 后,分别采集细胞的蛋白样本。Western-blot结果显示,同对照组相比,Hp 感染后的Ges-1 细胞和BGC-823 细胞HSP70 蛋白的表达随感染时间延长逐渐降低,其中Ges-1 细胞在24 h 和48 h 的表达水平同对照组相比显著下降,而BGC-823 细胞则在48 h 显著下降(P<0.05,图1)。Westernblot 结果也显示,在无Hp 感染的情况下,胃癌细胞BGC-823 的HSP70 蛋白表达水平高于人胃黏膜细胞Ges-1(图2)。
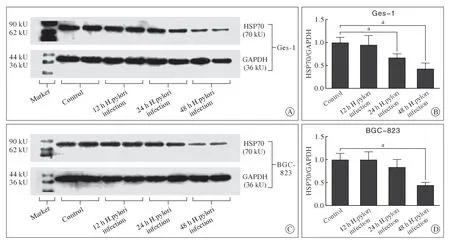
图1 Hp 感染12 h、24 h、48 h 时对胃黏膜细胞(Ges-1)和胃癌细胞(BGC-823)HSP70 蛋白表达的影响(Western-blot,A、C,n=2)及定量分析结果(B、D,n=3,aP<0.05)Fig.1 Effects of Hp infection on HSP70 protein expression in gastric mucosa cells (GES-1) and gastric cancer cells (BGC-823) at 12 h,24 h and 48 h detected by western-blot (A,C,n=2) and quantitative analysis (B,D,n=3,aP<0.05)
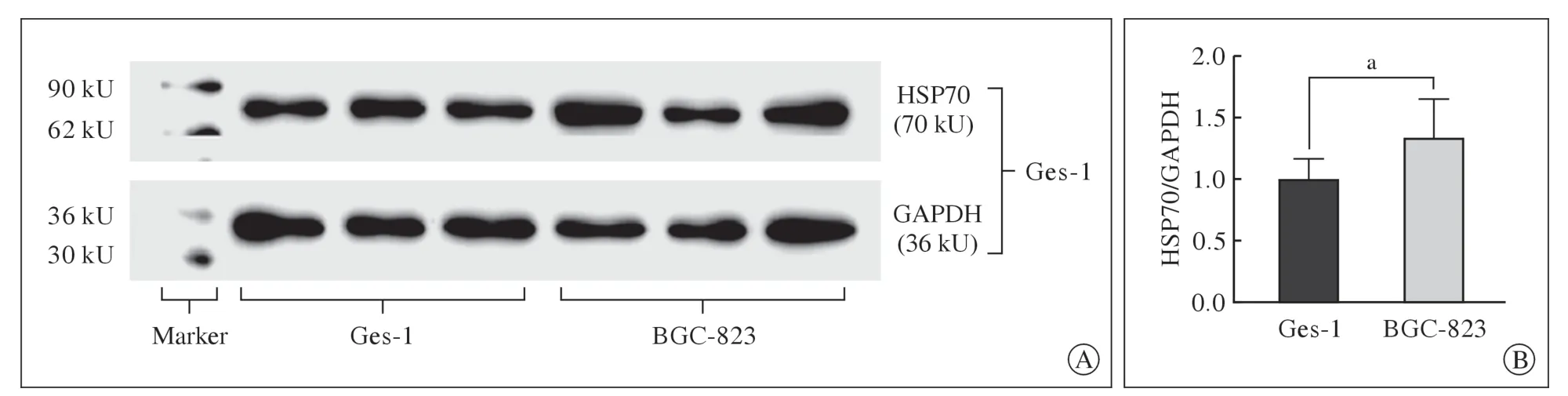
图2 胃黏膜细胞(Ges-1)和胃癌细胞(BGC-823) HSP70 蛋白表达的比较A:Western-blot 结果;B:定量分析结果(n=3)Fig.2 Comparison of HSP70 protein expression in gastric mucosa cells (GES-1) and gastric cancer cells (BGC-823)A:Western-blot analysis;B:quantitative analysis (n=3)
2 Hp感染人胃黏膜细胞和胃癌细胞的HSP70 mRNA 表达 RT-PCR 结果显示,同对照组相比,Hp 感染后的Ges-1 细胞和BGC-823 细胞均出现了HSP70mRNA 表达下降,Ges-1细胞在感染12 h后下调最为显著,而BGC-823 细胞在24 h 的表达水平最低(P<0.05,图3),而至48 h 表达均出现回升。qPCR 结果也显示了相同的HSP70 mRNA变化趋势(图4)。
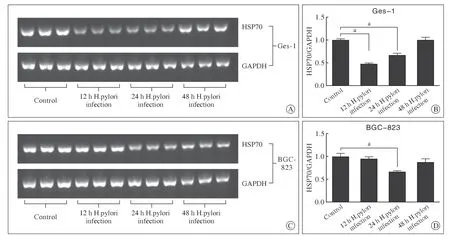
图3 Hp 感染12 h、24 h、48 h 时对胃黏膜细胞(Ges-1)和胃癌细胞(BGC-823) HSP70 mRNA 表达的影响(A、C:RT-PCR 结果)及定量分析结果(B、D,n=3,aP<0.05)Fig.3 Effects of Hp infection on HSP70 mRNA expression in gastric mucosa cells (GES-1) and gastric cancer cells (BGC-823) at 12 h,24 h and 48 h detected by RT-PCR (A,C) analysis and quantitative analysis (B,D,n=3,aP<0.05)
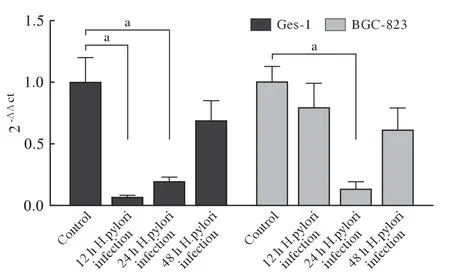
图4 Hp 感染12 h、24 h、48 h 时对胃黏膜细胞(Ges-1)和胃癌细胞(BGC-823) HSP70 mRNA 表达的影响(qPCR)(n=3,aP<0.05)Fig.4 Effects of Hp infection on HSP70 mRNA expression in gastric mucosa cells (GES-1) and gastric cancer cells (BGC-823) at 12 h,24 h and 48 h detected by qPCR (n=3,aP<0.05)
3 Hp 感染的胃黏膜腺体HSP70 蛋白表达 采用人胃组织芯片进行Hp 和HSP70 的IHC 染色,结果发现Hp 染色的阳性信号位于小凹和黏膜表面,表现为颗粒状棕黄色信号(图5A),观察同一腺体的HSP70 免疫组化染色,发现胃腺上皮细胞的胞质和胞核可见均匀的浅黄色-深黄色阳性信号,胞核信号多强于胞质(图5B)。与Hp 阴性的腺体对比(图6),Hp 感染的腺体细胞其HSP70 表达强度无明显变化。在Hp 阴性的正常胃黏膜腺体中,HSP70 蛋白表达在不同类型细胞的表现完全不同:胃泌酸腺体(固有腺)细胞和腺颈部(增殖带)的HSP70 蛋白表达阳性,其细胞胞质与胞核均表现出均匀的浅黄色信号,胞核呈较大的圆形,且能看到核仁;而成熟的胃小凹上皮细胞胞核呈狭长、细小形状,其HSP70 蛋白表达阴性(图6)。
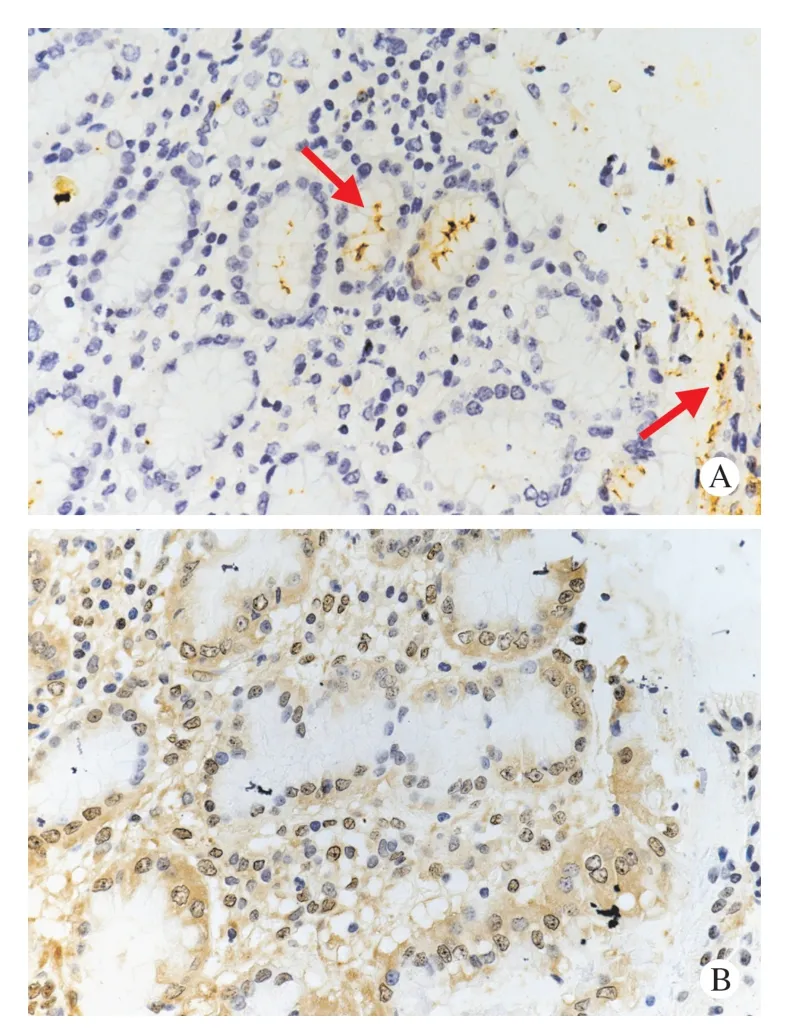
图5 组织芯片的免疫组织化学(IHC)染色,显示HSP70 蛋白在Hp 感染阳性腺体的表达(400×)A:IHC 染色检测Hp 感染,胃黏膜表面和小凹内呈颗粒状棕黄色信号,提示Hp 感染阳性;B:与A 为同一胃黏膜组织的连续切片,相同视野下IHC 染色检测HSP70 表达,染色结果显示腺上皮细胞的胞质和胞核可见均匀的浅黄色-深黄色阳性信号,胞核信号多强于胞质Fig.5 Immunohistochemistry (IHC) staining of tissue chips showed the expression of HSP70 protein in Hp positive glands (400×)A:Hp infection was detected by IHC staining of human gastric mucosa.The staining results showed that the surface and pits of gastric mucosa showed a granular brown-yellow signal,suggesting positive Hp infection;B:continuous sections of the same gastric mucosa tissue as A,HSP70 expression was detected by IHC staining under the same visual field.The staining results showed that there were uniform light yellow to dark yellow positive signals in the cytoplasm and nucleus of glandular epithelial cells,and the nucleus signal was stronger than the cytoplasm
4 胃癌组织的HSP70 蛋白表达 采用IHC 检测可以观察到胃癌细胞的HSP70 染色主要表现为胞质与胞核的均匀深黄色信号(图7),其表达强度明显高于正常胃黏膜的腺体细胞,不论胃黏膜腺体是否有Hp 感染(图6)。
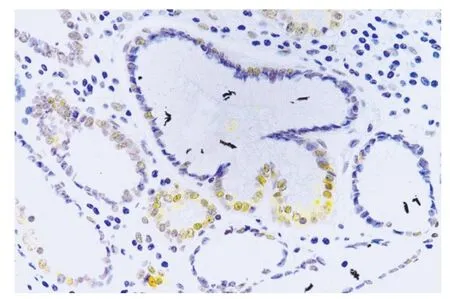
图6 正常胃黏膜腺体,IHC 染色检测HSP70 表达,染色结果显示泌酸腺和增殖细胞胞质和胞核可见浅黄色-深黄色阳性信号,而胃小凹上皮细胞染色阴性(400×)Fig.6 HSP70 expression was detected by IHC staining of normal gastric mucosa glands.The staining results showed light yellow to dark yellow positive signals in the cytoplasm and nucleus of acid-secreting glands and proliferating cells,while the epithelial cells of gastric fovea were negative (400×)
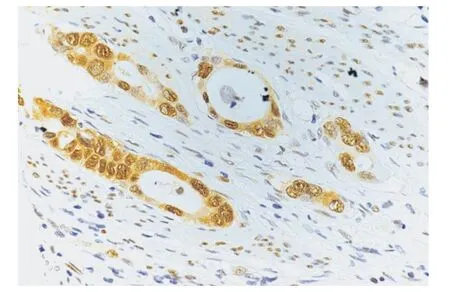
图7 人的胃癌组织切片,IHC 染色检测HSP70 表达,染色结果显示腺癌细胞的胞质和胞核呈深黄色阳性信号(400×)Fig.7 HSP70 expression was detected by IHC staining of human gastric cancer tissue.The staining results showed dark yellow positive signals in the cytoplasm and nucleus of adenocarcinoma cells (400×)
讨论
已知Hp 感染可导致胃黏膜炎症,并通过破坏细胞凋亡和增殖的平衡、减少上皮细胞的迁移、减少胃黏膜内的血流量或血管生成来延缓胃黏膜的愈合,HSPs 可以逆转这些限制并促进胃黏膜的愈合[16]。HSP70 在细胞内扮演着分子伴侣的角色,在调节细胞生长、促进增殖和抗凋亡方面发挥重要作用[17]。
本研究证实了Hp 可以引起胃癌细胞HSP70蛋白和mRNA 的表达降低,还发现Hp 感染正常胃黏膜细胞(Ges-1)后同样可以导致HSP70 蛋白和mRNA 的表达下降。文献报道,Hp 感染一旦致胃黏膜细胞损伤产生肠化等病变后,该细菌将主动迁移至其他正常胃黏膜细胞定植继续生存[18]。我们的结果发现,感染Hp 后的两种细胞HSP70蛋白和mRNA 表达仅一过性下调,这个下调的时间窗可能有利于细菌的进一步定植。Yeo 等[15]的研究发现在Hp 下调了细胞的HSP70 表达后,使用药物或对细胞无损伤的热休克干预可恢复HSP70的表达水平,进而抑制细胞iNOS 基因表达,减少NO 的产生对胃组织的损伤。根据这样的结果,如果能够在细胞HSP70 蛋白发生下调的时间窗内给予干预,使HSP70 蛋白表达维持甚至上调,将可能减少Hp 的定植及其对胃黏膜的损伤。
通过对比HSP70 蛋白与mRNA 下调的特征,发现从mRNA 水平的下调到蛋白质水平的下调,至少需要12h,我们猜测这个时间间隔不仅是基因转录和翻译过程所必需,而且与Hp 生长需要较长的倍增时间有关。关于Hp 感染下调胃癌细胞HSPs 的表达已有一些文献报道。研究发现cagA(+/-)的Hp 均能下调宿主细胞HSP70 的表达,而联合外源性cagA 蛋白可得到更显著的效果[19]。Lang 等[20]指出,与野生株相比,cagA 基因敲除的Hp 并不能下调HSPs 的表达,然而cagA 基因的表达载体转入细胞后也未能下调细胞表达HSPs,说明cagA 基因确实参与了宿主细胞HSPs的下调,但不是决定性的因素。国内也有研究报道Hp 阳性的萎缩性胃炎患者的胃黏膜组织HSP70表达略低[21]。目前,Hp 调节宿主细胞HSPs 表达的机制远未阐明,本研究发现的HSP70 表达动态改变时间窗现象为进一步研究Hp-宿主互动提供了空间。
研究表明,HSP70 在多种肿瘤组织中呈现高表达的状态,并与肿瘤的分级、转移、化疗耐药和不良预后相关[9,22-23]。因此,寻求抑制HSPs 通路的方法可能会成为治疗癌症的新途径。本研究也证实了HSP70 蛋白在胃癌组织中高表达。同时我们也发现,在正常胃黏膜腺体中,HSP70 蛋白表达在不同的胃黏膜腺体、不同生长和分化状态的胃黏膜细胞中有明显差异,表现为胃泌酸腺体(固有腺)细胞和增生活跃的小凹上皮细胞HSP70蛋白表达阳性,成熟的胃小凹上皮细胞或黏液腺上皮细胞表达阴性。目前没有关于HSP70 蛋白在胃黏膜组织分布规律的文献报道。但有研究发现在人的子宫内膜,增殖期的基底腺细胞大量表达HSP70 蛋白,而在功能性细胞中HSP70 不表达,在分泌期基底细胞和功能细胞——腺细胞均显著表达[24]。也有研究提出小鼠的生殖细胞在减数分裂时期HSPa2 蛋白表达量最高,在非分裂时期表达降低[25-26]。HSPs 的表达可能有助于增生期细胞对外界不利环境的耐受。
本研究的局限:1)体外培养并不能完全模拟体内的感染环境;2)与Hp 共培养48h 后的细胞状态明显下降,无法进行更长时间的观察研究,虽然在mRNA 水平看到了HSP70 表达的回升,但无法检测到HSP70 蛋白表达回升的时间点,也无法评估Hp 对宿主细胞更长作用周期的动态影响。
总之,本研究发现体外模拟Hp 感染胃黏膜细胞可以使细胞的HSP70 出现一过性表达降低,正常胃黏膜细胞出现表达降低反应的时间略早于胃癌细胞;正常胃黏膜组织中不同类型的腺体细胞具有与感染组织不同的HSP70 蛋白表达特征。这些发现为将来深入探讨Hp 感染的致病机制提供了新的思路。

