室管膜下区受累胶质母细胞瘤的MRI 影像学特征及其预后分析
刘若愚,刘明航,攸 娜,赵 悦,伊柯帆,赵 恺,孙国臣,许百男
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 神经外科医学部,北京 100853
胶质瘤是最常见的颅内原发恶性肿瘤。在我国,脑胶质瘤的发病率为(5~8)/100 000,5 年病死率在全身性肿瘤中仅次于胰腺癌和肺癌。其中胶质母细胞瘤(glioblastoma,GBM)预后最差,患者在接受标准化治疗方案后中位生存期仅为14 个月左右[1]。此类肿瘤的MRI 典型表现为不规则环形强化,同时伴有中心坏死和瘤周水肿。室管膜下区(subventricular zone,SVZ)为胼胝体下方沿侧脑室外侧壁呈条带状分布的薄层脑区,该区域同时也是成年人脑内神经干细胞(neural stem cells,NSCs)最大的集中部位[2]。在GBM 肿瘤组织中包含了一部分具有干细胞特征的细胞亚群[3],这些细胞有自我更新、无限增殖、多向分化以及迁移的潜能,被称为胶质瘤干细胞(glioma stem cells,GSCs)。NSCs 与GSCs 具有诸多相似性,多种与NSCs 有关的信号转导通路,如参与维持神经干细胞未分化状态的Notch 通路、能够抑制神经发生并促进胶质细胞再生的骨形态发生蛋白通路以及与干细胞自我复制有关的Sonic Hedgehog 通路,在GSCs 中也同样发挥着重要作用[4]。这种相似性提示胶质瘤的发生可能与室管膜下区中的神经干细胞密切相关。2018 年的一项基础研究通过对胶质瘤患者脑组织进行单细胞测序和激光显微切割分析并对小鼠模型的基因组编辑发现,室管膜下区脑组织中含有胶质母细胞瘤驱动突变基因的神经干细胞是一种胶质母细胞瘤的起源细胞[5]。相关研究还指出,初次确诊时MRI 中存在室管膜下区受累的胶质母细胞瘤患者表现出了更差的临床预后[6-7]。综上所述,影像学上肿瘤与室管膜下区接触的背后提示了一种恶性程度更高的胶质母细胞瘤亚型,这类肿瘤的高度恶性表现与室管膜下区中富含的神经干细胞密切相关,并可能有着独特的分子生物学特征。对室管膜下区受累胶质母细胞瘤相关特征性表现的深入研究或将为GBM 的个体化诊疗带来新的思路。本研究回顾性分析了在解放军总医院第一医学中心神经外科行手术治疗的GBM 患者,根据术前MRI 中肿瘤与室管膜下区有无影像学接触对患者进行分组,旨在探索室管膜下区受累胶质母细胞瘤的MRI 影像学特征及其与患者预后的关系。
资料与方法
1 资料 回顾性分析2016 年1 月-2018 年12 月在解放军总医院第一医学中心神经外科住院并行手术治疗的胶质母细胞瘤病例。纳入标准:1)初治胶质母细胞瘤患者,年龄≥18 岁;2)肿瘤位于小脑幕上,术后完成替莫唑胺同步放化疗。排除标准:1)既往低级别胶质瘤或其他颅内肿瘤病史;2)瘤卒中急诊入院或术后昏迷自动出院者;3)影像学资料不完整或丢失。
2 MRI 扫描 患者于术前1~2d 行头部MRI 扫描,平扫序列包括T1WI、T2WI、T2-FLAIR。采用Siemens Verio 1.5T 超导MR 扫描仪,扫描参数:T1WI(GRE)TR1650ms,TE3.02ms,层厚及层间隔分别为1.0mm、1.5mm,FOV250mm×250mm,矩阵为256×256;T2WI(TSE)TR5400ms,TE98ms,层厚及层间隔分别为3.0mm、1.5mm,FOV230mm×230mm,矩阵256×256。T2WIFLAIR,TR9000ms,TE86.0ms,层厚及层间隔分别为5.0mm、1.5mm。增强扫描对比剂采用Gd-DTPA(BAYER,Magnevist)静脉注射,0.1mmol/kg,流 率3.0mL/s,扫描参数与平扫一致。
3 影像指标判读 纳入8 项预后相关影像指标进行特征分析,包括强化程度、强化形式、瘤周水肿程度、坏死、囊变、多灶性表现、病变是否跨越中线以及肿瘤大小(图1,图2)[8-10]。判定标准:1)强化程度:以T1W1 增强序列中海绵窦信号作为参考标准,强化程度低于海绵窦为Ⅰ度强化,强化程度与海绵窦近似或一致为Ⅱ度强化。2)强化形式:根据强化病灶影像学表现形式划分为均匀强化或不均匀强化。3)瘤周水肿程度:测量T2WI 扫描序列中肿瘤最大水肿层面宽度,并进行分度。最大水肿带宽度≤1.5cm 者为Ⅰ度水肿,最大水肿带宽度>1.5 cm 者为Ⅱ度水肿。4)坏死:定义为肿瘤组织中边界不规则的低密度区域,T1WI 信号稍高于脑脊液,增强扫描无强化或轻度强化。5)囊变:定义为T1WI 低信号、T2WI 高信号,信号强度与脑脊液相近或一致的类球型囊腔,与周围组织边界清晰,增强扫面可见轻度强化或不强化的囊壁。6)多灶性表现:多灶性病变被定义为多发强化病灶或与原发增强病灶不连续的异常T2flair 信号。7)病变是否跨越中线:定义为增强T1 序列或T2flair 序列生长跨越中线的肿瘤异常信号。8)肿瘤大小:对磁共振增强病灶进行三维重建后测量其最大直径。由两名5 年以上临床工作经验的神经外科医师在双盲法下通过PACS 平台对上述影像学指标进行判读。对于二者意见不统一的情况,由另一名高级职称神经外科医师加入判定,经讨论达成一致结论。
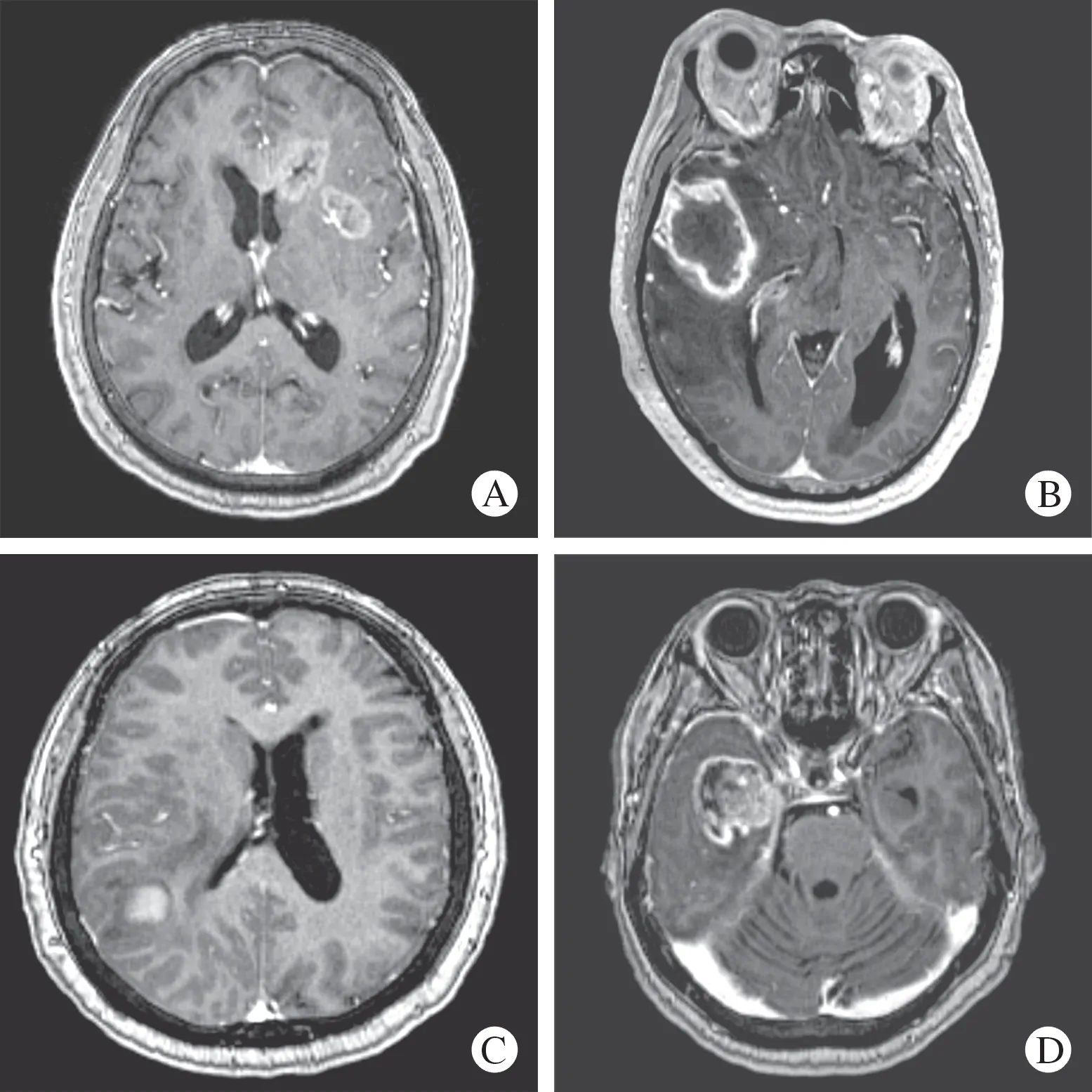
图1 肿瘤强化程度及强化形式示意图A:Ⅰ度强化;B:Ⅱ度强化;C:均匀强化;D:不均匀强化Fig.1 Extent and patterns of tumor enhancementA:slight enhancement;B:obvious enhancement;C:homogenous enhancement;D:inhomogeneous enhancement
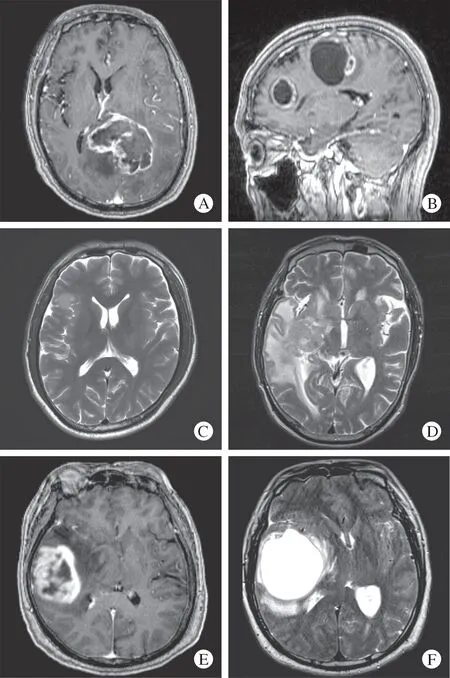
图2 相关影像学指标判读A:肿瘤生长跨越中线;B:多灶性病变;C:Ⅰ度瘤周水肿;D:Ⅱ度瘤周水肿;E:肿瘤内坏死;F:肿瘤内囊变Fig.2 Interpretation of related imaging indicatorsA:tumor grows across the midline;B:multifocal lesions;C:peritumoral edema,grade I;D:peritumoral edema,grade Ⅱ;E:intra-tumoral necrosis;F:intra-tumoral cystic transformation
4 分组及分析指标 1)根据MRI 中肿瘤增强病灶与室管膜下区有无接触将所有入组患者划分为室管膜下区受累与未受累两组(图3),室管膜下区被定义为距离侧脑室外侧壁(包括双侧颞角)5 mm内的脑区[11-12]。2)通过电子病历系统收集患者相关资料,包括性别、确诊年龄、术前KPS 评分、手术记录、常规病理检查结果。3)将手术切除程度分为全切(gross total resection,GTR)及次全切(subtotal resection,STR),即当 术 后增强核磁扫描提示存在一个或多个体素的对比增强表现时,判定肿瘤次全切除,反之则认为肿瘤全切[13]。4)对入组患者进行电话或门诊随访,总生存期(overall survival,OS)为手术时间至患者死亡时间或末次随访时间,无进展生存期(progression-free survival,PFS)为手术时间至影像学复发时间或死亡时间或末次随访时间。肿瘤复发定义为磁共振扫描提示出现新发病变或原病变进展。
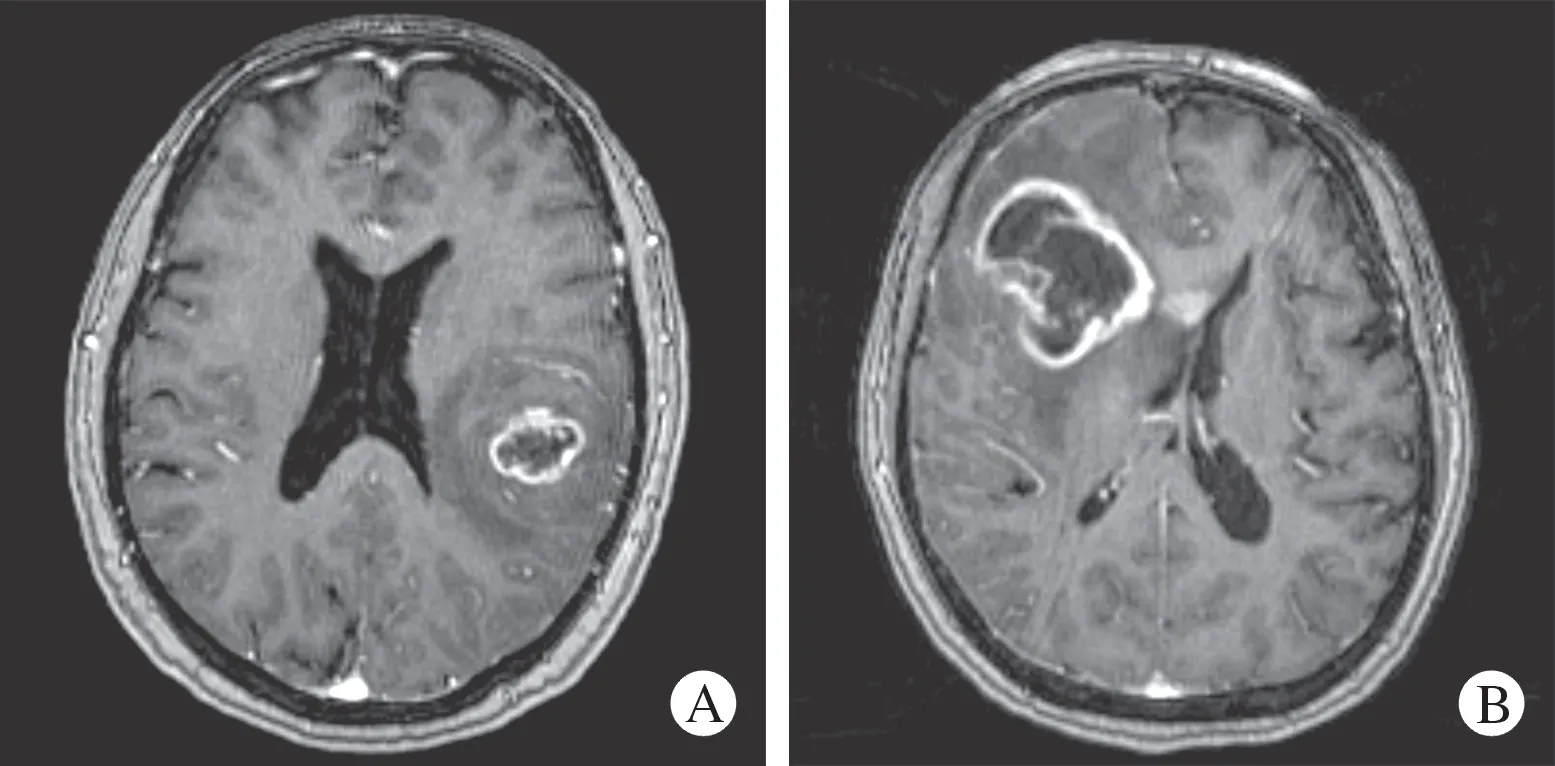
图3 根据术前MRI 检查中肿瘤增强病灶与室管膜下区的位置关系将患者分为两组A:室管膜下区未受累胶质母细胞瘤;B:室管膜下区受累胶质母细胞瘤Fig.3 The patients were divided into two groups according to the relationship between contrast-enhanced lesion and subventricular zone in preoperative MRIA:glioblastoma without subventricular zone contact;B:glioblastoma with subventricular zone contact
5 统计学分析 应用SPSS26.0 软件对数据进行统计学分析。符合正态分布的连续变量以±s表示,两组间比较采用成组t检验。非正态分布的数据采用中位数表示。分类变量采用频数和百分比表示,两组间比较采用χ2检验。采用Kaplan-Meier法分别绘制两组患者总生存期及无进展生存期的生存曲线,组间比较采用log-rank 检验,并采用单因素Cox 回归模型计算风险比(hazard ratio,HR)。采用Cox 比例风险模型进行多因素生存分析。P<0.05 为差异有统计学意义。
结果
1 两组患者临床特征比较 共134 例患者纳入本研究,13 例在数据库关闭时(2021 年9 月25 日)仍存活。患者以头痛头晕、肢体力弱、失语及癫痫发作等为主要临床表现。其中室管膜下区受累组99 例(74%),室管膜下区未受累组35 例(26%)。两组患者在性别、确诊年龄、术前KPS 评分、手术切除程度、IDH 突变、瘤周水肿程度、肿瘤内坏死、肿瘤强化形式及强化程度方面的差异无统计学意义。见表1。
2 两组MRI 特征比较 两组肿瘤内囊变(32.3%vs54.1%,P=0.045)、肿瘤生长跨越中线(39.4%vs5.7%,P<0.001)、多灶性表现(34.3%vs8.6%,P=0.003)及肿瘤大小[(5.88±1.27) cmvs(3.32±1.62) cm,P<0.001]差异有统计学意义(表1)。其中,MRI中存在室管膜下区受累的胶质母细胞瘤表现出了肿瘤内较少发生囊变、生长更易跨越中线、多灶性病变的影像学特征,且肿瘤直径更大。

表1 两组临床资料比较(n,%)Tab.1 Comparison of clinical characteristics between the two groups (n,%)
3 两组中位生存期比较 室管膜下区受累组的中位总生存期及中位无进展生存期分别为13 个月和7 个月,而未受累组的中位总生存期及中位无进展生存期分别为25 个月和17 个月,两组差异有统计学意义(P<0.001)。见图4。
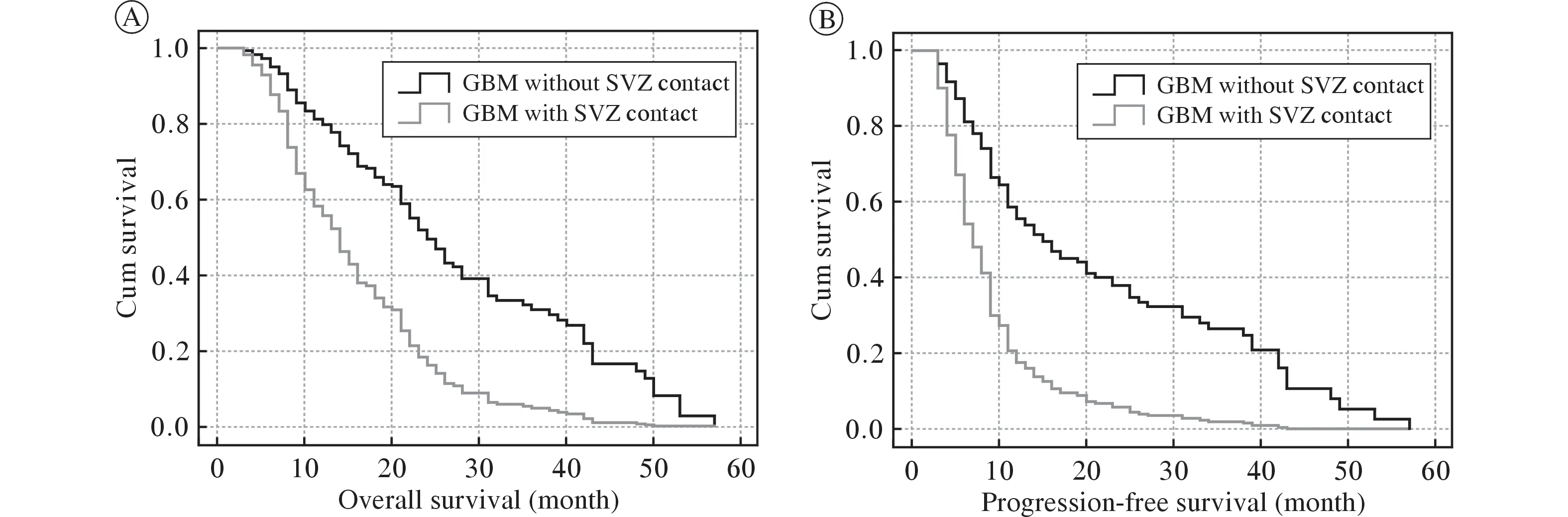
图4 室管膜下区受累与未受累组胶质母细胞瘤患者的总生存期(A)及无进展生存期(B)KM 曲线Fig.4 Kaplan-Meier curves of overall survival (A) and progression-free survival (B) in glioblastoma with or without subventricular zone contact
4 影响患者预后的单因素分析 单因素分析结果显示,确诊年龄、手术切除程度、IDH 突变状态、多灶性表现、肿瘤内有无囊变、肿瘤大小及室管膜下区是否受累对本研究中患者总生存期及无进展生存期的影响差异有统计学意义。肿瘤生长是否跨越中线仅对患者总生存期的影响差异有统计学意义。见表2。
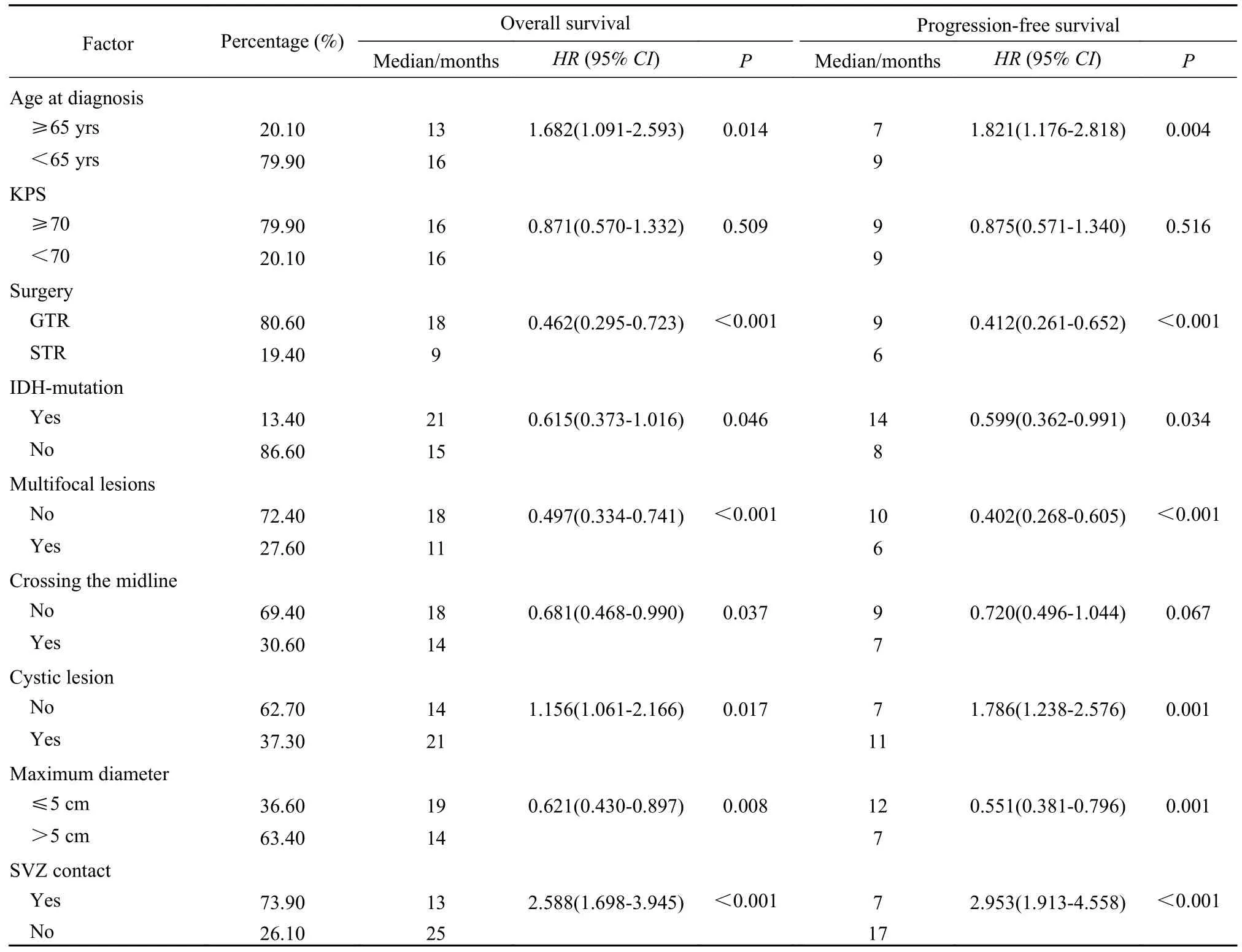
表2 胶质母细胞瘤患者影响预后的单变量分析Tab.2 Univariate survival analysis for several prognostic factors influencing the survival of glioblastoma patients
5 影响患者预后的多因素分析 将单因素分析中对本组患者生存预后有影响的指标纳入多因素Cox 比例风险回归模型。分析结果显示,在对确诊年龄、手术切除程度、IDH 突变状态、生长是否跨越中线、有无多灶性表现、瘤内有无囊变及肿瘤大小进行调整后,室管膜下区是否受累对患者总生存期及无进展生存期的影响差异仍有统计学意义(P<0.001),提示室管膜下区受累是影响胶质母细胞瘤患者总生存期及无进展生存期的独立危险因素。见表3。
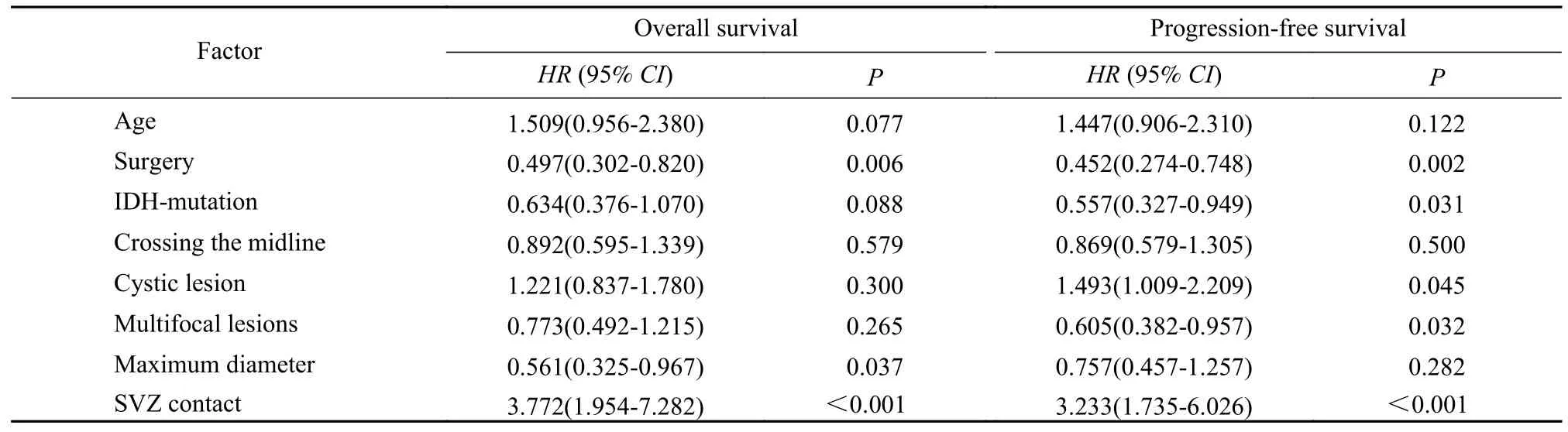
表3 胶质母细胞瘤患者总生存期及无进展生存期的多变量 Cox 回归模型Tab.3 Multivariate Cox regression model of overall survival and progression-free survival of the glioblastoma patients
讨论
本研究中单因素分析结果提示,确诊年龄、手术切除程度、IDH 突变状态、有无多灶性表现、瘤内有无囊变、肿瘤大小以及室管膜下区是否受累对患者总生存期及无进展生存期的影响差异有统计学意义。在多因素Cox 比例风险回归模型中对上述因素进行调整后,室管膜下区是否受累对GBM 患者OS 及PFS 的影响差异仍有统计学意义,由此确认了室管膜下区受累是一项影响胶质母细胞瘤患者总生存期及无进展生存期的独立危险因素。
该结果与近年来国内外研究结果相类似。一项关于胶质母细胞瘤短期存活者(生存期在12 个月以内)及长期存活者(生存期在3 年以上)的对照研究指出,短期存活者组中肿瘤累及室管膜下区的比例显著高于长期存活者组[7]。2019 年德国的一项研究选取285 名IDH1 野生型GBM 患者进行生存分析,结果表明室管膜下区受累是更差的总生存期和复发后生存期的独立预测因素[6]。2020 年,美国的一组病例对照研究进一步分析了胶质母细胞瘤距室管膜下区距离与患者生存预后的关系,结果提示只有在GBM 与室管膜下区存在影像学接触时患者的总生存期显著降低,而与距离远近无关[14]。相关研究还指出,室管膜下区胶质母细胞瘤具有更大的肿瘤体积,这可能与更强的肿瘤增殖能力、更快的肿瘤生长速度有关[15-17],这亦与本研究结果相吻合。此外,2019 年的一项单中心研究认为,胶质母细胞瘤累及室管膜下区与患者治疗后脑积水以及软脑膜播散发生独立相关[18]。以上结果均提示室管膜下区胶质母细胞瘤不仅是影像学上的单纯接触,存在该区域受累的肿瘤其恶性程度更高,预后更差。
胶质母细胞瘤作为高度异质性的中枢神经系统恶性肿瘤,具有不同的起源和进展机制。远隔部位脑组织起源的胶质瘤可能在初次诊断前已累及室管膜下区,因此室管膜下区受累胶质母细胞瘤亦可能是其他部位高度恶性肿瘤快速生长侵袭的结果,仅影像学上的室管膜下区受累并不能作为研究肿瘤起源的直接证据。尽管如此,通过影像学特征对室管膜下区胶质母细胞瘤的定义和研究仍有着重要的临床指导意义。如前文所述,当前研究已发现室管膜下区受累是一项影响患者生存预后的独立危险因素。相关研究还指出,室管膜下区受累胶质母细胞瘤更常表现为多灶性病变,且该类肿瘤更有可能出现与原发病变不连续的远处复发[19-20]。另一研究团队随后报道,累及室管膜下区的胶质母细胞瘤表现出了侵袭性更强的切向和多极迁移模式,由此假设正是这种独特的迁移模式导致了室管膜下区受累胶质母细胞瘤更常见的多灶性表现[21]。本研究对室管膜下区胶质母细胞瘤影像学特征的观察亦得到了类似结果。除此之外,我们进一步纳入了其他影响患者预后的影像学结果进行分析。结果提示,存在室管膜下区受累的胶质母细胞瘤在MRI 中表现出肿瘤内较少发生囊变、生长跨越中线、多灶性病变的特征,且肿瘤直径更大。以上特征提示,此类肿瘤可能具有更强的侵袭性和增殖活性。同时这也为肿瘤治疗带来了挑战,部分多灶性病变通过一次手术达到肿瘤全切难以实现,而肿瘤残留则意味着更差的生存预后。对于此类多灶性病变的治疗,需要我们深入研究肿瘤进展模式背后的分子生物学机制,试图找到新的治疗方案以弥补手术无法全切的局限。
本研究也存在一定的局限性:1)作为一项单中心回顾性研究,存在一定的选择偏倚;2)相对较小的样本量;3)仅纳入免疫组化检查中的IDH突变状态进行分析,未能加入相关分子病理学检查结果,如MGMT 启动子区甲基化状态等,这也是我们下一步准备继续完善的研究内容之一。
综上所述,本研究证实了室管膜下区受累是一项影响胶质母细胞瘤患者生存预后的独立危险因素。此外相较室管膜下区未受累组,MRI 中室管膜下区受累的胶质母细胞瘤表现出了肿瘤内较少发生囊变、生长更易跨越中线、多灶性病变且肿瘤直径更大的特征,从影像学上提示了一种具有更强增殖活性及侵袭性的肿瘤发生进展模式。这些宏观水平的临床观察提示我们,室管膜下区与胶质母细胞瘤的影像联系的背后可能反映了一种恶性程度更高的肿瘤亚型。因此针对室管膜下区的治疗手段或成为胶质母细胞诊疗发展的一个重要方向,如将室管膜下区纳入放疗靶区或对于室管膜下区微环境成分的靶向治疗。在后续的工作中,亦需要更多的基础研究对室管膜下区在肿瘤发生及进展中的作用进行深入探索,以发现室管膜下区受累胶质母细胞瘤临床特征背后的分子生物学机制并以此指导临床诊疗实践。

