黄花倒水莲花中黄酮苷类成分的分离、鉴定及抗氧化活性研究
李根 潘争红 宁德生 李连春 符毓夏 李海云
摘要:该研究采用硅胶、Sephadex LH20柱色谱和HPLC进行分离纯化,并结合1DNMR波谱数据和文献比对,研究了黄花倒水莲花中黄酮类成分及抗氧化活性。结果表明:(1)从黄花倒水莲花95%乙醇提取物的乙酸乙酯部位中分离鉴定出6个黄酮苷类化合物,即紫云英苷(1)、槲皮素3OβD葡萄糖苷(2)、槲皮素3Oβ吡喃木糖苷(3)、槲皮素3OαL吡喃阿拉伯糖苷(4)、异鼠李素3Oβ葡萄糖苷(5)、芦丁(6),其中化合物1-6均为首次从该植物中分离得到。(2)分别采用DPPH·自由基清除法及FRAP法对花的不同极性部位和所获得化合物进行总抗氧化能力评价,结果显示化合物1-6均表现出较好的抗氧化作用,其中化合物4的总抗氧化能力达到(4.533±0.13)mmol·g1(Vc为5.951±0.25 mmol·g1)。该研究结果不仅丰富了黄花倒水莲花的物质基础,而且为其今后的综合开发利用提供了科学依据。
关键词: 黄花倒水莲, 化学成分, 黄酮苷, 结构鉴定, 抗氧化活性
中图分类号:Q946.8
文献标识码:A
文章编号:10003142(2022)05079006
Isolation, identification and antioxidant activity of the
flavonoid glycosides from Polygala fallax flower
Abstract:To study the chemical constituents and antioxidant activity of the flavones in flowers from the Polygala fallax. Six compounds were isolated and purified by silica gel, Sephadex LH20 column chromatography and preparative high performance liquid chromatography (HPLC) from the ethyl acetate fraction of 95% ethanol extract of P. fallax. Combined with the 1DNMR spectral data and literature comparison. The results were as follows: (1) Their structures were identified as kaempferol3glucoside (1), quercetin3OβDgalactoside (2), quercetin3Oβxylopyranoside (3), quercetin3OαLarabinoside (4), isorhamnetin3Oβglucopyranoside (5), rutin (6), respectively. Compounds 1-6 were obtained from the plant for the first time. (2) The antioxidant activities of different polar parts and compounds were evaluated by using DPPH· and FRAP methods. The results showed that all compounds had antioxidant capacity, of which the total antioxidant activity of Compound 4 was up to (4.533±0.13) mmol·g1 (vitamin C value was of 5.951±0.25 mmol·g1). Thus, the overall results not only enrich the material basis of flowers of P. fallax, but also provide scientific basis for its future development and utilization.
Key words: Polygala fallax, chemical constituents, flavonoid glycosides, structure identification, antioxidant activity
黃花倒水莲(Polygala fallax)为远志科远志属多年生落叶灌木,别名黄花参、观音串、鸭仔兜等,集食用、药用和观赏于一身,是中国特有物种,也是瑶、苗、壮等少数民族常用的药食同源中药材。据资料记载,黄花倒水莲常以根入药,其具有抗炎、调脂、增强免疫力、抗氧化、抗衰老等多种生物活性(张嫦丽等,2017;陈家宝等,2018),临床上常用于治疗产后体弱体虚、风湿骨痛、肾虚腰痛、高血脂症和急慢性肝炎等疾病(梁启成等,2005;戴斌,2009),或配以扶芳藤、参三七研制出具有治疗糖尿病肾病、风湿骨痛等病症的复方制剂壮通饮(刘燕平等,2009)。这些功效与其含有丰富的皂苷、多糖、黄酮等成分密切相关(费希同等,2014;陈家宝等,2018)。
近年来,随着人们生活水平的不断提高和对健康生活的向往,花茶成为美容养颜和保健的一类新宠,越来越受到消费者的青睐,花茶市场消费量也逐年提高,如茉莉花茶,其年产量在11万吨,可见花茶未来的市场前景十分广阔。黄花倒水莲作为药食两用的植物,其花的花序大、花期长、产量高,非常适合作为花茶使用。但是,由于黄花倒水莲花的物质基础和活性等相关研究鲜有报道,致使其开发利用仍停留在粗加工水平,难以实现资源物尽其用。因此,本课题组通过开展黄花倒水莲花的化学成分及其抗氧化活性研究,首次从其活性部位中分离得到6个黄酮苷类化合物,并且这些化合物均表现出较好的抗氧化作用,研究结果不仅为黄花倒水莲花今后的开发利用奠定基础,而且也为该植物的综合利用提供科学依据。697B9528-575B-4F9E-B926-7C77DA6C1103
1材料与仪器
黄花倒水莲花采自广西贺州市昭平县,经广西壮族自治区中国科学院广西植物研究所潘争红研究员鉴定。凭证样品保存于广西植物功能物质研究与利用重点实验室。
AVANCE Ⅲ HD 500 MHz超导核磁共振波谱仪(TMS内标,瑞士Bruker公司);Agilent 1200高效液相色譜仪[赛默飞世尔科技(中国)有限公司],所用试剂为色谱纯;LC/MSITTOF质谱仪(日本岛津公司);柱色谱和薄层色谱所用硅胶(青岛海洋化工有限公司);Sephadex LH20凝胶(瑞士Amershan Biosciences公司);Tecan Spark多功能酶标仪;XS 205型精密分析天平(梅特勒-托利多仪器有限公司);总抗氧化能力检测试剂盒(FRAP法,上海碧云天生物技术有限公司),其余试剂均为分析纯(西陇化工股份有限公司)。
2提取与分离
粉碎干燥的黄花倒水莲花3.0 kg,按料液比1∶8加入95%乙醇,室温下浸提24 h,过滤,滤渣以上述方法重复提取2次,合并提取液,在60 ℃下减压浓缩得到浸膏1 300 g。先在浸膏中加适量水分散后,再依次加入石油醚、乙酸乙酯、正丁醇洗脱,得到石油醚(287 g)、乙酸乙酯(735 g)和正丁醇(209 g) 3个组分。
取乙酸乙酯组分685 g经大孔树脂(HDP100)分离,依次使用水及体积分数为20%、60%、80%及100%的甲醇洗脱,收集醇洗脱部位得到5个组分Fr.1~Fr.5,Fr.2经硅胶柱色谱分离纯化,以石油醚/乙酸乙酯(10∶1→0∶1)为洗脱剂得到4个组分Fr.2-1~Fr.2-4。Fr.2-2经半制备高效液相色谱分离(乙腈-水,体积比28∶72),得到化合物1(18.9 mg)、化合物2(20 mg)、化合物3(16.1 mg);Fr.2-3经硅胶柱反复纯化(二氯甲烷-甲醇=3∶1),得到化合物4(32 mg)和 化合物5(42 mg);Fr.2-4经Sephadex LH20柱色谱纯化,以氯仿-甲醇(1∶1)分离得到化合物6(28 mg)。
3结构鉴定
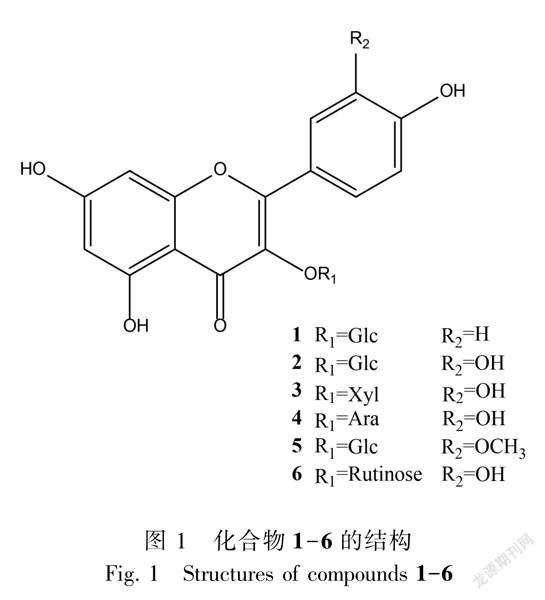
化合物1淡黄色粉末。HRESIMS m/z: 447.1172[MH]-, 分子式C21H20O11。1HNMR (500 MHz, CD3OD) δ: 8.04 (2H, d, J = 8.0 Hz, H2′, H6′), 6.88 (2H, d, J = 8.0 Hz, H3′, 5′), 6.36 (1H, s, H8), 6.18 (1H, s, H6), 5.23 (1H, d, J =7.0 Hz, H1″);13CNMR (125 MHz, CD3OD) δ: 158.5 (C2), 135.4 (C3), 179.3 (C4), 163.3 (C5), 100.1 (C6), 166.5 (C7), 94.8 (C8), 159.0 (C9), 105.7 (C10), 122.8 (C1′), 132.3 (C2′, 6′), 116.1 (C3′, 5′), 161.5 (C4′), 104.1 (C1″), 75.7 (C2″), 78.4 (C3″), 71.3 (C4″), 78.0 (C5″), 62.6 (C6″)。以上数据与文献(张彬若等,2020)报道的基本一致。故鉴定化合物1为紫云英苷。
化合物2黄色粉末。HRESIMS m/z: 465.1826[M+H]+, 分子式C21H20O12。1HNMR (500 MHz, CD3OD) δ: 7.72 (1H, s, H2′), 7.57 (1H, d, J = 8.5 Hz, H6′), 6.85 (1H, d, J =8.5 Hz, H5′), 6.36 (1H, s, H8), 6.18 (1H, s, H6), 5.23 (1H, d, J =7.0 Hz, H1′);13CNMR (125 MHz, CD3OD) δ: 158.2 (C2), 135.6 (C3), 179.2 (C4), 162.7 (C5), 99.9 (C6), 165.8 (C7), 94.7 (C8), 158.9 (C9), 105.5 (C10), 123.2 (C1′), 115.9 (C2′), 145.7 (C3′), 149.9 (C4′), 117.6 (C5′), 122.9 (C6′), 104.5 (C1″), 75.7 (C2″), 78.0 (C3″), 71.1 (C4″), 78.1 (C5″), 62.5 (C6″)。以上数据与文献(梅玉丹等,2020)报道的基本一致。故鉴定化合物2为槲皮素3OβD葡萄糖苷。
化合物3淡黄色粉末。HRESIMS m/z: 435.0854[M+H]+, 分子式C20H18O11。1HNMR (500 MHz, CD3OD) δ: 7.61 (1H, s, H2′), 7.58 (1H, d, J = 8.5 Hz, H6′), 6.85 (1H, d, J = 8.5 Hz, H5′), 6.39 (1H, s, H8), 6.20 (1H, s, H6);13CNMR (125 MHz, CD3OD) δ: 158.8 (C2), 135.4 (C3), 179.4 (C4), 163.1 (C5), 99.9 (C6), 166.1 (C7), 94.7 (C8), 158.4 (C9), 105.6 (C10), 123.0 (C1′), 117.2 (C2′), 146.1 (C3′), 149.9 (C4′), 116.0 (C5′), 123.3 (C6′), 104.6 (C1″), 75.3 (C2″), 77.6 (C3″), 71.0 (C4″), 67.2 (C5″)。以上波谱数据与文献(Park et al,2012)报道的基本一致,故鉴定化合物3为槲皮素3Oβ吡喃木糖苷。697B9528-575B-4F9E-B926-7C77DA6C1103
化合物4褐色粉末。HRESIMS m/z: 433.3943[MH], 分子式C20H18O11。1HNMR (500 MHz, CD3OD) δ: 7.76 (1H, s, H2′), 7.56 (1H, d, J = 8.5 Hz, H6′), 6.87 (1H, d, J = 8.5 Hz, H5′), 6.38 (1H, s, H8), 6.18 (1H, s, H6), 5.14 (1H, d, J = 6.5 Hz, H1″);13CNMR (125 MHz, CD3OD) δ: 158.3 (C2), 135.6 (C3), 179.4 (C4), 162.9 (C5), 99.9 (C6), 166.0 (C7), 94.7 (C8), 158.7 (C9), 105.6 (C10), 122.8 (C1′), 116.2 (C2′), 145.9 (C3′), 149.9 (C4′), 117.5 (C5′), 123.0 (C6′), 104.7 (C1″), 72.9 (C2″), 74.1 (C3″), 69.2 (C4″), 67.0 (C5″)。以上波譜数据与文献(贾忠等,2009)报道的基本一致,故鉴定化合物4为槲皮素3OαL吡喃阿拉伯糖苷。
化合物5淡黄色粉末。HRESIMS m/z: 477.2977[MH], 分子式C22H22O12。1HNMR (500 MHz, CD3OD) δ: 7.91 (1H, s, H2′), 7.54 (1H, d, J = 8.5 Hz, H6′), 6.87 (1H, d, J = 8.5 Hz, H5′), 6.32 (1H, s, H8), 6.15 (1H, s, H6), 5.39 (1H, d, J = 7.0 Hz, H1″);13CNMR (125 MHz, CD3OD) δ: 158.2 (C2), 135.3 (C3), 179.2 (C4), 162.8 (C5), 99.8 (C6), 165.8 (C7), 94.8 (C8), 158.5 (C9), 105.6 (C10), 122.9 (C1′), 114.2 (C2′), 150.7 (C3′), 148.2 (C4′), 115.6 (C5′), 123.8 (C6′), 103.7 (C1″), 75.9 (C2″), 78.4 (C3″ ), 71.4 (C4″), 78.0 (C5″), 62.5 (C6″), 56.7 (3′OCH3)。以上波谱数据与文献(王羽等,2015)报道的基本一致,故鉴定化合物5为异鼠李素3Oβ葡萄糖苷。
化合物6淡黄色粉末。HRESIMS m/z: 609.1547[MH], 分子式C27H30O16。1HNMR (500 MHz, CD3OD) δ: 7.67 (1H, s, H2′), 7.62 (1H, d, J = 8.5 Hz, H6′), 6.86 (1H, d, J = 8.5 Hz, H5′), 6.39 (1H, s, H8), 6.20 (1H, s, H6), 5.10 (1H, d, J = 7.5 Hz, H1″), 4.52 (1H, s, H1), 1.12 (3H, d, J = 6.5 Hz, H6);13CNMR (125 MHz, CD3OD): δ 158.5 (C2), 135.6 (C3), 179.4 (C4), 163.0 (C5), 99.9 (C6), 166.0 (C7), 94.9 (C8), 159.3 (C9), 105.6 (C10), 123.1 (C1′), 116.1 (C2′), 149.8 (C3′), 145.8 (C4′), 117.7 (C5′), 123.6 (C6′), 102.4 (C1″), 75.7 (C2″), 78.2 (C3″), 71.4 (C4″), 77.2 (C5″), 68.6 (C6″), 104.7 (C1), 72.1 (C2), 72.3 (C3), 73.9 (C4), 69.7 (C5), 17.9 (C6)。以上波谱数据与文献(唐振球等,2017)报道的基本一致,故鉴定化合物6为芦丁。
4抗氧化能力的测定
4.1 黄花倒水莲花不同极性部位抗氧化能力测定
参照黄思思等(2016)的DPPH·自由基清除法并稍作调整,具体步骤如下。
DPPH·溶液的配制:精密称取DPPH·1.971 6 mg,用无水乙醇溶解定容至50 mL,摇匀得到0.1 mmol·g1的储备液。
样品溶液的配制:精密称取黄花倒水莲花不同极性部位的样品5 mg,加入95%乙醇超声溶解并定容至5 mL,摇匀得到1 mg·mL1的样品溶液。
测定:分别吸取不同体积的样品溶液于10 mL试管中(醇提溶液分别精密吸取80、100、120、140、160 μL;石油醚、乙酸乙酯和正丁醇萃取液分别精密吸取100、200、300、400、500 μL;水相分别精密吸取100、300、500、700、900 μL),加纯水定容至2 mL配制成一系列梯度的样品溶液,再分别加入2 mL的DPPH·储备液,混匀后在室温下避光反应20 min,于517 nm测定吸光值。
以样品浓度为横坐标,相应清除率为纵坐标,作出回归曲线,并计算出半数清除浓度(IC50值)。样品对DPPH·自由基的清除率可用以下公式表示:
清除率(%)= [A0 –(AsAc)]/A0×100。
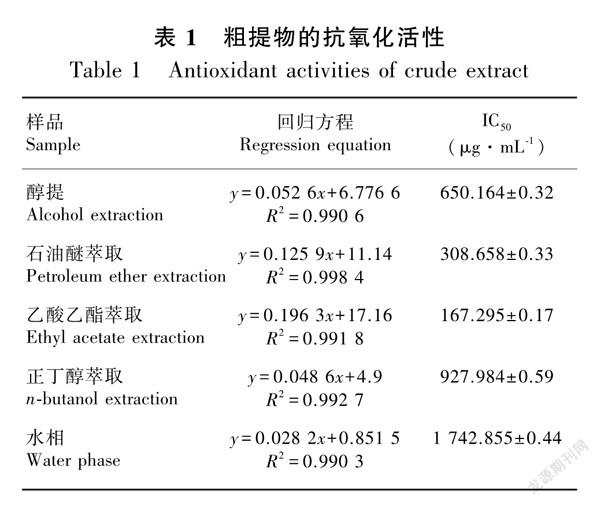
式中:A0为50%甲醇+2 mL DPPH·溶液的吸光度值;As为2 mL样品溶液+2 mL DPPH·溶液的吸光度值;Ac为2 mL样品溶液+2 mL 50%甲醇溶液的吸光度值。结果见表1。
由表1可知,黄花倒水莲花的不同极性部位对DPPH·自由基均具有不同程度的清除作用,其中乙酸乙酯萃取部位最佳(IC50为167.295±0.17 μg·mL1)。697B9528-575B-4F9E-B926-7C77DA6C1103
鉴于上述结果,对乙酸乙酯中分离鉴定出的6个黄酮苷化合物进行抗氧化活性测定。
4.2 黄花倒水莲花中化合物抗氧化能力测定
参照总抗氧化能力检测试剂盒方法(ferric reducing ability of plasma,FRAP法)步骤,对从黄花倒水莲花中分离得到的6个黄酮苷化合物进行抗氧化能力评价,具体步骤如下。
工作液配制:分别吸取3 000 μL TPTZ稀释液及300 μL TPTZ溶液,超声使其充分混匀后加入300hμL检测缓冲液,将其配制成FRAP工作液备用。
FeSO4标准溶液配制:精密称取139 mg的FeSO4·7H2O,超声溶解并用80%乙醇定容至5 mL,得到100 mmol·L1的标准品溶液。
化合物及Vc测试液配制:分别精密称取4 mg的各个化合物,加入80%乙醇超声溶解并定容至25 mL,得到0.16 mg·mL1的化合物溶液;精密称取3.0 mg的抗坏血酸(Vc)用80%乙醇超声溶解并定容至25 mL,得到0.12 mg·mL1的Vc溶液。
测定:96孔板中先加入180 μL TPTZ工作液,空白对照孔中加入5 μL 80%乙醇;标准曲线检测孔中加入5 μL不同浓度(0.15,0.3,0.6,0.9,1.2,1.5 mmol·L1)的FeSO4标准溶液;样品检测孔中加入5 μL各化合物及Vc溶液,在37 ℃下孵育5 min后,于593 nm测定其吸光值,实验重复3次。
以FeSO4浓度为横坐标,吸光度值为纵坐标做出回归曲线,得出以下回归方程:
y=0.278 5x+0.007 4,R2=0.991 4。
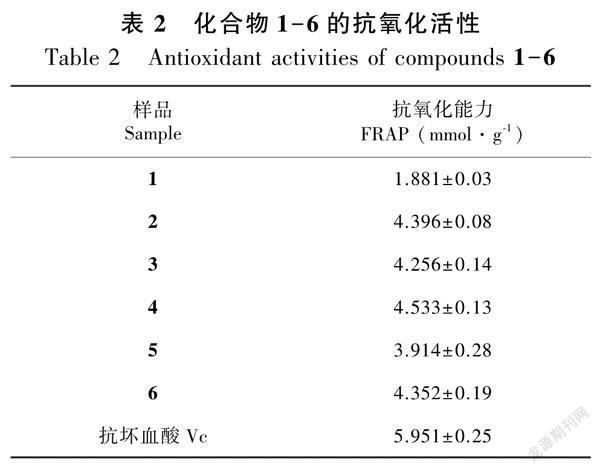
以Vc为阳性对照,样品的抗氧化能力用FeSO4标准溶液的浓度来表示,如样品的浓度为0.4 mg·mL1,测定得到的吸光度与0.8 mmol·L1的FeSO4标准溶液的值相同,则样品的总抗氧化能力可以表示为0.8 mmol·L1/0.4 mg·mL1,即2 mmol·g1。结果见表2。
由表2可知,除化合物1外,其余化合物均显示出较好的抗氧化活性,其FRAP值与Vc相当。通过抗氧化作用与结构关系分析,该类化合物中B环上3′,4′邻位羟基是抗氧化能力的关键基团,若3′位无取代基团(化合物1),则其抗氧化活性大大降低,若3′位上被-OCH3(化合物5)取代,则其抗氧化活性降低;而3位中糖类的种类和数量对抗氧化能力的贡献不大(俞文英等,2018)。
5討论与结论
目前,对于民族药黄花倒水莲的研究主要集中在其传统药用部位块根上,但尚无关于花、茎、叶等非药用部位的化学物质及生物活性研究。本研究利用多种色谱分离方法,首次从黄花倒水莲花中获得6个具有相同母核结构的黄酮苷类化合物,且其不同极性提取部位及化合物均具有不同程度的抗氧化活性。
黄酮及其苷类化合物是一类具有丰富药理活性和较高利用价值的植物次生代谢产物。紫云英苷(化合物1)对神经保护、抗癌、抗炎、抗溃疡等显示较好疗效(聂龙等,2020);槲皮素3OβD葡萄糖苷(化合物2)由于其对补体旁路途径的强抑制活性(AP50为0.580 mmol·L1),在治疗类风湿性关节炎等疾病具有广阔的应用前景(张姣等,2019);异鼠李素3Oβ葡萄糖苷(化合物5)能够抑制小鼠肺腺癌细胞LA795(10 μg·mL1)增殖(王羽等,2007),且其苷元可诱导细胞凋亡,抑制人肺腺癌细胞A549的生长(Zhu et al.,2005);芦丁(化合物6)不仅可以通过与胃蛋白酶结合,形成稳定的复合物,继而影响胃蛋白酶生物学功能,保护胃黏膜,而且能够抑制肝癌细胞HepG2的生长,诱发其凋亡(李玉山,2013)。此外,芦丁还具有抗疲劳、抗菌、降血压和抗脂质过氧化等活性(吴涛,2013)。结合本研究结果可知,黄酮苷类化合物应该是黄花倒水莲花中的主要活性成分之一。因此,本研究通过阐明黄花倒水莲非药用部位花的化学物质基础及其抗氧化活性,为进一步的黄花倒水莲花茶、速溶茶等产品开发利用提供科学依据,达到提高资源的综合利用目的。
参考文献:
CHEN JB, PAN WG, LUO P, et al., 2018. Research progress of Polygala fallax Hemsl [J]. AsiaPacific Tradit Med, 14(5): 86-89.[陈家宝, 潘为高, 罗彭, 等, 2018. 黄花倒水莲的研究进展 [J]. 亚太传统医药, 14(5): 86-89.]
DAI B, 2009. Chinese modern Yao medicine [M]. Nanning: Guangxi Science & Technology Publishing House: 613-618.[戴斌, 2009. 中国现代瑶药 [M]. 南宁: 广西科学技术出版社: 613-618.]
HUANG SS, NING DS, XIA MW, et al., 2016. Total phenolic content, antioxidant and antimicrobial activities from different parts of avocado Persea americana Mill. [J]. J Guangxi Acad Sci, 32(2): 151-155.[黄思思, 宁德生, 夏梦雯, 等, 2016. 油梨不同部位总酚含量、抗氧化及抗菌活性 [J]. 广西科学院学报, 32(2): 151-155.]
JIA Z, ZHANG PF, TAO BQ, et al., 2009. Study on flavones of the flower of Juglans regia [J]. Chin Pharm J, 44(7): 496-497.[贾忠, 张培芳, 陶保全, 等, 2009. 核桃花的黄酮类化学成分研究 [J]. 中国医学杂志, 44(7): 496-497.]697B9528-575B-4F9E-B926-7C77DA6C1103
LIU YP, HUANG CH, 2009. Treatment of56 cases of hyperlipemia with turbidity and stasis by Zhuang Tong Yin [J]. Shaanxi J Trad Chin Med, 30(2): 169-170.[刘燕平, 黄岑汉, 2009. 壮通饮治疗浊脂瘀阻型高脂血症56例 [J]. 陕西中医, 30(2): 169-170.]
LI M, 2014. Inhibition of isoproterenolinduced cardiac fibrosis in rat by quercetin and its glycoside derivative rutin [D]. Changchun: Jilin University.[李敏, 2014. 槲皮素及其糖苷衍生物芦丁对心肌纤维化的抑制作用及机制研究 [D]. 长春: 吉林大学.]
LIANG QC, ZHONG M, 2005. Chinese Zhuang pharmaceutical [M]. Nanning: Guangxi Nationalities Publishing House: 270-271.[梁启成, 钟鸣, 2005. 中国壮药学 [M]. 南宁: 广西民族出版社: 270-271.]
LIU QQ, ZHANG WN, LIU Q, 2016. Comparison studies on antioxidant capacities of flavonoids by different assays and the structureactivity relationship implication [J]. Sci Technol Food Ind, 37(23): 109-114.[刘庆庆, 张薇娜, 刘琴, 2016. 不同方法比较黄酮类化合物抗氧化性及其构效关系分析 [J]. 食品工业科技, 37(23): 109-114.]
LI YS, 2013. Progress on resources, pharmacological effect and major forms of rutin [J]. Amino Acid Biotic Resour, 35(3): 13-16. [李玉山, 2013. 芦丁的资源、药理及主要剂型研究进展 [J]. 氨基酸和生物资源, 35(3): 13-16.]
MEI YD, LI HB, WANG ZZ, et al., 2020. Glycosides from flower buds of Lomicera macranthoides [J]. Chin Trad Herb Drugs, 51(2): 287-292.[梅玉丹, 李海波, 王振中, 等, 2020. 灰毡毛忍冬花蕾中苷类化学成分研究 [J]. 中草药, 51(2): 287-292.]
NIE L, PENG L, LI YF, et al., 2020. Research advances in the biological activities and mechanism of Astragalin [J]. Chin J Trop Agric, 40(6): 64-70. [聂龙, 彭磊, 李钰芳, 等, 2020. 紫云英苷生物活性及其机制的研究进展[J]. 热带农业科学, 40(6): 64-70.]
PARK BJ, MATSUTA T, TSUTOMU K, et al., 2012. Phenolic compounds from the leaves of Psidium guajava Ⅱ. Quercetin and its glycosides [J]. Chem Nat Compd, 48(3): 477-479.
TANG ZQ, WANG XG, YANG BY, et al., 2017. Isolation and identification ofchemical constituents from fruits of Sambucus williamsii Hance [J]. Chin J Med Chem, 27(3): 225-229.[唐振球, 王新国, 杨炳友, 等, 2017. 接骨木果实化学成分的分离与结构鉴定 [J]. 中国药物化学杂志, 27(3): 225-229.]
WANG Y, ZHANG YJ, GAO WY, et al., 2007. Antitumor constituents from Paris polyphylla var. yunnanensis [J]. Chin J Chin Mat Med, 32(14): 1425-1428.[王羽, 張彦军, 高文远, 等, 2007. 滇重楼的抗肿瘤活性成分研究 [J]. 中国中药杂志, 32(14): 1425-1428.]
WU T, 2013. Study on antifatigue effect of rutin [D]. Xian: Shaanxi Normal University.[吴涛, 2013. 芦丁抗疲劳作用的实验研究 [D]. 西安: 陕西师范大学.]
YU WY, ZHANG HH, WU YG, et al., 2018. Structureactivity relationship of flavonoids and its application in pulmonary inflammatory diseases [J]. Chin Trad Herb Drugs, 49(20): 4912-4918.[俞文英, 张欢欢, 吴月国, 等, 2018. 黄酮类化合物的构效关系及其在肺部炎症疾病中的应用 [J]. 中草药, 49(20): 4912-4918.]697B9528-575B-4F9E-B926-7C77DA6C1103
ZHANG CL, ZHANG KF, XU YR, et al., 2017. Research progress on the chemical constituents and pharmacological activities of Polygala fallax Hemsl [J]. Chin Pharm, 28(19): 2724-2728.[张嫦丽, 张可锋, 许有瑞, 等, 2017. 黄花倒水莲的化学成分与药理活性研究进展 [J]. 中国药房, 28(19): 2724-2728.]
ZHANG BR, LIU L, LI XH, et al., 2020. Separation and content determination of chemical components of Yi medicine Di Wu Gong [J]. J Chin Med Mat, 43(4): 915-919.[张彬若, 刘录, 李晓红, 等, 2020. 彝药地蜈蚣中化学成分的分离及含量测定 [J]. 中药材, 43(4): 915-919.]
ZHANG J, DE J, FU AL, et al., 2019. Anticomplementary and antioxidant activities of constituents from Juniperus convallium [J]. Chin Trad Herb Drugs, 50(13): 3008-3016.[张姣, 德吉, 付爱玲, 等, 2019. 密枝圆柏的化学成分及其抗补体、抗氧化活性 [J]. 中草药, 50(13): 3008-3016.]
ZHU L, ZHOU LM, YANG CL, et al., 2005. Induction of apoptosis in lung cancer cells by isorhamnetin [J]. Chin Pharmacol Commun, 22(2): 37.
(責任编辑蒋巧媛)
收稿日期:2021-01-13
基金项目:广西创新驱动发展专项资金(桂科AA18118015); 中央引导地方科技发展专项资金(桂科ZY20111010)
第一作者: 李根(1995-),硕士研究生,研究方向为天然药物化学,(Email)ligen1048195659@163.com。
通信作者:宁德生,硕士,副研究员,研究方向为天然产物开发与利用,(Email)65392586@qq.com。697B9528-575B-4F9E-B926-7C77DA6C1103

