2个大豆VOZ转录因子的克隆及非生物胁迫表达分析
邬长乐,张军,何佳琦,李铭杨,于海伟,李珊珊,翟莹
2个大豆VOZ转录因子的克隆及非生物胁迫表达分析
邬长乐1,2,张军3,何佳琦1,2,李铭杨1,2,于海伟1,2,李珊珊1,2,翟莹1,2
(齐齐哈尔大学 1. 生命科学与农林学院,2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006;3. 黑龙江省农业科学院 畜牧兽医分院,黑龙江 齐齐哈尔 161005)
为探究大豆维管植物锌指蛋白(VOZ)转录因子的序列特征和非生物胁迫表达模式,采用实时荧光定量PCR对,在非生物胁迫下的表达量进行检测,并对其进行克隆及序列分析.,对干旱、高盐、低温胁迫均存在响应,且干旱胁迫下表达量升高最明显.位于大豆6号染色体上,位于大豆13号染色体上,分别编码含有478,459个氨基酸的蛋白质,它们均含有1个保守的VOZ结构域.GmVOZ1-1,GmVOZ1-2均含有1个核定位信号,预测均为细胞核蛋白.GmVOZ1-1与白羽扇豆LaVOZ的亲缘关系最近,GmVOZ1-2与蒺藜苜蓿MtVOZ的亲缘关系最近.
大豆;VOZ转录因子;非生物胁迫;表达分析
植物已经进化出复杂的调控网络,能够及时应对环境条件的变化.当植物遭受环境胁迫时,其体内的转录因子家族(如NAC,AP2/ERF,MYB,WRKY等)通过与顺式作用元件的特异性结合进而调控靶基因的表达[1].这种转录调控作用在植物抵御逆境及基因组信息表达过程中具有核心作用.维管植物锌指蛋白(Vascular plant one-zinc finger protein,VOZ)是植物中广泛存在且特有的一类转录因子,它们在植物进化过程中高度保守[2].VOZ转录因子最早发现于拟南芥中(,),它们与拟南芥基因启动子中的GCGTNx7ACGC回文序列区结合,调控花粉的发育[3]846-850.
近年来,VOZ转录因子在植物应对生物和非生物胁迫过程中发挥的作用逐渐被发现.过表达的转基因拟南芥对冻害和干旱胁迫的耐受性降低,但对真菌的耐受性提高[4].相反,,双突变体对非生物胁迫耐受性增强,但对生物胁迫的耐受性降低[5]761.后续研究表明,,还可以分别作为,的转录抑制子,介导植物响应热胁迫[6-7].水稻受干旱、高温、低温、高盐等多种逆境胁迫诱导表达,其超表达转基因植株对盐胁迫的抗性增强[8]23-46.此外,双突变体的铝胁迫抗性增强,它们可能作为转录因子的负调控因子参与水稻抗铝毒[9].盐、干旱、低温胁迫可以抑制菠萝,的表达[10]1228.
大豆是中国五大农作物之一,其抗逆基因的筛选和鉴定对大豆抗逆基因工程育种具有重要意义.大豆VOZ转录因子的非生物胁迫抗性研究尚未开展.本研究从在线数据库中获得2个大豆VOZ转录因子的基因序列,对它们的非生物胁迫表达模式及序列特征进行了探究,为基因的进一步功能鉴定及应用奠定基础.
1 材料与方法
1.1 材料与试剂
大豆种子(齐齐哈尔地区种植的北豆9号);大肠杆菌DH5菌株,根癌农杆菌EHA105菌株(齐齐哈尔大学植物分子育种研究室).
RNAiso Plus试剂,TB Green Premix ExⅡ酶,pMD18-T克隆载体(Takara公司);cDNA反转录试剂盒(Novoprotein公司).
1.2 实验方法
1.2.1 大豆幼苗非生物胁迫处理 使用沙土与草炭土(1∶1)的混合物种植大豆种子,7 d后移入Hoagland营养液中,水培至幼苗第1片三出复叶完全展开,进行干旱、高盐、低温处理.将幼苗移至20%的PEG8000营养液中进行干旱胁迫处理;移至200 mmol/L的NaCl营养液中进行高盐胁迫处理;移至4 ℃的培养箱中进行低温胁迫处理.处理过程中,分别在不同时间点剪取0.1 g第1片三出复叶,迅速置于液氮中保存备用.
1.2.2 基因表达量检测 使用RNAiso Plus试剂提取各时间点样品并反转录成第一链cDNA.以cDNA为模板,大豆为内参基因[11],使用TB Green Premix ExⅡ酶,通过实时荧光定量PCR(qPCR)检测VOZ基因的表达量.qPCR体系反应为:2×TB Green Premix ExⅡ酶 10 μL、cDNA 2 μL、上下游引物各0.8 μL,补水至总体积20 μL.反应参数设置为:95 ℃预变性30 s;95 ℃ 5 s,58 ℃ 30 s,共循环40次.qPCR引物的设计使用Primer Premier 5软件,引物序列见表1.所有处理进行3次重复,基因相对表达量的计算采用2-△△Ct法.

表1 qPCR和基因扩增引物序列
1.2.3 基因克隆 从植物转录因子数据库PlantTFDB(http://planttfdb.gao-lab.org/index.php?sp=Gma),NCBI数据库(https://www.ncbi.nlm.nih.gov/)搜索并下载大豆VOZ转录因子的基因及蛋白序列.使用Primer Premier 5软件设计,的基因扩增引物(见表1).以大豆叶片cDNA为模板,PCR扩增,的基因编码序列.PCR反应程序为:94 ℃ 8 min;94 ℃ 40 s,57 ℃ 40 s,72 ℃ 1 min,循环30次;72 ℃延伸8 min.回收PCR产物,连接pMD18-T克隆载体,然后送生工生物公司进行测序验证.
1.2.4 生物信息学分析 蛋白分子量及等电点的预测使用Expasy在线软件(https://web.expasy.org/compute_pi/);亚细胞定位的预测使用PSORT在线软件(https://www.genscript.com/psort.html);植物VOZ蛋白序列下载于NCBI数据库;蛋白序列的比对使用DNAMAN软件;蛋白系统进化树的构建使用MEGA5软件.
2 结果与分析
2.1 GmVOZ1-1和GmVOZ1-2干旱、高盐、低温胁迫表达分析
从PlantTFDB,NCBI数据库中获取2个大豆VOZ转录因子(Genebank登录号分别为XM003527355,XM006594138),分别命名为,,它们的功能均未被鉴定.实时荧光定量PCR结果见图1.由图1可见,,对干旱胁迫的应答最显著.干旱胁迫处理后,,的表达量迅速升高,的表达量在处理2 h时达到最大值,的表达量在处理1 h时达到最大值,分别达到对照0 h的220倍和106倍(见图1a).高盐胁迫处理后,的表达量先下降后升高,然后再下降,处理10 h时达到最大值,表达量为对照的2.2倍;的表达量在处理1 h后开始下降,处理24 h时表达量达到最低值(见图1b).低温胁迫处理后,,的表达量均升高,的表达量在处理5 h时达到最大值,表达量在处理24 h时达到最大值,分别达到对照的7.1,4.4倍(见图1c).
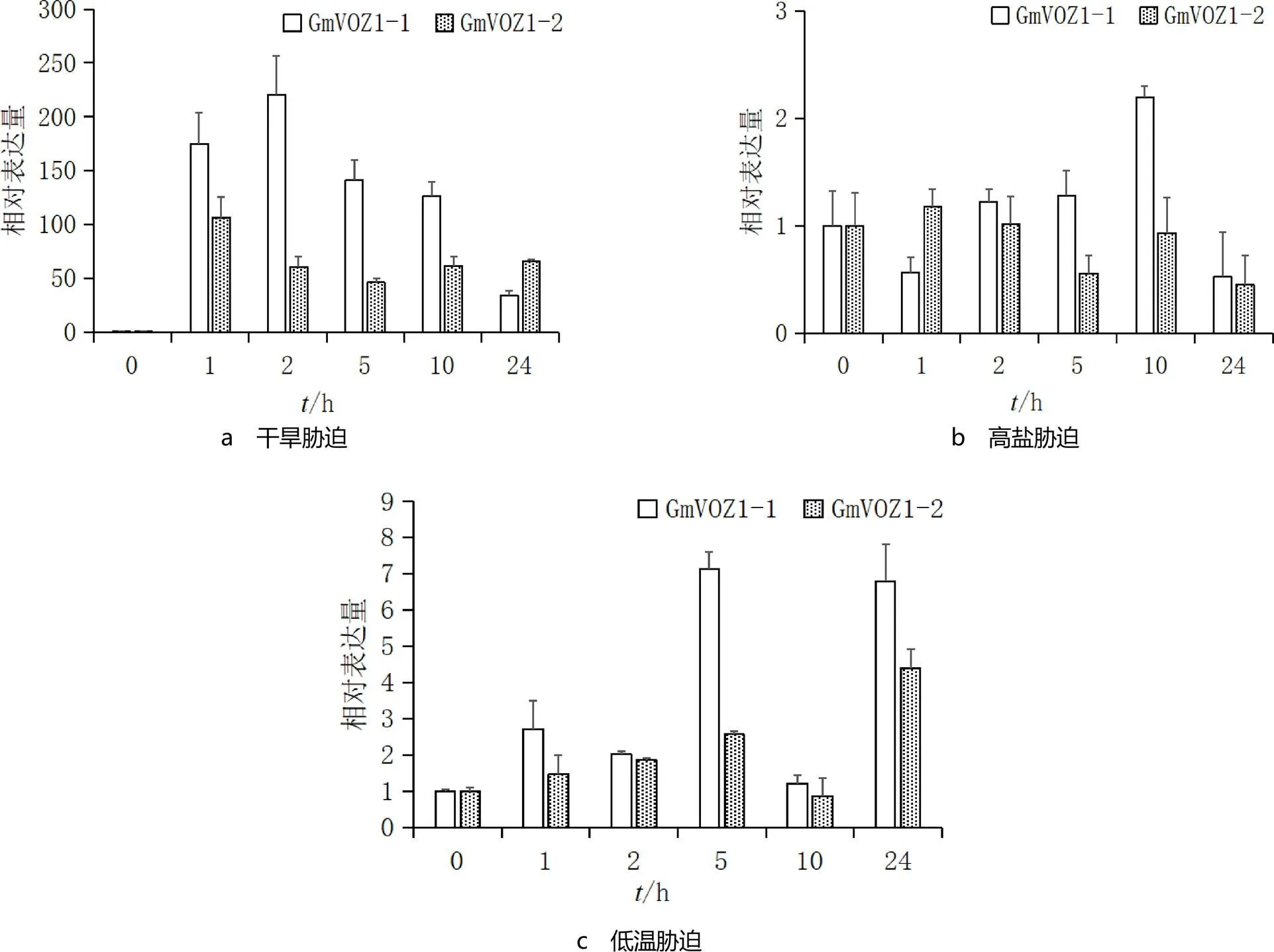
图1 GmVOZ1-1和GmVOZ1-2在干旱、高盐和低温胁迫下的表达
2.2 GmVOZ1-1和GmVOZ1-2克隆及序列分析
分别从大豆叶片cDNA中扩增获得1 437 bp的基因编码序列,1 380 bp的基因编码序列(见图2).将,分别与克隆载体连接后经测序验证,与NCBI数据库中登录序列一致.
位于大豆6号染色体上,位于大豆13号染色体上,它们分别编码含有478,459个氨基酸的蛋白质,分子量分别为54.02,51.16 kD,等电点分别为5.56,5.83.GmVOZ1-1,GmVOZ1-2的氨基酸序列相似度达到47.62%,它们均含有1个保守的VOZ结构域(GmVOZ1-1氨基酸序列的235-451位;GmVOZ1-2氨基酸序列的193-410位).亚细胞定位预测结果显示,GmVOZ1-1,GmVOZ1-2的VOZ结构域中均含有1个核定位信号,均为细胞核蛋白(见图3).

图2 GmVOZ1-1和GmVOZ1-2基因的PCR扩增
注:M为DNA分子量标记物2000;1为的PCR扩增;2为的PCR扩增.

图3 GmVOZ1-1和GmVOZ1-2的氨基酸序列比对
注:方框代表预测的核定位信号;下划线代表VOZ结构域.
2.3 GmVOZ1-1,GmVOZ1-2蛋白系统进化分析
将GmVOZ1-1,GmVOZ1-2与其它植物中的VOZ蛋白构建系统进化树,进化关系见图4.由图4可见,GmVOZ1-1与白羽扇豆LaVOZ的亲缘关系最近,GmVOZ1-2与蒺藜苜蓿MtVOZ的亲缘关系最近,这些VOZ蛋白均来自豆科植物.

图4 植物VOZ蛋白系统进化树
3 讨论
VOZ转录因子能够调控植物应答非生物胁迫已在拟南芥[4-7]、水稻[8-9]、菠萝[10]中得到鉴定.序列分析显示,GmVOZ1-1,GmVOZ1-2的氨基酸序列中均含有1个保守的VOZ DNA结合结构域,该结构域也具有蛋白质二聚化功能[3]846.转录因子一般定位在细胞核中行使转录调控功能.如齿肋赤藓具有核定位潜力及转录调控功能[12].在GmVOZ1-1,GmVOZ1-2的氨基酸序列中均预测到1个核定位信号,因此推测它们为细胞核蛋白.GmVOZ1-1与LaVOZ的亲缘关系最近,GmVOZ1-2与MtVOZ的亲缘关系最近,推测这2个同样来自豆科植物的VOZ转录因子也存在响应非生物胁迫的可能性.
,能够在大豆幼苗中应答干旱、高盐、低温胁迫,推测它们的启动子中应该含有与胁迫相关的顺式作用元件或与逆境相关转录因子的结合位点[13].,在非生物胁迫下的表达量均具有升高的趋势,尤其在干旱胁迫下它们的表达量升高非常明显,由此推测,在大豆中可能正调控非生物胁迫.这种调控方式前人也有报道,如水稻正调控水稻的盐胁迫抗性[8]46,拟南芥正调控拟南芥的盐胁迫抗性[14].此外,VOZ转录因子在植物生物胁迫响应途径中一般也发挥正调控的作用[4-5].VOZ转录因子对植物抗逆性的影响主要通过调控靶基因实现.如,对盐胁迫抗性的正调控是通过直接或间接的调控大量盐胁迫响应基因的表达实现的,但在低温胁迫下它们则负调控等逆境相关基因的表达[5]762-766.后续应进一步对,的转基因植物进行抗性鉴定,并探索它们在逆境信号网络中的作用及机制,从而丰富大豆抗逆基因资源.
[1] Yoon Y,Seo D H,Shin H,et al.The role of stress-responsive transcription factors in modulating abiotic stress tolerance in plants[J].Agronomy,2020,10(6):788.
[2] Yasui Y,Mukougawa K,Uemoto M,et al.The phytochrome-interacting vascular plant one-zinc finger1 and VOZ2 redundantly regulate flowering in[J].The Plant Cell,2012,24(8):3248-3263.
[3] Mitsuda N,Hisabori T,Takeyasu K,et al.VOZ:isolation and characterization of novel vascular plant transcription factors with a one-zinc finger from[J].Plant and Cell Physiology,2004,45(7):845-854.
[4] Nakai Y,Fujiwara S,Kubo Y,et al.Overexpression ofconfers biotic stress tolerance but decreases abiotic stress resistance in[J].Plant Signaling & Behavior,2013,8(3):e23358.
[5] Nakai Y,Nakahira Y,Sumida H,et al.Vascular plant one-zinc-finger protein 1/2 transcription factors regulate abiotic and biotic stress responses in[J].The Plant Journal,2013,73(5):761-775.
[6] Koguchi M,Yamasaki K,Hirano T,et al.Vascular plant one-zinc-finger protein 2 is localized both to the nucleus and stress granules under heat stress in[J].Plant Signaling & Behavior,2017,12(3):e1295907.
[7] Song C,Lee J,Kim T,et al.VOZ1,a transcriptional repressor of DREB2C,mediates heat stress responses in[J].Planta,2018,247(6):1439-1448.
[8] 谈存梅.水稻基因的克隆与功能分析[D].雅安:四川农业大学,2014.
[9] 朱海凤.水稻和荞麦抗铝毒转录因子ART1调控机制的研究[D].南京:南京农业大学,2016.
[10] 夏杨,苏初连,晁骏,等.菠萝VOZ转录因子序列特征及其对非生物胁迫的响应[J].西北植物学报,2018,38(7):1228-1234.
[11] Qiu S,Zhang J,He J,et al.Overexpression of,a soybean galactinol synthase gene,enhances transgenic tobacco drought tolerance[J].Plant Cell Tissue and Organ Culture,2020,143(3):507-516.
[12] 高贝,李小双,张道远.基于HMM的齿肋赤藓VOZ转录因子的预测与分析[J].生物信息学,2014,12(2):77-83.
[13] 孙孟思.拟南芥基因在非生物胁迫中的功能研究[D].长沙:湖南大学,2018.
[14] Prasad K,Xing D,Reddy A.Vascular plant one-zinc-finger (VOZ)transcription factors are positive regulators of salt tolerance in[J].International Journal of Molecular Sciences,2018,19(12):3731.
Clone and expression analysis of two VOZ transcription factors in soybean under abiotic stress
WU Changle1,2,ZHANG Jun3,HE Jiaqi1,2,LI Mingyang1,2,YU Haiwei1,2,LI Shanshan1,2,ZHAI Ying1,2
(1. School of Life Sciences,Agriculture and Forestry,2. Heilongjiang Provincial Key Laboratory of Resistance Gene Engineering and Protection of Biodiversity in Cold Areas,Qiqihar University,Qiqihar 161006,China;3. BranchofAnimalHusbandryandVeterinaryofHeilongjiangAcademyof AgriculturalSciences,Qiqihar 161005,China)
In order to investigate the sequence characteristics of VOZ transcription factors in soybean and their expression patterns under abiotic stress,the expression levels of,under abiotic stress were detected by real-time fluorescence quantitative PCR,and the gene cloning and sequence analysis were also carried out.,responded to drought,salt and cold stresses,and their expression levels increased most obviously under drought stress.was located on chromosome 6 of soybean and encoded a protein containing 478 amino acids.was located on chromosome 13 of soybean and encoded a protein containing 459 amino acids.The amino acid sequences of GmVOZ1-1,GmVOZ1-2 both contained a conserved VOZ domain.GmVOZ1-1 and GmVOZ1-2 both contained a nuclear localization signal,which were predicted to be nuclear proteins.GmVOZ1-1 was most closely related to LaVOZ of,and GmVOZ1-2 was most closely related to MtVOZ of.
soybean;VOZ transcription factor;abiotic stress;expression analysis
Q37
A
10.3969/j.issn.1007-9831.2022.06.014
1007-9831(2022)06-0080-05
2022-02-26
齐齐哈尔大学大学生创新创业训练计划项目(202110232163);黑龙江省省属高等学校基本科研业务费科研项目(145109506);齐齐哈尔大学研究生创新科研项目(YJSCX2020041)
邬长乐(2001-),男,河南信阳人,在读本科生.E-mail:wuchanglevip@icloud.com
翟莹(1982-),女,吉林省吉林人,教授,博士,从事大豆分子遗传育种研究.E-mail:fairy39809079@126.com

