AMG肌松监测仪关键参数范围的临床研究
【作 者】岑建,姚祖明,何宇翔,陶华,刘启翎,袁秋
深圳迈瑞生物医疗电子股份有限公司,深圳市,518057
0 引言
临床上肌松状态主要通过使用肌松药阻断神经肌肉接头处的兴奋传导来实现。肌松药的使用有利于减少气道损伤,提高插管质量,有效控制术中体动,减小肌肉张力,改善手术操作条件[1];但手术结束后,如拔管过早,肌松残余会影响肌力恢复[2],会导致呼吸肌功能障碍,引起上呼吸道梗阻与低氧血症[1]。
现阶段评估肌松消除程度唯一安全可靠的方法是定量肌松监测法[3-5],通过量化神经肌肉收缩程度,实现监测的客观性、实时性。其中加速度描记法(accelerometry,AMG)监测结果准确可靠,易用性好,被视为“临床金标准”[7],且该类监测仪体积小,人机连接简单,操作方便,适用于自由活动的肌肉,不易受外界环境干扰,在临床中被广泛应用[8]。
监测仪在临床中的正常使用,离不开对其关键参数临床范围的研究,这有助于确定产品检测范围,防范临床失效风险。本研究主要探讨AMG肌松监测仪在四个成串刺激(train of four stimulation,TOF)模式下监测拇内收肌运动关键参数(加速度峰值、响应时间、TOF比值(train of four stimulation ratio,TOFR))的临床分布范围。
1 AMG肌松监测仪工作原理
肌松监测仪包括两个部分:一部分是电刺激源,根据监测目的不同产生不同模式的电刺激,作用于外周神经;另一部分是传感器,通过检测、分析并量化刺激神经后的骨骼肌反应情况,从而将神经肌肉阻滞程度以数字形式呈现,以便临床医师评估[8]。
刺激模式主要包括如下四种刺激模式:单刺激(single-twitch stimulation,ST)、双重爆发刺激(double-burst stimulation,DBS,由两组频率50 Hz,间隔0.75 s的刺激组成[9])、强直刺激后计数(post-tetanic twitch count,PTC,由频率50 Hz持续5 s的刺激及间隔3 s后频率1 Hz的单刺激组成[10])、四个成串刺激(TOF,由四个频率2 Hz、间隔0.5 s的连续刺激组成[10])。其中TOF可全阶段监测药物起效、维持和消除情况,比ST敏感性更高,比DBS不适感更低,相比于PTC,可用于非深度阻滞的连续监测,所以TOF是临床中最合适的神经肌肉阻滞评估模式[10]。

图1 单刺激模式示意Fig.1 ST mode diagram

图2 双重爆发刺激模式示意Fig.2 DBS mode diagram

图3 强直刺模式示意Fig.3 PTC mode diagram

图4 四个成串刺激模式示意Fig.4 TOF mode diagram
检测方式主要有肌电描记法(electromyography,EMG)、肌机械描记法(mechanomyography,MMG)、加速度描记法(AMG)。其中MMG是评估神经肌肉阻滞程度的最准确、客观的标准方法,但由于这类设备体积庞大且使用复杂,未能得到广泛应用[10]。AMG监测法是基于牛顿第二定律“F=ma”,质量一定,力和加速度成正比,间接监测了该肌肉的收缩力的变化情况。AMG本质和MMG一样都是测量力,属于同类测量方式,但解决了体积与易用性问题,是临床中应用最广泛和认可度最高的肌松监测技术,也是肌松监测技术发展方向。
用AMG肌松监测仪进行监测时,电刺激源刺激外周神经,加速度传感器检测运动部位,将信号发送给监测仪[7],其典型信号如图5所示。可从中计算获得加速度峰值与响应时间。

图5 AMG加速度的典型信号Fig.5 Typical signal of AMG acceleration
本研究选用TOF模式进行肌松监测。使用TOFR,即第4个刺激加速度峰值T4与第一个刺激加速度峰值T1的比值(T4/T1)作为量化神经肌肉阻滞程度的指标[9]。
2 关键参数范围的临床试验设计
为得到AMG肌松监测仪的关键参数(加速度峰值、响应时间、TOFR)的临床分布范围,本实验结合常见临床中肌松监测过程,将监测过程分为起效平台期、起效期、维持期、消除期与消除平台期5个阶段,以便于数据选取,如图6所示。

图6 TOFR变化曲线Fig.6 TOFR variation curve
2.1 关键参数范围选取
加速度峰值:由于在使用肌松药物前与肌松药效消除后人体运动部位的加速度峰值最大,所以选择起效平台期与消除平台期数据。但在药物影响下两个阶段的神经肌肉反应情况存在差异,所以对比两个阶段的分布情况。
响应时间:观察发现在肌松各个阶段无明显差异,选择加速度峰值同时间的数据即可。
TOFR:最大最小值选择除维持期外整个监测过程的数据,维持期加速度最小值为0,无需统计,其中最大值选取起效平台期和消除平台期的监测数据,最小值选取退出起效期的最后一个数值和进入消除期的第一个数值。
2.2 病例选择
本研究纳入了2019年3月至2020年1月期间,中山大学附属第三医院、广州医科大学附属第二医院,以及江门市人民医院中在全身麻醉气管插管条件下行择期手术的患者。
入选标准:①在全身麻醉使用肌松药物进行气管插管条件下行择期手术;②American Society of Anesthesiologists(ASA)分级Ⅰ~Ⅱ级;③年龄18~60岁;④体重指数(body mass index,BMI)18~30 kg/m2;⑤无神经肌肉接头相关疾病既往史及家族史。
排除标准:①既往神经损伤或应用影响神经肌肉传导药物;②尺神经监测部位皮肤炎症、溃疡及其他明显外伤;③既往糖尿病、脑卒中、脑出血及椎间盘疾病;④严重心、肺、肝、肾功能障碍;⑤接受肌松要求高的手术或精细手术;⑥术中需要特殊体位;⑦医师认为不适合参与本次临床试验的患者。
脱落(剔除)标准:①患者要求退出研究;②校准失败≥2次;③监测过程中发现监测部位受压≥2次;④试验过程中出现严重手术麻醉相关不良反应。
2.3 试验方法
所有患者均无术前用药。患者入室后连接迈瑞BeneVision N12病人监护仪及其NMT模块,如图7所示。患者受测上肢外展、手心朝上固定于手臂支撑架,负电极粘贴于手腕皱襞近侧1 cm处、尺侧腕屈肌的桡侧,正电极粘贴于负电极近端2~3 cm处,确保电刺激跨越尺神经,加速度传感器固定于大拇指掌侧表面,用于监测拇内收肌的运动情况,皮肤温度探头置于掌心。采用布巾包裹方式维持监测部位皮肤温度≥32.5oC,以U形挡板使监测部位与术者、布巾等相隔,以免监测部位受压,保证监测部位运动不受阻碍。

图7 AMG监测仪连接示意Fig.7 AMG monitor connection diagram
由巡回护士建立上肢静脉通路,静脉滴注乳酸林格液10 mL/kg(第一个小时内),予面罩吸氧5 L/min。本次试验采取全凭静脉麻醉(total intravenous anesthesia,TIVA)方法。患者经去氮给氧3 min后开始诱导,经静脉给予咪达唑仑0.05~0.1 mg/kg、丙泊酚2.0~2.5 mg/kg、芬太尼2~4 μg/kg。待至患者意识消失后,启动肌松监测仪校准,获得超强电流及参考值。校准成功后,开始以TOF模式(频率2 Hz,间隔12 s)进行肌松监测,并静脉予肌松药物顺苯磺酸阿曲库铵0.2 mg/kg(4倍ED95),同时予面罩辅助通气。待TOFR下降到5%以下后,由麻醉医师评估患者咽喉肌肉松弛满意度,肌松满意后在可视喉镜辅助下进行气管插管。确认气管导管位置深度恰当,连接麻醉机行机械通气。机械通气模式采用容量控制模式,呼吸参数设定为潮气量8~10 mL/kg,呼吸频率12次/分,吸呼比1:2,PETCO2维持在35~45 mmHg(1 mmHg=0.133 kPa)。术中以丙泊酚和瑞芬太尼进行麻醉维持,采用靶控静脉输注(target control infusion,TCI)模式。丙泊酚初始血浆靶浓度为4~6 μg/mL,瑞芬太尼初始血浆靶浓度为4~8 ng/mL,术中根据血流动力学数据进行调整,每次调整幅度为±0.5 μg/mL(丙泊酚)或0.5 ng/mL(瑞芬太尼),维持NIBP波动不超过基础值±30%。
术中不继续追加肌松药物,直至监测部位TOFR≥90%(临床中将TOFR≥90%判断为神经肌肉传导功能已恢复[5-6])。试验结束后,可根据手术情况给予肌松药物或其他麻醉药物的追加,或进行拔管评估。
试验过程中记录以下数据信息:①一般情况:患者编号、年龄、性别、BMI、ASA分级及拟行手术类型由研究者采集并记录;②麻醉诱导开始时间、校准时间、刺激时间、给予肌松药物时间及试验结束时间由研究者采集并记录;③术中肌松监测:监测部位的TOF值(间隔12 s)、皮肤温度(间隔10 min)及相应时间点由迈瑞BeneVision N12病人监护仪自动采集并记录。
主要监测指标包括:加速度峰值、响应时间与TOFR值。
2.4 统计分析
(1)样本量计算:根据HEIER等[11]的报道,95%以上的受试者采用TOF模式在给药后TOF降至5%以下。预期本次临床研究中,99%以上的受试者采用TOF模式在给药后TOF降至5%以下,设定本临床研究中检验水准为0.01,检验效能为90%,假设试验中脱落率为20%,根据单组目标值法,本次试验样本量为200例。
(2)关键参数的正态分布检验采用Kolmogorov-Smirnov检验,符合正态分布采用均值±标准差(mean±SD)表示,不符合正态分布采用中位数(median[IQR])表示。
3 试验结果
本次研究共纳入病例213例,排除11例,进入试验共202例,其中中山大学附属第三医院97例,广州医科大学附属第二医院53例,江门市人民医院52例。剔除病例47例,其中监测部位运动受到阻碍致收集数据有误23例;手术提前结束致消除期数据空白19例;校准失败5例。最终纳入统计病例共155例,其中男性66例,占比42.58%;平均年龄(44±15)岁;平均BMI为(22.92±3.31)kg/m2;ASA分级、手术类型及其占比如表1所示。

表1 人口学资料Tab.1 Demographic characteristics
统计155例患者TOFR的平均变化趋势,加速度峰值分布与响应时间分布的结果来源于起效/消除平台期,TOFR均值分别为100.7%、96.9%,受肌松药物影响小,肌肉收缩正常,加速度最大。TOFR分布结果来源于除维持期外整个监测过程,期间TOFR出现明显变化。
3.1 加速度峰值分布范围
起效平台期的加速度峰值分布如图8所示。呈正态分布,平均加速度峰值(1.6±0.7)g,分布范围为0.3~4.0g。

图8 起效平台期加速度峰值分布Fig.8 Plateau of onset period acceleration distribution
消除平台期的加速度峰值分布如图9所示。由于消除平台期,部分病例受麻醉药物与意识状态影响,抽搐反应高度未能恢复到起效平台期水平,导致加速度峰值的低值成分增加,未呈现正态分布,中位值1.3g,分布范围为0.2~4.7g。结合起效与消除平台期结果,整体加速度峰值分布范围为0.2~4.7g。

图9 消除平台期加速度峰值分布Fig.9 Plateau of convalescence acceleration distribution
3.2 响应时间分布范围
起效平台期的响应时间分布如图10所示。呈正态分布,平均响应时间为(24.3±3.0)ms,分布范围在17.5~35.0 ms。
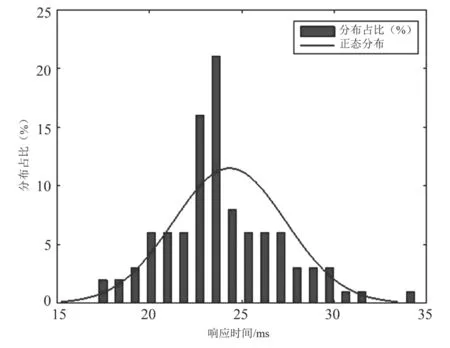
图10 起效平台期响应时间分布Fig.10 Plateau of onset period response time distribution
消除平台期的响应时间分布如图11所示。同样呈正态分布,平均响应时间(24.0±3.8)ms,分布范围在15.3~37.5 ms。结合起效平台期与消除平台期结果,整体响应时间分布范围在15.3~37.5 ms。
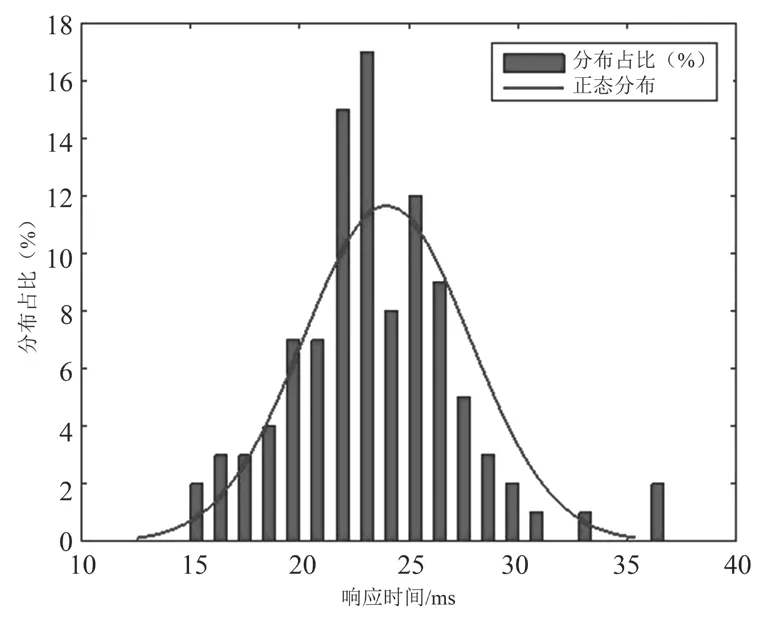
图11 消除平台期响应时间分布Fig.11 Plateau of onset period response time distribution
3.3 TOFR范围
肌松监测过程中,最大TOFR分布如图12 所示。呈正态分布,最大TOFR平均值(115.2±12.1)%,分布范围为86%~151%。

图12 TOFR最大值分布Fig.12 TOFR maximum value distribution
在肌松监测过程中,除维持期外的最小TOFR,分布如图13所示。在TOF模式下,当患者处于较深度阻滞时,T1通常低于校准参考值的10%~20%,且T4基本上已经消失,此情况下只能获取T1~T4的有反应的计数值,无法检测TOFR,因此可检测的最低TOFR为1%/20%=5%(其中T1最小值为1%,T4取20%),所以试验中TOFR=5%出现次数最多,未呈现正态分布,中位值11%,分布范围为5%~49%。结合最大、最小TOFR结果,整体TOFR范围为5%~151%。

图13 TOFR最小值分布Fig.13 TOFR minimum value distribution
4 小结
本研究介绍了定量肌松监测领域使用最多的AMG监测仪的原理,并招募患者在临床麻醉过程中对TOF模式下AMG监测仪的关键参数(加速度峰值、响应时间、TOFR)的范围与分布情况进行了试验研究,结果表明加速度峰值临床分布范围为0.2~4.7g、响应时间临床分布范围为15.3~37.5 ms、TOFR的临床范围为5%~151%。关键参数临床分布范围为肌松监测仪的研发和完善提供了实践依据。

