微生物γ-谷氨酰转肽酶分子改造合成γ-谷氨酰化合物的研究进展
杨娟,廖剑洪,郭晶,董浩,曾晓房,白卫东,梁景龙*
(1.仲恺农业工程学院 轻工食品学院,广州 510225;2.仲恺农业工程学院 现代农业工程创新研究院,广州 510225)
γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT,E.C.2.3.2.2)广泛存在于动物、植物和微生物中,主要参与谷胱甘肽(γ-Glu-Cys-Gly)的代谢循环,催化谷胱甘肽中的γ-谷氨酰残基转移至其他受体氨基酸或者肽类物质中,同时释放出半胱氨酸-甘氨酸肽,利于谷胱甘肽的分解代谢[1]。近年来,多种微生物源GGT被报道能够以谷氨酰胺和一些氨基酸、乙胺为底物,催化γ-谷氨酰肽、茶氨酸等γ-谷氨酰化合物的合成。这些产物中如γ-谷氨酰二肽、γ-谷氨酰含硫化合物等具有良好的鲜味、厚味,已被用于食品添加剂工业中;谷胱甘肽、茶氨酸和γ-谷氨酰-D-色氨酸等化合物具有一定的药用价值,可作为药物或者保健品而广受关注[2-3]。随着γ-谷氨酰肽及其衍生物应用研究的深入,越来越多的学者开始致力于从不同微生物中提取和纯化出多种GGT,用于酶法合成γ-谷氨酰化合物。
目前已有多种微生物的GGT被报道,如大肠杆菌(Escherichiacoli,EcGGT)、奇异变形杆菌(Proteusmirabilis,PmGGT)、幽门螺旋杆菌(Helicobacterpylori,HpGGT)、枯草芽孢杆菌(Bacillussubtilis,BsGGT)、地衣芽孢杆菌(Bacilluslicheniformis,BlGGT)和解淀粉芽孢杆菌(Bacillusamyloliquefaciens,BaGGT)等。其中,EcGGT和芽孢杆菌源GGT已经被用于多种γ-谷氨酰化合物的合成。但是,野生型GGT存在难以分离纯化、酶活力较低等问题,阻碍了GGT的工业化进程,同时也制约了γ-谷氨酰肽的大规模生产。因此,研究人员利用现代生物技术对野生型GGT进行异源表达和分子改造,以期提高GGT的产率、酶活和催化特性。本文对微生物来源GGT的催化特性、异源表达和分子改造等进行综述,以期为推动GGT合成γ-谷氨酰化合物的工业化提供理论参考。
1 GGT的催化特性
GGT在微生物体内以异源二聚体形式发挥作用,该酶属于N-末端亲核氨基水解酶类。GGT仅对含γ-谷氨酰残基的化合物(如谷胱甘肽、谷氨酰肽、γ-谷氨酰-对硝基苯胺等)有专一特性,催化过程涉及“Ping-Pong”机制,即GGT与γ-谷氨酰残基化合物结合,形成γ-谷氨酰-GGT中间产物,随后再与γ-谷氨酰受体作用释放出酶,合成γ-谷氨酰化合物[4-5]。
由图1可知,根据受体的不同,GGT可催化以下3种反应:①转肽反应:当受体是氨基酸(或二肽)时,形成γ-谷氨酰肽;②水解反应:当γ-谷氨酰受体是水时,形成谷氨酸;③自转肽反应:当中间产物与供体γ-谷氨酰化合物进一步作用时发生自转肽反应。3种反应中以催化转肽反应为主,对碱性氨基酸和芳香族氨基酸的亲和力最高[6];水解反应较为少见,通常在一定条件下,反应体系中不存在除γ-谷氨酰供体以外的其他底物,GGT可催化底物分子(如谷氨酰胺或者谷胱甘肽)中的γ-谷氨酰供体转移到水中形成谷氨酸;催化自转肽反应的过程,要求底物同时含有NH2基团和γ-谷氨酰基基团,在反应过程中底物既作为供体又作为受体[7]。

图1 GGT的催化反应类型
已报道的GGT在碱性pH值范围内(pH 8.0~11.0)均具有较高的催化转肽反应活力,酸性条件则利于水解反应。不同来源GGT的最适温度存在差异,最适温度范围通常在37~60 ℃之间,而多数GGT对温度的耐受性较差,如B.subtilisNX-2的GGT在60 ℃时酶活力仅能维持较短时间[8]。此外,金属离子如Ca2+、Mg2+、K+、Mn2+和Co2+对GGT酶活力也有一定影响。
2 GGT的微生物来源
GGT广泛存在于原核和真核生物中,在不同生物体中,其催化特性相似,但其分布位置存在显著差异。在真核生物中,GGT一般与糖类物质结合形成糖蛋白分布于细胞膜上;在原核生物中,GGT多以游离形式存在于其胞内或者胞外,因此微生物的GGT更易于被提取和纯化。对于GGT的研究始于日本京都大学的Suzuki等[9],他们从E.coliK12中分离出了GGT,并对其性质、结构、催化特性和催化产物进行了系列研究。大肠杆菌源GGT存在于细胞间质,分为两条亚基,酶活力为1.40 U/mg,耐碱性,可用于合成多种γ-谷氨酰化合物。此后,学者们开始致力于从不同微生物中分离出GGT。
由表1可知,目前已经在Saccharomycescerevisiae、B.subtilis168、B.subtilisNX-2、B.subtilisSK11.004、B.subtilis(natto)、B.amyloliquefaciensBH072、B.amyloliquefaciensSMB469、B.licheniformis、B.licheniformisER-15、B.pumilus、B.altitudinisIHB B1644、Helicobacterpylori、Geobacillusthermodenitrificans、P.nitroreducensIFO12694、Proteusmirabilis等微生物中分离出了野生型GGT,并对其酶分子量、酶活、最适合反应条件进行了测定[10-23]。GGT两个亚基分子量分别在38~64 kDa和19.7~32 kDa之间;酶活力为1.40~683.4 U/mg,最适pH多为碱性(8.0~10.0),最适温度为37~60 ℃,且对pH的稳定性高于对温度的稳定性。不同微生物来源的GGT酶活力存在显著差异,其中,大肠杆菌来源的GGT酶活力较低(约为1.40 U/mg),芽孢杆菌来源的GGT酶活力较高(在17.75~683.4 U/mg之间)。不同野生型微生物产GGT的酶活力大小存在着显著差异,因此,对于产GGT的野生型微生物的挖掘也成为众多学者重点突破的工作之一。
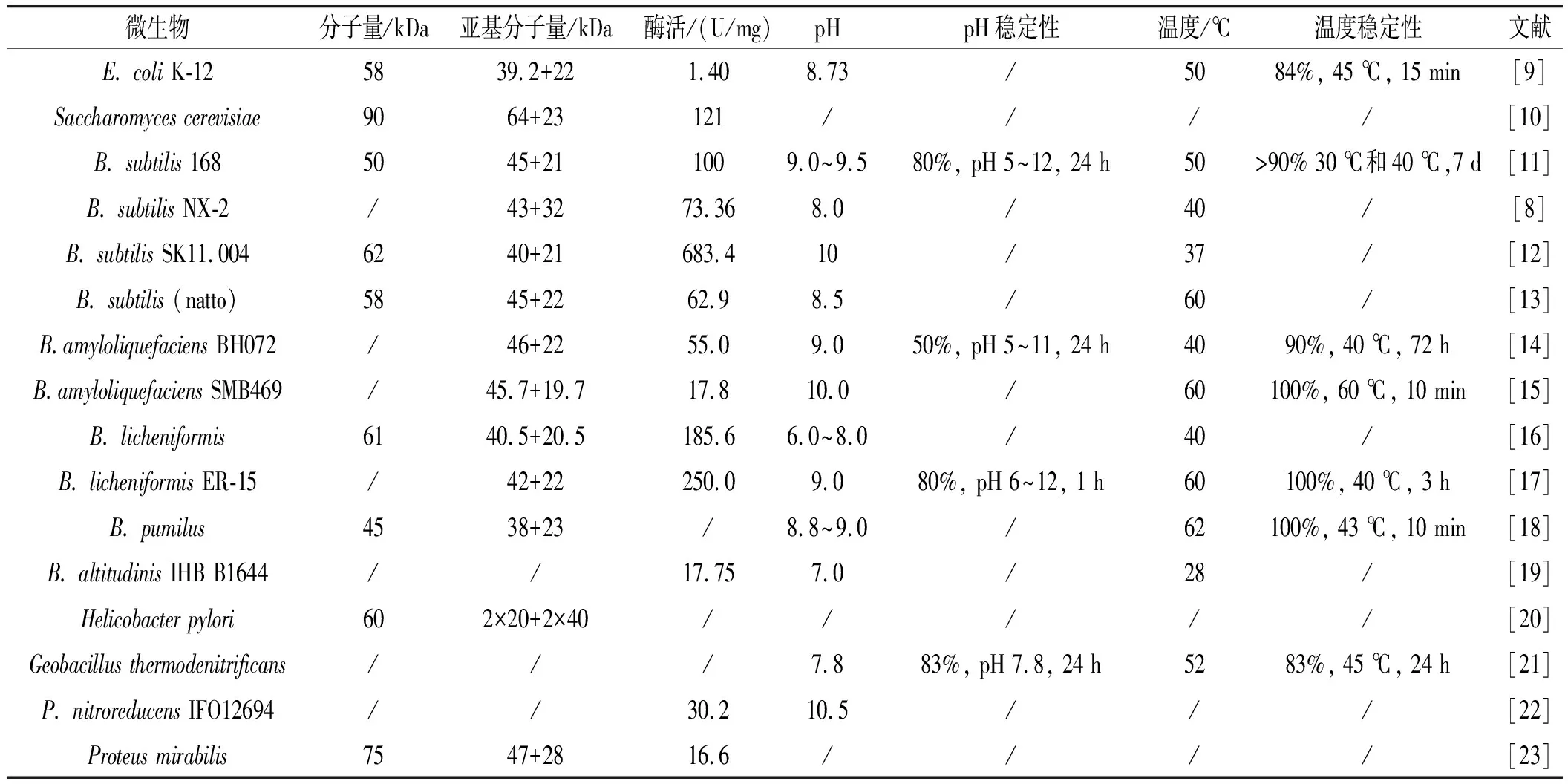
表1 不同微生物来源GGT的酶学性质
3 GGT的基因改造
鉴于微生物来源的GGT存在着诸如酶活力低、不利于分离提取等问题,众多学者致力于利用生物技术对野生型GGT进行改造。
由表2可知,目前针对GGT的改造主要包括克隆表达、随机突变和定点突变等方式,以实现高产量、高酶活或/和突出酶学性质的改变。
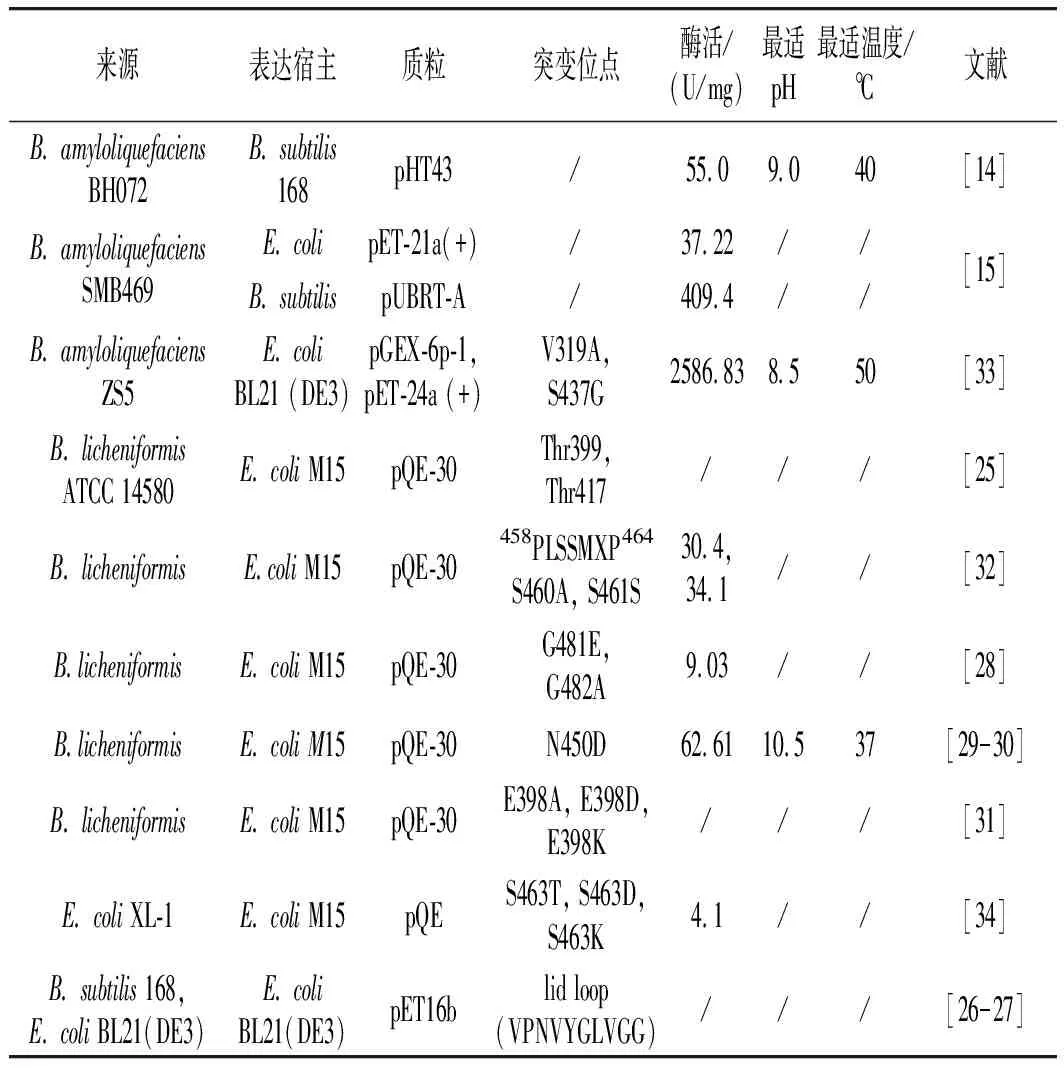
表2 GGT的基因改造
3.1 GGT的克隆表达
GGT主要被克隆到E.coli或者B.subtilis中实现大量表达。如Irene等[24]将B.subtilis168作为表达宿主,成功地将B.pumilusML413源GGT进行了克隆表达,并利用重组GGT生产茶氨酸;Lee等将B.amyloliquefaciensSMB469中的GGT分别转录到E.coli和B.subtilis菌中,得到的重组GGT酶活力分别提高了2倍和23倍;Mu等将B.amyloliquefaciensBH072转录到B.Subtilis168中表达,得到了相对更耐高温和耐碱性pH值的GGT,并将其用于合成茶氨酸。
3.2 GGT的随机突变和定点突变
多位学者通过随机突变和定点突变实验确定了微生物源GGT催化中心的关键氨基酸残基位置以及提高了重组GGT的催化特性。如Lyu等[25]将B.licheniformisATCC 1458菌源GGT的Thr399和Thr417进行随机突变,结果显示突变后的重组酶酶活显著降低,暗示了Thr399和Thr417残基序列为此酶催化的关键位点;Calvio等[26-27]研究了B.subtilis168和E.coliBL21(DE3)源GGT序列中一个覆盖谷氨酸结合位点的短序列(称为lid loop)对其催化效率的影响,通过定点突变可以降低其GGT的水解活性且提高其底物专一性;Chi等[28-32]通过随机突变和定点突变实验确定了B.licheniformis源GGT的氨基酸残基458PLSSMXP464、Asn450、Glu398、Gly481和Gly482对其酶活力大小具有重要的贡献,其中用Asp和Gln代替Asn450得到的重组GGT被用于合成茶氨酸,其转化率达到了94%;Li等[33]将一株来自海洋的耐盐B.amyloliquefaciensZS5的GGT进行了克隆和基因改造,通过定点突变将Val319和Ser437转变为Ala319和Gly437,获得了高酶活重组GGT,并用于合成茶氨酸,其产量从58%提高到83%。
综上所述,目前对于GGT的基因改造主要侧重于提高酶活力,而尚未见对GGT催化特性方面的改造应用。GGT催化γ-谷氨酰肽合成的最适pH为10.0,属于中强碱性范围,可能会导致底物的消旋反应,同时反应后需要大量的酸进行中和,使得产物中通常含有大量的钠盐离子,为后续的分离纯化带来麻烦;此外,多数GGT对碱性氨基酸和芳香族氨基酸更具有亲和力,对于酸性氨基酸和中性氨基酸的亲和力较差,因此,在后续的基因改造中,侧重于改造GGT的最适pH,或者对不同受体氨基酸选择性方面的改造,将减少反应过程中钠离子的引入,同时拓宽γ-谷氨酰肽化合物的合成范围。
4 GGT的生产应用
酶在发酵食品、调味品加工工业中已有广泛的应用[34-38]。尽管GGT可催化3种催化反应类型,但是多数GGT主要催化转肽反应,众多学者将经过分子改造产生的重组GGT用于合成γ-谷氨酰肽。包括各种γ-谷氨酰二肽、γ-谷氨酰肽衍生物、茶氨酸、聚谷氨酸、谷氨酸等。对GGT合成γ-谷氨酰化合物的情况进行了汇总,见表3。

表3 GGT的催化产物
4.1 谷氨酸的合成
谷氨酸是一种鲜味氨基酸[39],赋予食物鲜味[40],是酱油、蚝油等调味品中的主要呈味物质。在酱油等发酵调味品的生产中,可部分由谷氨酰胺酶[41]催化谷氨酰胺脱氨生成[42-43]。而此反应也可由GGT在一定条件下催化。GGT通常以催化转肽反应为主,经过基因改造,可以降低转肽活性,提高水解效果。Suzuki等通过定点突变将GGT残基Asp445用Ala替换,得到具有高水解活性的GGT突变体,并将其用于酱油发酵过程,其产品中谷氨酸的含量提高了36 mmol/L。此外,经过改造的GGT具有高耐盐性,在盐含量18%以内均具有较高的水解活性,可用于酱油发酵中谷氨酸的生成。有学者采用诱变技术选育高产菌株生产鲜味氨基酸也是一个值得参考的方向[44]。
4.2 L-茶氨酸的合成
L-茶氨酸(γ-谷酰基乙酰胺)是一种独特的非蛋白质氨基酸,分离于茶叶中,可以赋予茶鲜味。L-茶氨酸还具有多种生理功能,包括抗癌、抗肥胖、神经保护、缓解精神压力、提高学习能力和记忆力等。GGT是茶氨酸合成途径中的关键酶,它可以通过催化谷氨酰胺上的γ-谷氨酰基转移到乙胺受体上而合成茶氨酸。众多学者已经从多种微生物中分离GGT,经过改造后提高GGT催化茶氨酸的合成效率。如Bindal和Gupta[45]将B.licheniformisER-15的GGT编码基因转录到E.coliBL21进行表达,得到了可高产茶氨酸的GGT,产率高达85%~87%。Li等将B.amyloliquefaciens源GGT转录到E.coliBL21(DE3)中,得到了耐盐的重组GGT,同时提高了其催化茶氨酸的产率,使茶氨酸产率从58%提高到83%。Lin等利用定点突变实验将B.licheniformis源GGT进行改造,将Asn450分别改成Asp450和Gln450,以此提高GGT酶活力,得到的重组GGT催化茶氨酸合成产率高达94%。
4.3 含L-氨基酸的γ-谷氨酰肽
γ-谷氨酰肽是典型的厚味肽,可以作为食品添加剂增强食品的鲜味、浓厚味[46-47],广泛存在于大蒜、洋葱、豆类和发酵食品中。γ-谷氨酰肽也可以通过γ-谷氨酰转移反应合成,多以谷氨酰胺为γ-谷氨酰供体,游离氨基酸为受体,在GGT或者谷氨酰胺酶的催化作用下产生。Suzuki等[48-49]以支链氨基酸、碱性氨基酸和芳香链氨基酸为受体,通过E.coli源GGT合成了多种γ-谷氨酰肽,其合成的最佳条件通常为pH 10, 37 ℃,产物的最高产率可达到88%。Li等[50]利用B.amyloliquefaciens源GGT为催化剂,以猪血红蛋白和肉类蛋白为原料,经过蛋白酶水解得到γ-谷氨酰转移反应的供体和受体游离氨基酸,合成多种γ-谷氨酰肽,此方法解决了目前用于合成γ-谷氨酰肽原料昂贵的壁垒,有利于γ-谷氨酰肽商业化推广。
4.4 γ-D-谷氨酰基-L-色氨酸
γ-D-谷氨酰基-L-色氨酸(scv-07)在治疗结核病中可作为一种潜在有效药物,因此未来其在制药行业中的需求将会大大增加。以D-谷氨酰胺为γ-谷氨酰基供体,L-色氨酸为受体,其可在GGT的催化作用下合成[51-52]。此外,由于GGT催化γ-谷氨酰转移反应的过程中,对L-谷氨酰胺(Km=8.3 μmol/L)的亲和力远远高于D-谷氨酰胺(Km=278 μmol/L),因此如果使用D-谷氨酰胺代替L-谷氨酰胺作为γ-谷氨酰基供体合成γ-谷氨酰基肽副产物的含量将大幅下降[53]。
4.5 γ-谷氨酰肽衍生物
一些功能性的γ-谷氨酰肽衍生物如γ-L-谷氨酰-L-3,4-二羟基苯丙氨酸[54]、γ-Glu-Tau[55]和β-N-(γ-l(+)谷酰基)苯肼[56],由于在C端含有γ-谷氨酰残基而可以通过GGT被大规模合成。大蒜中的一些天然的味道增强剂,包括γ-EM, γ-Glu-S-allyl-Cys和γ-Glu-S-methy-Cys也以GSH作为底物通过GGT催化合成[57-58]。
5 总结
目前国内外对于GGT的开发和研究相对较少,已知的微生物来源GGT酶活力较低,GGT的分子改造也尚处于实验室阶段,未能满足工业化生产。目前市场对于“kokumi”味γ-谷氨酰肽的认可和需求逐年增加,但我国尚没有自主产权的酶资源。对于某些特定用途GGT的开发迫在眉睫,如提高GGT的催化专一性,降低GGT的最适pH值,提高酶催化效率等的研究均尚未见报道。后续需要大量投入相关研究,筛选高活性微生物来源的GGT,结合分子酶改造技术,提高GGT产量、转化率、耐温、降盐等特性,同时加强酶的生产工艺,为γ-谷氨酰肽低成本、高产量的工业化生产提供基础。

