谷氨酰胺代谢受损的巨噬细胞抑制内皮细胞的增殖和迁移
王 靖,白 皓,王新力,张思琦,王天吉,冯亚非,雷 伟
(空军军医大学西京医院骨科,陕西,西安 710032)
血管新生对于组织的损伤修复至关重要[1],而其本身也受到损伤周围环境等多种因素的调控[23]。其中,单核巨噬细胞在损伤早期即被募集到损伤周围,而再生修复阶段的巨噬细胞将分泌多种促血管生成因子调控血管新生,如碱性成纤维细胞生长因子、血小板源性生长因子等[4]。巨噬细胞的功能状态对于血管新生及组织的损伤愈合至关重要。研究表明,促炎表型(M1型)的巨噬细胞将抑制血管新生[5],而抗炎表型(M2型)的巨噬细胞则可通过分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)促进血管新生[6],但巨噬细胞调节血管再生的关键机制尚不清楚。
谷氨酰胺是血浆中最丰富的非必需氨基酸,是组织内重要的氮、碳和能量运输载体[7]。研究发现,巨噬细胞消耗大量的谷氨酰胺,谷氨酰胺代谢降低将影响巨噬细胞极化并导致炎性因子分泌增多,补充谷氨酰胺可以改善巨噬细胞促炎/抗炎表型失衡并抑制炎性因子的分泌,从而促进肌肉组织再生[810]。但谷氨酰胺代谢异常的巨噬细胞能否影响人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的增殖和血管新生功能尚不清楚。因此,本实验旨在明确谷氨酰胺代谢异常的巨噬细胞对HUVECs增殖、迁移和成管能力的影响,并初步探讨其机制。
1 材料和方法
1.1 材料
Esco Airstream生物安全柜(ESCO公司,新加坡);细胞培养箱(Thermo公司,美国);FLUOstar Omega全自动多功能酶标仪(BMG LABTECH公司,德国);HUVECs(赛百慷生物技术股份有限公司,中国);低糖DMEM培养液(Hyclone公司,美国);胎牛血清、CCK-8试剂盒(InCellGene公司,美国);巨噬细胞集落刺激因子(macrophage-colony stimulating factor,M-CSF)(PeproTech公司,美国);青霉素链霉素、胰蛋白酶、红细胞裂解液(碧云天公司,中国);TRIzol reagent(Invitrogen公司,美国);基质胶(Corning公司,美国);兔抗p-VEGFR2(Tyr1054+Tyr1059)、兔抗VEGFR2、兔抗p-Akt(Ser473)、兔抗Akt、兔抗α-Tubulin等一抗,山羊抗兔二抗等抗体(Cell Signaling Technology公司,美国);谷氨酰胺酶(glutaminase,GLS)flox(Glsf/f)小鼠和巨噬细胞特异性Cre(Lyz2-Cre)小鼠(上海南方模式动物有限公司,中国)。
1.2 方法
1.2.1 构建巨噬细胞特异性GLS敲除小鼠(Glsf/f;Lyz2-Cre小鼠) 将Glsf/f小鼠和Lyz2-Cre小鼠进行交配,即可获得Glsf/f;Lyz2-Cre小鼠。同胎出生的Glsf/f小鼠作为野生对照小鼠(wild type小鼠,WT小鼠)。
1.2.2 分离原代骨髓来源的巨噬细胞(bone marrow-derived macrophages,BMDMs) 6~8周的Glsf/f;Lyz2-Cre小鼠及WT小鼠,处死后于750 mL/L乙醇浸泡消毒5 min后,在超净台中分离小鼠股骨和胫骨,并用PBS冲洗出骨髓,1 000 r/min离心5 min后 ,用红细胞裂解液去除红细胞后,重悬于巨噬细胞培养液中(低糖DMEM培养基+20 μg/L M-CSF+100 mL/L胎牛血清+10 mL/L双抗)。诱导培养7 d后即为BMDMs。
1.2.3 制备BMDMs条件培养基(conditioned medium,CM) 不同组BMDMs经10 mL/L 胎牛血清的低糖DMEM培养基培养48 h后,收集培养上清,1 000 r/min离心5 min去除死细胞及细胞碎片后冻存于-80 ℃,以备后用。将培养Glsf/f;Lyz2-Cre小鼠BMDMs的CM表示为GLS KO-CM(GLS KO-CM组),WT小鼠BMDMs的CM表示为 WT-CM(WT-CM组)。
1.2.4 细胞增殖实验 将消化后重悬的HUVECs接种于6孔板或96孔板内,待细胞贴壁后更换为BMDMs CM(500 mL/L BMDMs培养上清+100 mL/L胎牛血清+10 mL/L双抗),37 ℃,50 mL/L CO2培养箱内培养24、48 h后:①6孔板经PBS洗涤2次后,利用光学显微镜进行图片采集;②96孔板每孔加入10 μL CCK-8溶液,将培养板在培养箱内孵育1~4 h后,用酶标仪测定每孔A450 nm值。
1.2.5 划痕实验 将消化后重悬的HUVECs接种于6孔板中培养,待细胞融合率达到100%时,用200 μL枪头在细胞层上进行划痕。用PBS洗2次后加入BMDMs CM(500 mL/L BMDMs培养上清+10 mL/L胎牛血清+10 mL/L双抗),37 ℃,50 mL/L CO2培养箱内培养,并于24、48 h用光学显微镜进行图片采集,并计算划痕距离。
1.2.6 HUVECs成管实验 预冷的枪头吸取50 μL左右的基质胶加入到96孔板中,置于37 ℃培养箱中孵育30 min,待其凝胶后,将消化重悬后的HUVECs按照1×104个/孔的密度接种到凝胶上,待细胞贴壁后更换为BMDMs CM(500 mL/L BMDMs培养上清+100 mL/L胎牛血清+10 mL/L双抗),37 ℃,50 mL/L CO2培养箱内培养4 h后利用光学显微镜进行图片采集并分析。
1.2.7 Western blotting检测 经不同处理后的HUVECs用PBS洗2次后提取蛋白,利用BCA法进行蛋白定量,并将样品煮沸10 min,使得蛋白样品变性。利用100 g/L SDS-PAGE凝胶进行蛋白电泳。蛋白样品按照10 μg/孔进行上样跑胶,结束后利用恒流湿转法进行转膜。转膜结束后,室温条件下利用50 g/L脱脂奶粉封闭1 h,之后孵育一抗[兔抗VEGFR2、兔抗p-VEGFR2(Tyr1054+Tyr1059)、兔抗Akt、兔抗p-Akt(Ser473)、兔抗α-Tubulin],一抗浓度均为1∶1 000。4 ℃条件下孵育过夜,之后加入山羊抗兔二抗(1∶5 000),在室温下孵育1 h后,进行化学发光并采集图像。利用Image J软件进行条带灰度分析。
2 结果
2.1 HUVECs增殖能力检测
为研究巨噬细胞谷氨酰胺代谢异常对于HUVECs增殖的影响,利用500 mL/L GLS KO-CM和WT-CM处理HUVECs 24、48 h后,对细胞进行图像采集并结合CCK-8法检测两组细胞A450 nm值以反映增殖情况。结果显示,经GLS KO-CM处理48 h后的HUVECs数量明显减少,细胞形态较WT-CM组更不规则(图1A);经GLS KO-CM处理24、48 h后HUVECs的A450 nm值较WT-CM组明显降低(P<0.05,图1B)。以上结果提示巨噬细胞敲除GLS将显著抑制HUVECs的增殖能力。
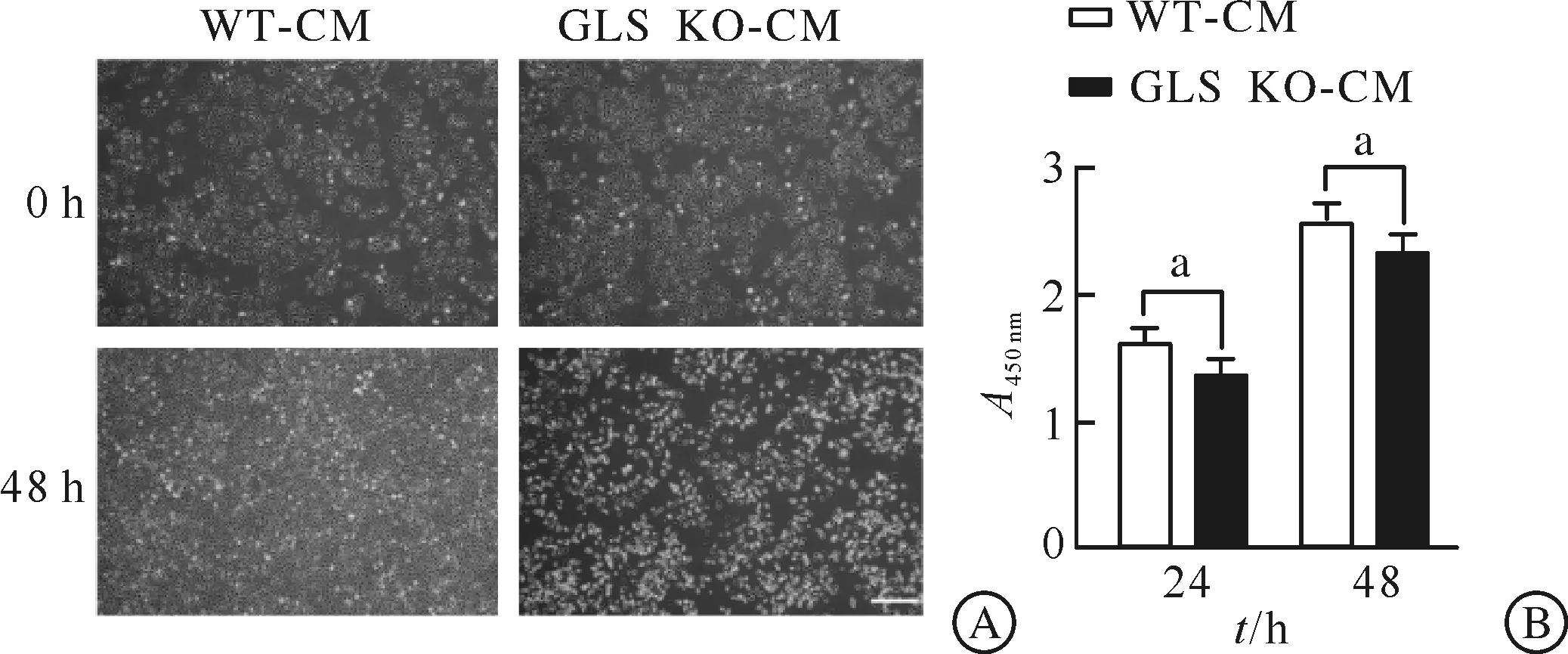
A:HUVECs增殖情况(标尺为100 μm,n=6);B:HUVECs CCK-8增殖实验A450 nm值(n=6,aP<0.05)。WT-CM:对照组巨噬细胞条件培养基;GLS KO-CM:GLS敲除的巨噬细胞条件培养基;HUVECs:人脐静脉内皮细胞。图1 HUVECs增殖实验结果
2.2 HUVECs迁移能力检测
利用划痕实验研究巨噬细胞谷氨酰胺代谢异常对于HUVECs迁移的影响(图2),结果显示,HUVECs细胞划痕经500 mL/L GLS KO-CM和WT-CM处理24 h后,GLS KO-CM组的细胞划痕愈合效率略小于WT-CM组(P>0.05),48 h后差异尤为显著(P<0.05)。以上结果提示巨噬细胞敲除GLS将显著抑制内皮细胞的迁移能力。

A:HUVECs0、24、48 h迁移图(标尺为100 μm,n=6);B:HUVECs迁移百分比统计图(n=6,aP<0.05)。WT-CM:对照组巨噬细胞条件培养基;GLS KO-CM:GLS敲除的巨噬细胞条件培养基;HUVECs:人脐静脉内皮细胞。图2 HUVECs迁移实验结果
2.3 HUVECs成管能力分析
利用成管实验检测不同BMDMs CM处理后HUVECs的成管能力(图3),结果显示,处理4 h后,GLS KO-CM处理组HUVECs在基质胶上形成的管腔数量明显少于WT-CM组(P<0.05,图3B),且形成的小管总长度也较WT-CM组显著减少(P<0.01,图3C)。以上结果说明巨噬细胞敲除GLS将抑制HUVECs的成管能力。
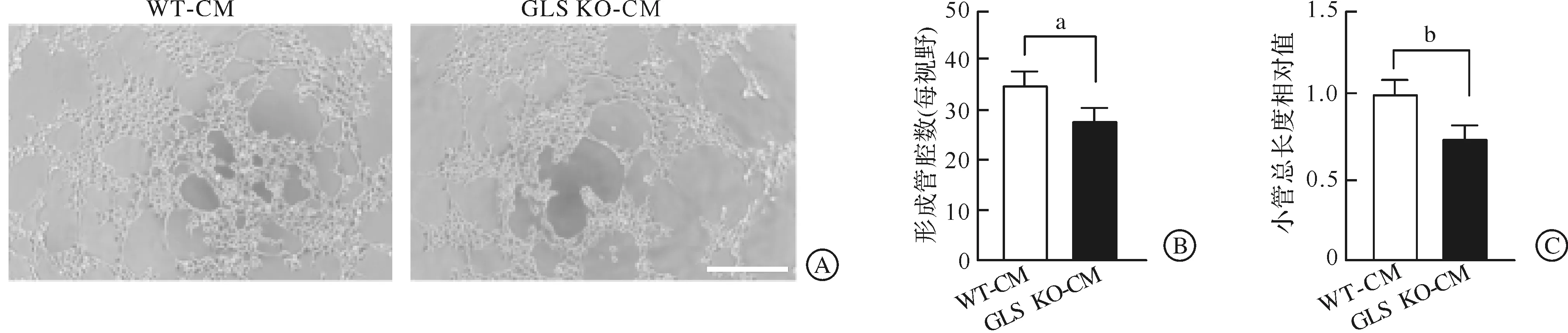
A:HUVECs 诱导成管4 h图(标尺为50 μm,n=6);B:+HUVECs成管过程中形成的管腔数量统计图(n=6,aP<0.05);C:HUVECs成管过程中形成的小管总长度相对值统计图(n=6,bP<0.01)。WT-CM:对照组巨噬细胞条件培养基;GLS KO-CM:GLS敲除的巨噬细胞条件培养基;HUVECs:人脐静脉内皮细胞。图3 HUVECs成管实验结果
2.4 巨噬细胞敲除GLS抑制HUVECs功能的分子机制
利用Western blotting检测HUVECs经不同BMDMs CM处理48 h后细胞中VEGFR2/PI3K/Akt通路的变化(图4),结果显示,GLS KO-CM处理的HUVECs中p-VEGFR2/VEGFR2比值较WT-CM组降低29.3%(P<0.05)、p-Akt/Akt比值较WT-CM组降低21.9%(P<0.05)。由此说明,敲除GLS的巨噬细胞可能通过分泌因子抑制HUVECs中VEGFR2/PI3K/Akt通路的表达从而抑制HUVECs的增殖与迁移。

A:HUVECs 中VEGFR2/PI3K/Akt通路蛋白表达情况(n=6);B:HUVECs中磷酸化VEGFR2(Tyr1054+Tyr1059)与VEGFR2的比值统计图;C:HUVECs中磷酸化Akt(Ser473)与Akt的比值统计图(n=6,aP<0.05)。WT-CM:对照组巨噬细胞条件培养基;GLS KO-CM:GLS敲除的巨噬细胞条件培养基;HUVECs:人脐静脉内皮细胞。图4 HUVECs信号通路检测实验结果
3 讨论
血管新生是指在现有血管网的基础上通过扩张从而形成新的血管,包括基底膜和细胞外基质的降解,内皮细胞增殖、迁移,出芽以及血管网的构建等一系列过程[11]。损伤发生后,巨噬细胞作为最先到达的反应细胞之一,在组织损伤愈合及血管新生过程中发挥着重要作用[12]。目前对于巨噬细胞极化影响血管新生的研究相对较多[3,13],但巨噬细胞代谢特别是谷氨酰胺代谢对血管新生的影响如何,目前尚不明确。
在本研究中,我们利用GLS KO-CM及WT-CM处理HUVECs,结果发现,与WT-CM组相比,GLS KO-CM处理的HUVECs增殖、迁移及成管能力明显受抑制,且HUVECs中促血管新生的VEGFR2/PI3K/Akt通路被抑制。由此证实,谷氨酰胺代谢受损的巨噬细胞可通过分泌因子抑制HUVECs中的VEGFR2/PI3K/Akt通路从而抑制HUVECs的增殖和迁移。
根据不同的表面标志及功能,目前普遍认为:M1型巨噬细胞因其分泌大量的炎性因子而导致组织愈合延迟,相反M2型巨噬细胞因分泌抗炎因子及促生长因子而促进组织愈合与再生[14]。巨噬细胞中的谷氨酰胺经GLS分解为谷氨酸,后者在谷氨酸脱氢酶的作用下进一步分解为α酮戊二酸并参与三羧酸循环,从而实现糖回补[15]。有研究显示,抑制巨噬细胞谷氨酰胺代谢将导致巨噬细胞向M1促炎表型转化,从而分泌大量的炎性因子,而补充谷氨酰胺及其代谢产物如α酮戊二酸将促进巨噬细胞向M2型极化[16]。在胶质母细胞瘤中,M2型巨噬细胞可以促进血管生成,M1型巨噬细胞则抑制血管生成[3],这与本研究结论相一致,即抑制巨噬细胞谷氨酰胺代谢导致巨噬细胞倾向于促炎表型而明显抑制HUVECs的增殖、迁移和成管功能,且这种效应与HUVECs中促血管新生的VEGFR2/PI3K/Akt通路受抑制有关[1718]。
综上所述,本研究揭示了谷氨酰胺代谢在巨噬细胞调控血管新生过程中扮演的重要角色,该结果将为改善组织损伤愈合过程中血管新生的探索提供新的思路。

